磁共振扩散加权成像检查在宫颈癌诊断中的应用效果
高瑞芳,孟砺实,严建春
(镇江市第四人民医院<镇江市妇幼保健院>放射科 江苏 镇江 212001)
宫颈癌是女性群体中一种常见的生殖系统恶性肿瘤,近年来,宫颈癌发病群体呈年轻化趋势。宫颈癌病因较多,包括HPV感染、初产年龄小、多孕多产及营养不良等。阴道不规则流血、经量增多、白带夹杂血丝等是宫颈癌患者常见症状表现,严重损害患者的身心健康,降低日常生活及工作质量。手术治疗、放疗、化疗等是临床治疗宫颈癌的常用方法,但只有I~Ⅱa宫颈癌患者适合接受手术治疗,大部分中晚期患者仅能选择以同步放化疗为主的综合疗法[1]。因此,早期诊断宫颈癌并明确具体分期是本病临床治疗的关键。磁共振扩散加权成像(diffusion weighted imaging,DWI)技术是当下能观察到活体组织中水分子扩散情况的唯一无创手段,其在脑部疾病及全身良恶性病变诊断领域已经得到广泛应用。本研究旨在对比MRI常规序列检查及联合DWI检查的情况,利用数据证实DWI用在疾病临床诊断中意义,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2019年1月—2020年12月间镇江市第四人民医院收治的68例宫颈癌患者的资料。选择同期60例在本院进行检查的非宫颈癌患者为对照组。纳入标准:①符合《妇产科学(第8版)》宫颈癌诊断标准;②经病理检查确诊为宫颈癌患者;③年龄范围18~65岁。排除标准:①有妇科手术史者;②安装心脏起搏器者;③合并精神类疾病者;④入组前进行放、化疗者;⑤临床资料不完整或中途退出者等。患者年龄30~64岁,平均(47.85±8.45)岁;BMI 20~25㎏/m2,平均(22.04±2.01)㎏/m2;FIGO 2018分期[2]:I期者21例,Ⅱ期者18例,Ⅲ期者15例,IV期者14例。对比术后病理结果,68例宫颈癌患者中均为鳞癌,其中高分化29例,中分化24例,低分化14例。
对照组年龄28~65岁,平均(48.51±8.57)岁;BIM 20~26㎏/m2,平均(22.87±2.15)㎏/m2。两组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究符合《赫尔辛基宣言》要求。
1.2 方法
采用uMR560型1.5T MRI设备(上海联影公司)扫描四通道相控阵体线圈。检查前嘱患者饮水500 mL,使膀胱处于适度充盈状态,对于体内有节育环者,要先对其进行取环术。检查过程中叮嘱患者保持仰卧位姿势不动,头先进,进行自由呼吸。从左右双侧髂骨翼上缘扫描到双侧股骨颈,认真观察整个盆腔内部状况,侧重检查肿瘤外形、大小,阴道及邻近器官等的受累状况。①MRI常规序列检查。采用单次激发快速自旋回波序列(single shot fast spin echo,SSFSE)进行矢状位T1WI、T2WI(脂肪抑制)扫描,横轴位、冠状位T1WI、T2WI、T2WI(脂肪抑制)扫描。扫描参数TR、TE、矩阵、视野(field of vision,FOV)、层厚及层距对应值分别是440/3 800/153 ms、15/75/65 ms、360×260、300、4.0 mm、0.8 mm。②DWI检查。采用单次激发平面回波成像序列(echo planar imaging,EPI)进行横断位成像。扫描参数:TR 4 500 ms,TE 80 ms;矩阵360×260;FOV 300 mm;层厚4.0 mm,层距0.8 mm;b值800 s/mm2。表观扩散系数(apparent diffusion coefficient,ADC)值测量:将b值为800 s/mm2扩散加权成像(diffusion weighted imaging,DWI)序列上的图像输入联影后处理工作站后处理得到ADC图。对宫颈癌组取ADC图上低信号区的最大层面病灶;健康组宫颈随意3处测量ADC值,随后取3次测量的平均值作为对照组的ADC值。
1.3 观察指标
将手术病理检查结果作为“金标准”,由2名长期从事影像诊断的医师采用双盲法共同完成阅片。意见不同时,邀请第3名医师一起商讨后达成统一结论。①分别计算MRI常规序列、DWI序列及二者结合三种不同检查方法下的灵敏度、特异性。②对比不同病理级别宫颈癌DWI序列的ADC值。
1.4 统计学方法
使用SPSS 22.0统计软件进行数据处理。符合正态分布的计量资料采用(± s)表示,两组间比较行t检验,三组间比较行F检验;计数资料用频数(n)和百分率(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 DWI、MRI单独诊断及联合诊断的效能比较
联合诊断灵敏度、特异度、准确度、阳性及阴性预测值分 别 是98.53%(67/68)、96.67%(58/60)、97.10%(67/69)、98.31%(58/59),高于DWI单独诊断的83.82%(57/68)、85.00%(51/60)、86.36%(57/66)、82.26%(51/62),差异有统计学意义(χ²=3.524、3.454、3.154、3.487,P=0.042、0.044、0.045、0.041);高于MRI常规序列诊断的79.41%(54/68)、81.67%(49/60)、83.08%(54/65)、77.78%(49/63),差异有统计学意义(χ²分别为4.021、3.954、3.754、4.414,P分别为0.036、0.041、0.043、0.032)。见表1及图1。
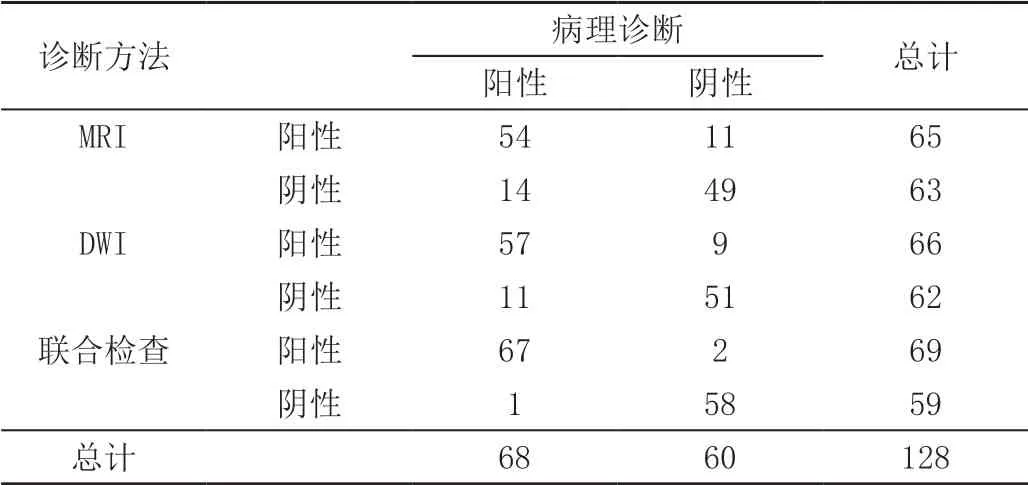
表1 DWI、MRI常规序列单独诊断及联合诊断的效能对比 单位:例
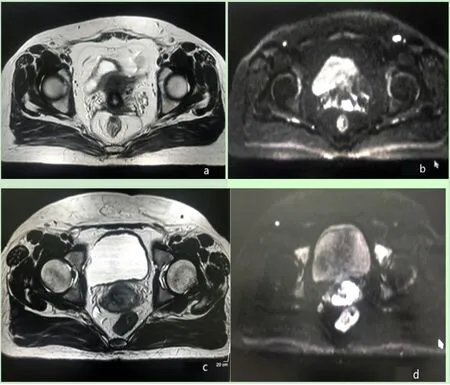
图1 不同病理级别宫颈癌MRI T2WI及DWI序列信号对比
2.2 两组ADC值比较
伴随宫颈癌病理级别的升高,其恶化程度呈现出增加的趋势,ADC值逐渐下降,差异均有统计学意义(F=161.257、145.23,P<0.05),见表2及图2。
表2 不同病理级别宫颈癌ADC值比较( ± s)
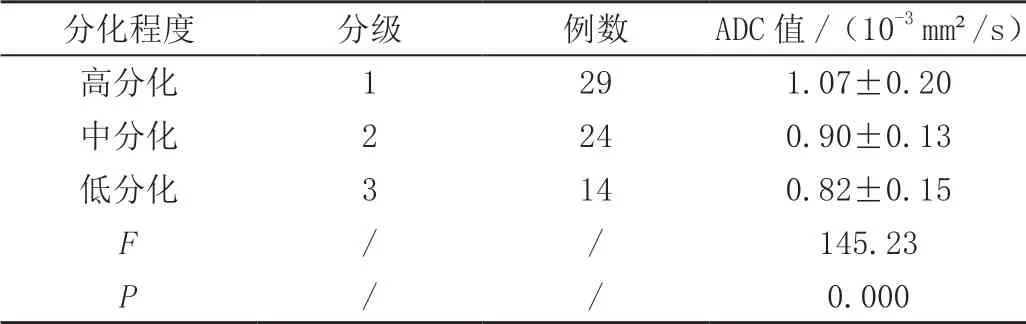
表2 不同病理级别宫颈癌ADC值比较( ± s)
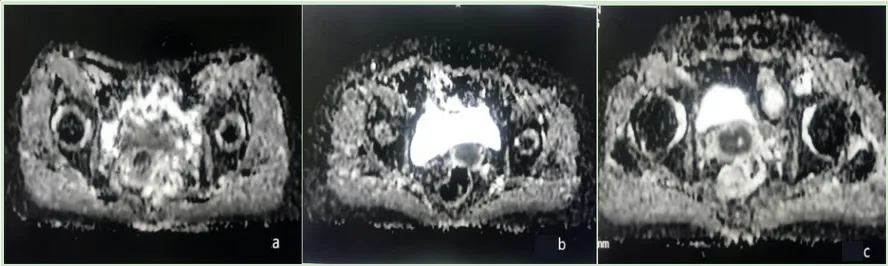
图2 不同病理级别宫颈癌测量ADC值示例
3 讨论
宫颈癌是女性生殖系统内一种常见的原发性恶性肿瘤,具有一定侵袭性,随着疾病病程的进展,可能会破坏宫颈壁进而侵犯宫旁、宫体以及阴道等,并不断向两侧累及盆腔。疾病晚期时可能会累及膀胱、直肠等脏器或者发生远处转移。FIGO分期是当下宫颈癌常用的临床分期形式,宫颈癌诊断以妇科检查、组织活检或者细胞学检查等为主,但难以客观评估宫体、宫旁及周围脏器等的受累情况,且即便是明确临床分期也不能精准掌握宫颈癌的实际恶化情况。肿瘤的病理类型、细胞分化、肿瘤微循环及对药物的敏感性等诸多因素均影响着肿瘤疾病的治疗效果,通过影像学检查对宫颈癌患者预分期,能够协助临床医生出个体性更强的治疗方案。
正常宫颈在T1WI上会表现出均匀稍低信号,无显著分层。而在T2WI能够分清3层结构:内带就是黏膜层,和子宫内膜连接、延续,呈显著高信号;中间带又被叫做基质环,和宫体的结合带相互延续,相对较厚,是子宫肌内层,含水量最低,呈显著的低信号;外带是子宫肌外层,偏薄,整体呈现出中等信号。绝经以后的老年女性宫颈在T2WI上只会表现出均匀单一的低信号,分层模糊[3]。T1WI上宫颈癌病灶以等信号为主,其和周边组结构之间基本不会形成差异或差异极小,漏诊的风险较高。但是在T2WI上的大部分病灶表现出为稍高或高信号,且病灶周边存在着低信号的宫颈基质也有助于病灶的检出率,使MRI成为检出病灶的常用手段。然而,一些处在Ia、Ib期的微小病灶,特别是处于宫颈上段的微小病灶,在T2WI上没有表现出较强的信号,且在宫颈周围脂肪组织、宫颈管黏膜及内分泌物等的影响下,会显著增加探查到以上这些病灶的难度[4]。
随着临床医疗及计算机技术的发展,DWI检查手段被开发,其能够提供形态学外和肿瘤细胞组织及细胞膜完整性等有关的功能参数信息,协助临床医生更快速的发现肿瘤,更全面的阐述肿瘤特征,是常规MRI检查的重要补充手段,DWI的基本原理是:DWI的物理基础是水分子于媒介内作布朗运动,不管对于哪种序列的MRI,如果把一对方向互逆,作用强度、持续时间等同的扩散敏感梯度场添加到180°脉冲两侧,则能顺利得到DWI图像。在梯度场作用下,弥散水分子内的横向磁化形成相位位移,若水与体素中呈自由弥散,那么该处失相,信号下降;相反,如果水自由弥散受到一定限制,则很少出现失相位情况,信号偏高。弥散状态不同的水分子会生成不同的DWI强度,基于不同的信号强度形式被呈现出来,生成具有组织对比的DWI图像。由于DWI检查技术有成像快速、图像清晰度高、检查时间较短暂等特征,故而患者及其家属的接受度较高。因为恶性病变组织中的细胞数量显著增加,对细胞外水分子的自由弥散运动过程起到一定限制作用,故而此时DWI呈现出的是高信号,和低信号或等信号的宫颈组织之间形成鲜明对比,从而凸显出宫颈癌组织,提升宫颈癌疾病的临床检出率[5]。
本研究显示,常规MRI、DWI联合检查的灵敏度、特异度、准确度、阳性及阴性预测值分别是98.53%、96.67%、97.10%、98.31%,高于DWI单独诊断的83.82%、85.00%、86.36%、82.26%,MRI诊 断 的79.41%、81.67%、83.08%、77.78%,差异均有统计学意义(P<0.05)。表明常规MRI、DWI联合诊断的效能更高。分析原因:①MRI对宫颈癌的组织分辨率较好,但是常规MRI序列无法区分直径<3 mm的肿瘤,IA2期肿瘤局部可见。常规MRI检查基础上配合阴道内线圈MRI技术,有益于提高小浸润性宫颈癌定位的精准度[6]。②DWI单独检查诊断时,血流灌注等因素可能会影响DWI信号。③MRI、DWI联合诊断,能使两种影像学技术实现优势叠加,通过科学分析水分子运动状况及血流动力学特征等,显著提升疾病的临床诊断效能,与国内既往部分报道结论相一致[7]。
DWI能够清晰地呈现出水分子在活体组织内的扩散特性,ADC值为其形成的一项重要定量参数,全面呈现出成像体素中的布朗运动情况,和肿瘤细胞的密度之间形成较高的相关性。国内外学者均指出,DWI以及ADC值能更加精准的区分宫颈位置的良恶性病变[8]。本研究结果显示,高分化组ADC值是(1.07±0.20)×10-3mm²/s,高于中分化组(0.90±0.13)×10-3mm²/s及低分化组(0.82±0.15)×10-3mm²/s,差异有统计学意义(P<0.05)。提示宫颈癌患者ADC值显著降低可能和宫颈癌病理特征之间存在相关性,随着肿瘤分级的提高,细胞分化能力逐渐降低,大部分宫颈癌细胞生长增殖旺盛、数量较多、细胞密度较大,将越来越多的正常宫颈上皮细胞代替,进而造成肿瘤细胞外容积降低,水分子弥散过程受限,且大分子物质强化了水分子的吸附能力,对细胞生物膜形成较大的限制,最后使宫颈癌病灶DWI呈现显著高信号,ADC值下降。此外,既往有学者在研究中指出,ADC值能够提供MRI检查时无法显示出来的感兴趣区,其提示的参数信息能协助临床医生更精准的鉴别宫颈癌的病理类型及病灶特点[9]。
大量研究证实,细胞密度是影响肿瘤内水分子扩散运动的一项主要因素,当恶性或者良性肿瘤发生恶变时,通常表现为细胞数目增多,核异型性增加,且细胞呈现出显著的多形型特征,还能观察到多核与巨核细胞等。以上因素共同作用均可能造成细胞密度增加,细胞外间隙密度变得窄小,继而导致ADC值下降。而当性肿瘤的细胞密度普遍较低时,细胞外间隙相对较大,核异型性不足,ADC值会偏高。细胞密度不单纯是影响肿瘤内水分子扩散运动情况的一项主要因素,也是当下临床判断肿瘤患者预后的一项常用指标。宫颈癌肿瘤细胞密度和病理级别之间存在正相关,表明ADC值与病理级别之间存在负相关性,证实ADC值能为测评宫颈癌恶性程度提供较可靠的间接性依据[10]。
综上所述,采用MRI常规序列+DWI联合诊断宫颈癌患者,能明显提升病灶的检出率,同时应用DWI序列计算出的ADC值可以协助临床手术前无创评估肿瘤分期,为疾病诊疗方案提供可靠依据,值得推广。

