小黑杨PsnbHLH35 转录因子基因功能分析
董立本,王爽,姜廷波,周博如
(东北林业大学林木遗传育种国家重点实验室,黑龙江 哈尔滨 150040)
植物在生长过程中会遇到各种不良的环境因子,对其生长发育产生影响[1]。土壤中可溶性盐分过多,地球干旱和半干旱地区近一半的土地受盐碱化影响,因此盐胁迫已经成为影响植物生长及产量的重要因素之一[2]。在高盐环境的胁迫下,植物会受到渗透胁迫和离子毒害[3],还会进一步受到氧化胁迫和营养胁迫[4]。这一系列反应会影响细胞的生长代谢,进而影响种子萌发、幼苗生长与作物产量[5]。植物为抵抗高盐环境在形态、代谢及分子水平上进化出复杂的应对机制,如关闭气孔、减少叶片数和叶面积、Na+和Cl-外排及区隔化和活性氧清除等[6-7]。当受到高盐胁迫时,植物激活转录因子转录并调控下游基因表达以应对胁迫的影响[8]。在植物中有许多应答盐胁迫的转录因子家族[9],比如NAC、NFY、HSF、bZIP、MYB、bHLH、ERF 和WRKY 等。
bHLH 是主要存在于真核生物中的一类碱性螺旋-环-螺旋类转录调控因子[10],在植物体内部是除了MYB 家族外最大的转录因子家族。bHLH家族的成员具有两个不同功能的保守结构域,分别是氨基末端的DNA 结合域以及羧基末端HLH结构域[11]。bHLH 转录因子可在植物中起到多种作用,如植物的生长发育[12-13]、合成次生代谢产物[14]、激素信号转导[15-17]以及植物器官形态建成等。另外bHLH 家族基因也参与植物响应非生物胁迫过程。例如,在烟草中过表达NtbHLH123可以通过激活氧化酶NtRbohE的表达来提高其耐盐性[18]。苹果MdCIB1基因在干旱胁迫下发挥正调控 作 用[19]。甜菜bHLH113、bHLH137在 盐 胁 迫12h 后表达量均明显上调,且蛋白互作分析结果表明甜菜中与盐胁迫应答有关的基因可能参与了ABA 逆境信号转导,进而调控甜菜在盐胁迫下的生长发育[20]。
小黑杨(Populus simonii×P. nigra)是速生丰产人工林广泛种植树种之一,从黑龙江省至黄河流域均可栽植[21]。因其生长速度快、对环境适应性强、材质好且抗逆能力优异[22],是东北地区的推广品种。本研究对小黑杨PsnbHLH35基因进行克隆,通过生物信息学分析的方法构建系统发育树、鉴定PsnbHLH35保守结构域。同时对该基因在盐胁迫条件下的时空表达模式、蛋白的亚细胞定位与自激活活性进行研究。为小黑杨抗逆分子育种提供重要依据。
1 材料与方法
1.1 植物材料
试验材料小黑杨来自东北林业大学林木遗传育种国家重点实验室。在(25±2)℃,相对湿度60%~70%下培养1 个月,选择健壮的组培苗,用流水将根部培养基洗净,在水中继续培养1 个月,用0.15 mol·L-1NaCl 溶液分别处理0、3、6、12、24、48h 且每个时间点进行3 次生物学重复,用于分析盐胁迫下bHLH35基因的组织表达差异。
1.2 试验方法
1.2.1 构建pMD19-T-PsnbHLH35 载体
使用试剂盒提取小黑杨总RNA,并将其反转录为cDNA。在Phytozome 数据库中查找杨树bHLH35基因序列并以此设计小黑杨PsnbHLH35引物bHLH35-F、bHLH35-R(表1),以反转录得到 的cDNA 为 模 板,bHLH35-F 和bHLH35-R 为引物,进行PCR 扩增[23]。将目的条带回收后,把pMD19-T 载体、反应缓冲液和胶回收产物按照相应体系混合,构建pMD19-T-PsnbHLH35 载体并送至生物公司检测。测序结果正确的菌液提取pMD19-T-PsnbHLH35 质粒。
1.2.2PsnbHLH35启动子生物信息学分析
通过CTAB 方法提取小黑杨的DNA,调取毛果杨中bHLH35基因上游约1600 bp 的启动子序列,参考选取的毛果杨bHLH35启动子序列设计引物QDZ-bHLH35-F、QDZ-bHLH35-R(表1),以小黑杨的DNA 为模板进行PCR 扩增。将启动子构建于pMD19-T 载体并送测。使用Plant CARE 数据库预测PsnbHLH35基因启动子序列中的顺式作用元件。

表1 PsnbHLH35 基因引物Table 1 Primers for PsnbHLH35 gene
1.2.3PsnbHLH35基因的生物信息学分析
利用ExPASy(http://web. expasy. org /protparam/)中Protparam 程 序 分 析PsnbHLH35氨 基酸 的 理 化 性 质[23];使用SignalP 5.0(https://ser-vices. healthtech. dtu. dk/service. php? SignalP-5.0)预测PsnbHLH35氨基酸信号肽;通过SOMPA(https://npsa-prabi. ibcp. fr/cgi-bin/npsa_automat. pl? page=npsa_sopma. html)分 析Psnb-HLH35蛋白的二级结构;最后利用在线软件SWISS model(https://swissmodel.expasy.org/interactive)预测PsnbHLH35蛋白的三维结构。
1.2.4PsnbHLH35同源序列比对
利 用PlantTFDB(http://planttfdb. gao-lab.org/)查找bHLH 家族氨基酸序列,查找文献选取bHLH 家族中与bHLH35相似度高的蛋白序 列[11]与PsnbHLH35序列进行多序列比对,使用MEGA X 绘制Neighbor-Joining Tree 进化树[24]。用DNAMAN 查找比对蛋白序列的保守结构域。
1.2.5PsnbHLH35转录因子自激活活性分析
根据测序正确的PsnbHLH35基因序列设计带有EcoR Ⅰ和BamH Ⅰ酶切位点的引物,bHLH35-BD-F、bHLH35-BD-R(表1),以构建好的pMD19-T-PsnbHLH35 质粒为模板进行PCR扩增,构建pGBKT7-bHLH35 载体并送去生物公司测序。提取测序正确的pGBKT7-bHLH35 质粒并将其转入Y2H 酵母感受态细胞,涂于SD/-Trp培养基中后放入30 ℃恒温培养箱中培养。3 d 后挑取单菌落在SD/-Trp/-His/-Ade/X-α-Gal 培养基上划线,放入30 ℃恒温培养箱中培养3 d,并观察其生长情况。
1.2.6PsnbHLH35蛋白亚细胞定位
根据已经测序成功的PsnbHLH35基因的ORF 全长去除终止子序列设计加入Spe Ⅰ酶切位点的引物bHLH35-GFP-F、bHLH35-GFP-R(表1)。以提取的pMD19-T-PsnbHLH35 质粒为模板进行PCR 扩增,将PCR 产物回收用于构建pBI121-bHLH35-GFP 载体并将其送往生物公司测序。测序结果正确的菌液提取重组质粒pBI121-bHLH35-GFP。 将 pBI121-bHLH35-GFP 质粒与pBI121-GFP 质粒分别转入GV3101农杆菌感受态细胞中。获得的菌液经处理后分别注射到3 周龄的健康本氏烟草叶片中,在温度25 ℃、空气湿度为70%的条件下继续暗培养24~48 h。将注射后的烟草叶片置于激光共聚焦显微镜下观察,得到PsnbHLH35在细胞中的表达部位。
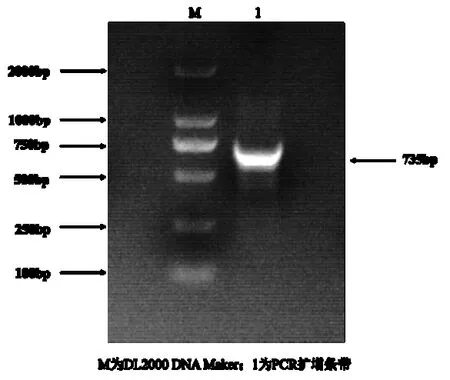
图1 小黑杨PsnbHLH35 基因PCR 扩增Fig.1 PCR amplification of PsnbHLH35 gene
1.2.7PsnbHLH35组织表达特异性分析
取小黑杨组培苗,在相对湿度60%、光照16 h/暗处理8 h、温度25 ℃的条件下水培1 个月。用0.15 mol·L-1NaCl 处理0、3、6、12、24、48 h 后将根、叶用液氮速冻-80℃保存。
用CTAB 法提取处理后的样本RNA 并进行反转录。根据PsnbHLH35基因的序列信息,在非保守结构域处设计荧光定量引物qPCR-bHLH35-F、qPCR-bHLH35-R,以Actin-F、Actin-R 为内参引物(表1),进行荧光定量PCR,并将结果用2-ΔΔCt算法处理。
2 结果与分析
2.1 pMD19-T-PsnbHLH35 载体构建
以小黑杨cDNA 为模板,克隆PsnbHLH35序列,扩增出长度为735 bp 的条带,胶回收后将回收产物连接pMD19-T 载体,测序结果正确,-80 ℃保存。
2.2 PsnbHLH35 启动子及基因生物信息学分析
2.2.1PsnbHLH35启动子顺式作用元件预测
以小黑杨的cDNA 为模板,克隆PsnbHLH35基因。以小黑杨的DNA 为模板经PCR 反应扩增克隆出bHLH35基因上游1600 bp 的启动子序列。经Plant CARE 预测后,得知bHLH35基因的启动子序列中除去核心启动子元件外,还包含其它胁迫应答元件(表2),说明PsnbHLH35可能与植物应答胁迫相关。
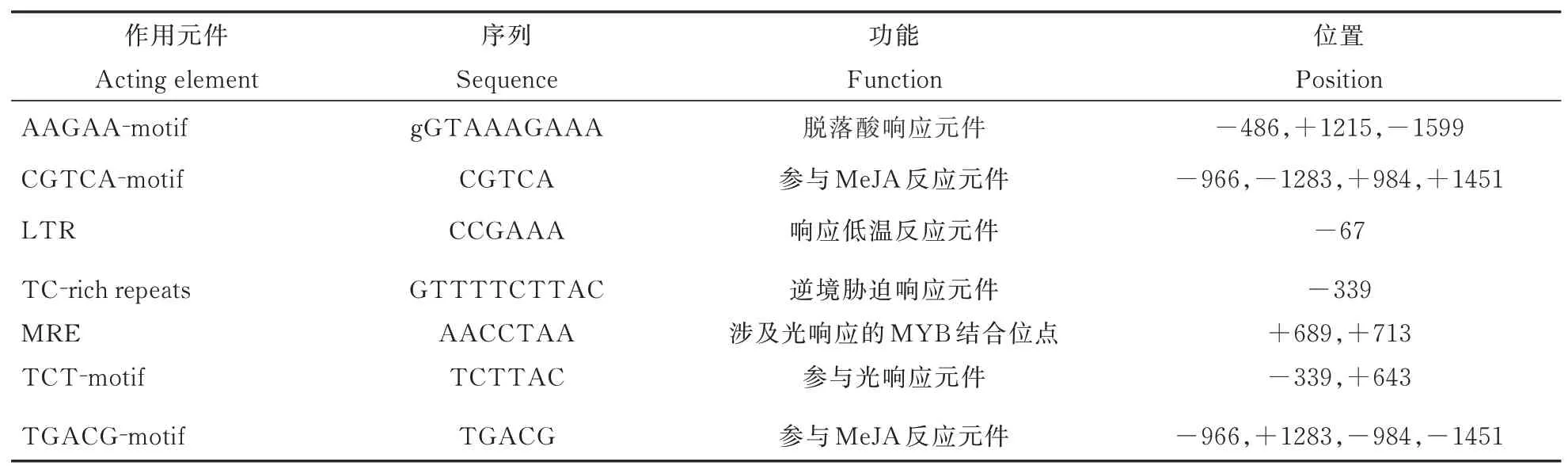
表2 PsnbHLH35 启动子克隆序列分析Table 2 Cloning sequence analysis of PsnbHLH35 promoter
2.2.2PsnbHLH35蛋白的理化性质使用ExPASy ProtParam 预测分析,Psnb-
HLH35编码蛋白大小244 aa,其分子式为C1217H1963N335O397S11,相对分子质量27.992 64,理论等电点5.25;PsnbHLH35不稳定指数为47.51,为不稳定蛋白。该蛋白的脂溶指数是80.37,平均亲水性系数为-0.639,小于0,认为PsnbHLH35 蛋白为亲水蛋白。
2.2.3 PsnbHLH35 蛋白的信号肽预测
用SignalP 5.0 Server 在线软件进行信号肽预测,发现PsnbHLH35不存在信号肽(表3)。
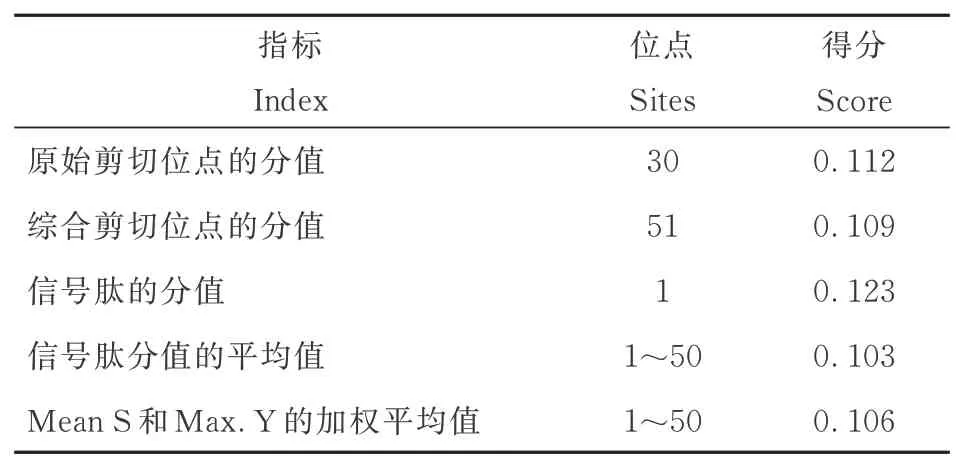
表3 PsnbHLH35 蛋白的信号肽预测结果Table 3 Signal peptide prediction results of PsnbHLH35 protein
2.2.4 PsnbHLH35 蛋白结构分析
SOPMA 结果表明PsnbHLH35的二级结构由54.51%的α-螺旋、2.05%的β-折叠、34.43%的无规则卷曲和9.02%的延伸链所构成(图2)。使用SWISS model 预测PsnbHLH35 蛋白的三级结构(图3),该蛋白的三级结构为碱性区域和“α 螺旋1-环-α 螺 旋2”。PsnbHLH35 的 蛋 白 结 构 符 合bHLH 结 构 特 点,表 明PsnbHLH35属 于bHLH 转录因子家族。
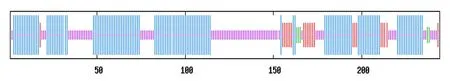
图2 PsnbHLH35 蛋白二级结构分布Fig.2 Secondary structure distribution of PsnbHLH35 protein
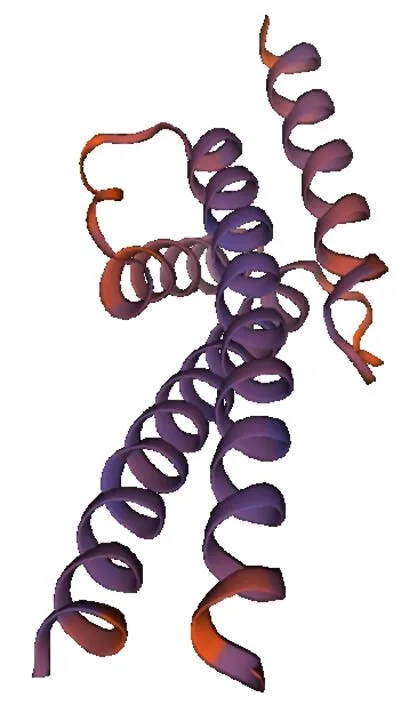
图3 PsnbHLH35 蛋白三维结构预测图Fig.3 Prediction map of PsnbHLH35 protein tertiary structure
2.3 PsnbHLH35 同源序列比对
利用DNAMAN 查找并比对PsnbHLH35与杨树bHLH 家族成员的保守结构域(图4)。利用MEGA Ⅹ构建系统进化树(图5)。结果表明,PsnbHLH35保守结构域及氨基酸序列与其它bHLH家族蛋白高度相似,属于bHLH 家族并可能具有相似的功能。

图4 PsnbHLH35 保守结构域分析Fig.4 Conservative domain analysis of PsnbHLH35

图5 PsnbHLH35 系统进化树Fig.5 The phylogenetic tree of PsnbHLH35
2.4 PsnbHLH35 转录因子自激活活性分析
将PsnbHLH35构建中在pGBKT7 载体中,将测序正确的质粒转入酵母细胞中(图6),转入重组质粒的Y2H 酵母细胞能够在SD/-Trp 培养基上生长,但无法在SD/-Trp/-His/-Ade/X-α-Gal 培养基生长,说明PsnbHLH35转录因子不具有自激活活性。

图6 PsnbHLH35 自激活活性检测Fig.6 Detection of transcriptional activation activity of PsnbHLH35
2.5 PsnbHLH35 亚细胞定位
将 携 带 pBI121-bHLH35-GFP 质 粒 与pBI121-GFP 质粒的农杆菌菌液经处理后注入健康的烟草叶片,在激光共聚焦显微镜下观察到荧光反应的位置(图7)。试验表明PsnbHLH35为核定位蛋白,与网站预测结果一致。
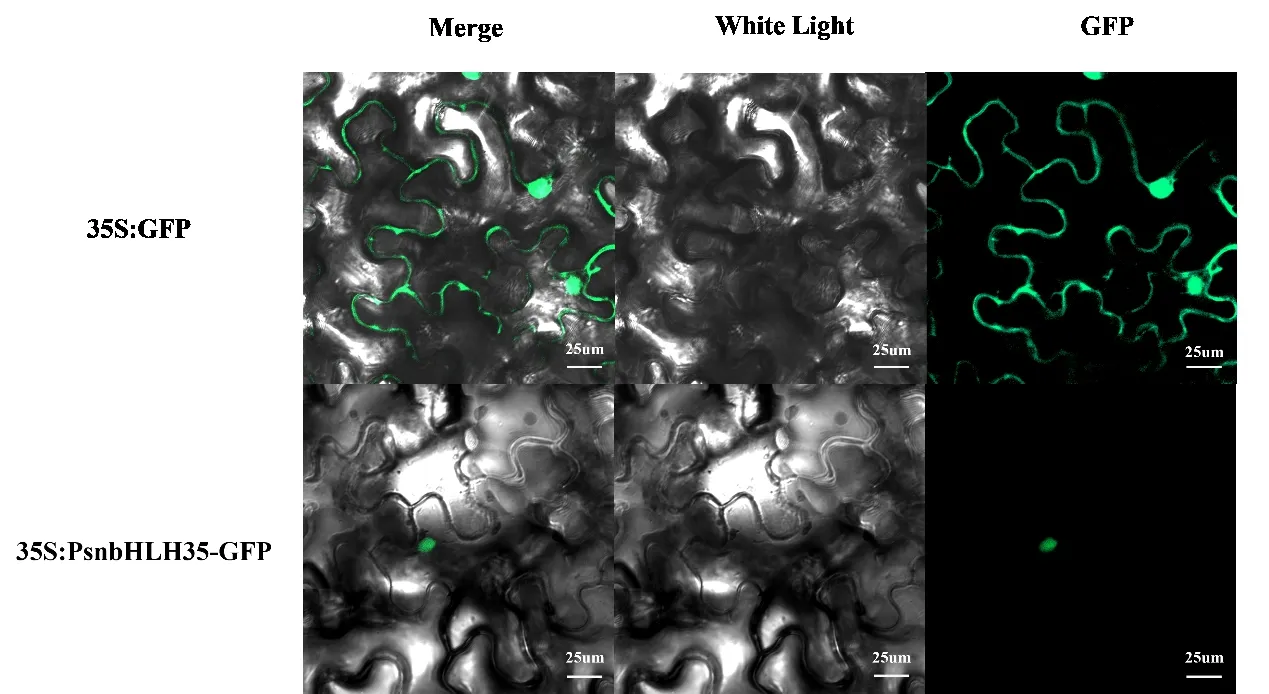
图7 PsnbHLH35 亚细胞定位Fig.7 Subcellular localization of PsnbHLH35
2.6 PsnbHLH35 组织表达特异性分析
在水培条件下,PsnbHLH35在根和叶中的表达量无明显差异,而在0.15 mol·L-1NaCl 的胁迫下该基因在不同时间点均上调表达,并具有组织特 异 性。 在0.15 mol·L-1NaCl 胁 迫 下,Psnb-HLH35在根的表达量在胁迫后逐渐增加,在48 h达到最大值,较对照升高了约4.53 倍;在叶中12 h表达量最高,为对照组的4.89 倍,后逐渐下降,48 h 时为对照组的2.17 倍,呈先升后降的趋势(图8)。

图8 盐胁迫下PsnbHLH35 的时空表达模式分析Fig.8 Changes of PsnbHLH35 gene expression in different tissues under salt stress at different times
3 讨论
本研究通过Phytozome 在线网站参考毛果杨bHLH35基因序列,设计小黑杨PsnbHLH35基因的特异性引物,克隆并获得全长为735 bp 的Psnb-HLH35基因。对其上游启动子进行预测分析后,发现该基因除去含有核心启动元件外,还涉及光胁迫应答元件、ABA 应答胁迫元件、参与MeJA 反应元件、低温响应元件等多种胁迫应答元件。说明该基因在植物应答各种胁迫过程中可能参与多种应答反应并发挥作用。PsnbHLH35 蛋白由244个氨基酸组成,具有亲水性,没有信号肽。通过与其它13 个杨树bHLH 家族基因的氨基酸序列比对,结果显示PsnbHLH35和它们具有极高的相似度,且在51~110 个氨基酸处存在60 个氨基酸组成的bHLH 保守结构域;利用SWISS model 在线软件对PsnbHLH35蛋白三维结构预测,结果显示该蛋白含有bHLH 转录因子特有的碱性区域和“α 螺旋1-环-α 螺旋2”结构。bHLH 家族在植物中广泛存在并在参与植物代谢活动,细胞生长分化以及对生物胁迫和非生物胁迫应答[25]。毛竹bHLH 家族启动子序列包含许多应答胁迫的元件,说明bHLH 家族可能与应答胁迫相关。在毛竹中鉴定出来的137 个bHLH 基因中,有13 个基因响应干旱胁迫,13 个基因响应盐胁迫,表示其功能涉及干旱或盐胁迫应答[26]。在试验中发现盐胁迫下PsnbHLH35的表达量呈显著性差异,其中在根中48 h表达量最高,上调表达了4.53 倍;在叶中表达量逐渐增加,12h 时达到峰值4.89 倍,后续又逐渐下降。因此,我们推测PsnbHLH35参与到了非生物胁迫响应过程中。
转录调控区与DNA 结合区是转录因子的主要功能结构,部分转录因子同时含有两个DNA 结合区[27],而个别转录因子甚至没有DNA 结合区或转录调控区[28]。转录调控区决定转录因子功能的差异,DNA 结合区能够识别DNA 顺式作用元件并与之结合[29]。利用酵母双杂交试验检测出该基因不具有自激活活性。亚细胞定位结果表明,该基因定位于细胞核中,符合大部分转录因子所具有的特性。前人的研究显示bHLH35不仅参与到了植物的根和叶生长发育中,而且该基因也参与到了非生物胁迫的响应中。例如,在拟南芥中通过解剖学和生理学分析发现AtbHLH35过表达植株通过增大气孔密度、减小气孔孔径、降低蒸发率和水损失、增加叶绿素含量以及提高光合作用率来获得更好的抗旱能力[30]。在水稻中,过表达OsbHLH035的 植 株 通 过 下 调OsABA2和OsAAO3基因表达来减少ABA 合成,并上调OsABA8ox1的表达来提高ABA 分解代谢,最终达到减轻盐胁迫下ABA 对发芽抑制的作用[31]。因此推测PsnbHLH35具有调控植物抗盐胁迫和干旱胁迫的功能。
4 结论
本研究以小黑杨为研究对象,以提取出的小黑杨cDNA 为模板,克隆获得735 bp 的Psnb-HLH35基因。对PsnbHLH35进行理化性质、蛋白结构及系统进化树的生物信息学分析,发现其符合bHLH 家族转录因子特点。克隆获得Psnb-HLH35启动子并对启动子元件进行预测,发现该基因与植物抗逆功能相关。 构建pGBKT7-bHLH35 载体进行自激活活性分析发现其不具有自激活活性。亚细胞定位结果表明PsnbHLH35定位于细胞核中。组织特异性分析结果显示盐胁迫下PsnbHLH35在根与叶中表达量较未胁迫有显著提升,推测该基因与植物渗透调节相关,为后续培育转基因植株与生物学机制研究提供理论基础。
——一道江苏高考题的奥秘解读和拓展

