小黑杨LBD 基因家族全基因组鉴定及耐盐性分析
高原,程紫涵,姜嘉慧,刘霖,樊高峰,周博如,姜廷波
(东北林业大学 林学院/林木遗传育种国家重点实验室,黑龙江 哈尔滨 150040)
植物在生长发育过程中经常受到如低温、干旱和高盐等环境胁迫的影响[1]。根据目前的气候预测模型,全球气候的恶化不可避免地导致干旱、热浪和盐渍化[2]。为了适应极端外界环境的影响,植物体内逐渐形成了复杂的生理生化调控机制,从而快速对外界环境变化做出响应[3]。研究植物对逆境信号的感知、传递以及适应性响应的分子机制,对阐明植物适应胁迫机制,提高作物的抗逆性具有重要意义[4]。转录因子是一类转录调控蛋白,在植物生长发育的过程中起着重要作用[5]。另外,转录因子在应答外界环境变化以及调节植物生理活动中发挥重要的调控作用。近年来,人们从植物中分离出许多调控干旱、高盐、低温及与发育相关的转录因子,这些转录因子的过量表达可以增强植物对环境胁迫的抗逆能力[6-7]。因此,转录调控也已经成为植物逆境胁迫调控中的研究热点。
LBD 家族基因是植物特有的一类转录因子,在植物生长发育和逆境胁迫响应过程中起着重要作用[8-9]。LBD 家族基因包含1 个类似锌指结构的保守结构域CX2CX6CX3C、1 个类似亮氨酸拉链LX6LX3LX6L 和1 个甘氨酸-丙氨酸-丝氨酸(GAS-block)区 域[10-11]。其 中,CX2CX6CX3C 保守结构域在DNA 结合过程中发挥作用,而LX6LX3LX6L 结构域可能参与蛋白质的互作[12-15]。LBD 家族基因能够参与调控植物侧生器官发育、激素积累、花青素和氮素代谢等[13-14],例如,在84K 杨中,TcLBD6过表达通过促进叶片L-多巴生物合成从而抑制84K 杨的生长发育[16];杨树LBD1-30的过表达导致转基因株系次生韧皮纤维木质化增加,次生木质部分化被抑制,甚至有明显的不规则木质化出现[17];在拟南芥中,LBD28的过表达导致转基因株系叶片变狭长[18]。
杨树分布广、适应性强、生长速度快,是我国重要的造林和用材树种,也是研究林木生理和基因 工 程 的 模 式 植 物[19-21]。 小 黑 杨(Populus simonii×P. nigra)是小叶杨和欧洲黑杨的杂交后代,其因耐盐碱干旱以及抗病虫害而被作为研究的模式植物[22-24]。目前有关杨树LBD 转录因子家族的研究报道还不够全面,本研究通过生物信息学的方法对杨树LBD 基因家族进行了全基因组鉴定,并对其基因结构、保守结构域、染色体分布、基因重复事件、启动子顺式作用元件以及盐胁迫下基因的表达模式进行了分析,旨在为杨树LBD 家族基因的功能以及小黑杨耐盐胁迫能力进行鉴定并提供理论依据。
1 材料与方法
1.1 LBD 家族成员的鉴定以及家族进化树的构建
利用Phytozome 植物基因组数据库(https://phytozome-next.jgi.doe.gov/)中下载杨树的蛋白序列以及全基因序列。从Pfam 数据库(http://pfam. xfam. org/)中下载典型的LBD 家族蛋白结构(PF03195)的隐马尔科夫模型。利用HMMER3.0[25]搜 索 杨 树 中 含 有PF03195 蛋 白 结 构 的特有蛋白。利用SMART 在线网站(http://smart.embl-heidelberg.de/)对搜索到的蛋白进行进一步的筛选。利用MEGA7 对杨树LBD 家族蛋白进行进化树分析,构建进化树的方法为邻接法,设置bootstrap 为1000 次重复[26]。
1.2 LBD 家族蛋白基因结构和保守基序分析
利用GSDS(http://gsds.cbi.pku.edu.cn/)在线软件分析LBD 家族基因的蛋白结构,利用MEME 在线软件(http://meme-suite. org/tools/meme)分析LBD 家族基因的保守基序。通过TBtools 软件进行图片的可视化[27]。
1.3 LBD 家族启动子顺式作用元件分析
通过Phytozome12.1(https://phytozome. jgi.doe. gov/pz/portal.html)在线软件提取LBD 家族基因上游2000 bp 的启动子区域,利用Plant CARE网 站(http://bioinformatics. psb. ugent. be/webtools/plantcare/html/)识别顺式作用元件,通过TBtools 进行图片的可视化[27]。
1.4 LBD 家族染色体定位和重复事件分析
参考杨树基因组中LBD 家族蛋白的位置信息,将每个蛋白映射到相应的染色体位置。利用MCscan[27]计 算 杨 树LBD 家 族 蛋 白 之 间 的 重 复 事件。利用TBtools 软件中的Ka/Ks Calculator 功能,计算重复基因对的Ka/Ks 值[28]。采用blaxtp 软件对杨树和其它物种(水稻、拟南芥、桉树、番茄、大豆)进行基因组比较,并利用TBtools 软件中的Dual Synteny Plotter 功能计算杨树LBD 蛋白与其它5 个物种之间的重复事件,并进行可视化[27]。
1.5 植物材料和盐胁迫处理
本试验所用的植物材料为双单倍体小黑杨(Populus simonii×P. nigra),长期保存于东北林业大学林木遗传育种重点实验室。幼苗在1/2 MS培养基中生长。对1 个月大的小黑杨幼苗进行水培处理,待长出新鲜的幼根后进行盐胁迫(150 mM NaCl)处理。取盐胁迫0 h 和24 h 的叶片送往金唯智生物公司进行转录组测序[29]。采用DESeq2 的方法[30]挑选差异基因,筛选的标准为log2(差异倍数)的绝对值≥1,且p 值≤0.05。接着,选取小黑杨叶片进行RT-qPCR 对转录组数据进行验证。RT-qPCR 的步骤采用了之前的研究[31]。所有样品均采用3 个生物学重复制备。
2 结果与分析
2.1 LBD 家族成员的鉴定
在研究中共发现58 个LBD 家族成员。系统进化树分析表明,58 个LBD 家族成员可分成ClassⅠ、ClassⅡ和ClassⅢ3 类,分别含有22 个、20 个和16 个LBD 基因(图1A)。
2.2 LBD 家族基因结构分析
利用MEME 在 线 网站(http://meme-suite.org/tools/meme)对杨树LBD 家族蛋白的保守基序进行分析,共找到15 个高度保守基序。从图1B中可以看出,除Potri. 015G135900.1 只有Motif1和Motif2 外,其它LBD 蛋白的N 末端均含有保守基序(Motif1、Motif2 和Motif4)。且分布在350 氨基酸以内,且大多数LBD 蛋白序列保守性较高,推测它们功能相似。
另外分析LBD 家族成员的基因结构,发现LBD 家族基因结构简单,大多数基因的外显子数目小于3,其中只有1 个基因含有3 个外显子,14 个基因有1 个外显子,其余均有2 个外显子。此外,16 个基因没有UTR 结构(图1C)。
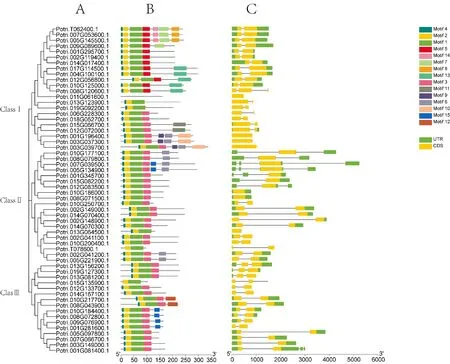
图1 杨树LBD 基因的基因结构、保守蛋白结构域和基序的表征Fig.1 Characterization of gene structure,conserved protein domains and motifs of poplar LBD gene
2.3 LBD 家族启动子顺式作用元件的分析
从Phytozome 在线软件中提取杨树所有LBD家族基因起始密码子上游2000 bp 的启动子序列,并对启动子序列的顺势作用元件进行了分析。如图2 所示,发现杨树LBD 基因启动子区域含有与水杨酸、脱落酸、茉莉酸甲酯等激素相关的元件,另外我们发现了与光、防御和压力、低温等逆境胁迫相关的顺式作用元件,同样,LBD 家族基因启动子上也含有大量与生长发育相关的元件,如胚乳表达、分生组织表达、细胞周期调节等,这些结果表明LBD 基因可能在杨树的应答胁迫和生长发育方面发挥着重要作用。
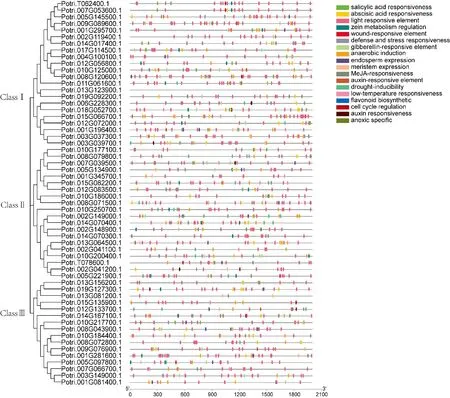
图2 杨树LBD 基因启动子中的顺式元件Fig.2 Cis-elements in poplar LBD gene promoter
2.4 LBD 家族染色体定位、串联重复、片段重复及基因组内KAKS 分析
通过对LBD 家族基因染色体定位分析,发现LBD 基因在染色体上均匀分布,除了第16 条染色体没有基因分布外,其它染色体上均有分布(图3)。其中有2 个LBD 基因分别位于Scaffold-65 和Scaffold-86 上。其中,在第4、6、11、17、18 条染色体上各有1 个基因,第10 条染色体上含有7 个基因,其数量最多(图3),然而并没有在第16 条染色体上发现LBD 基因。
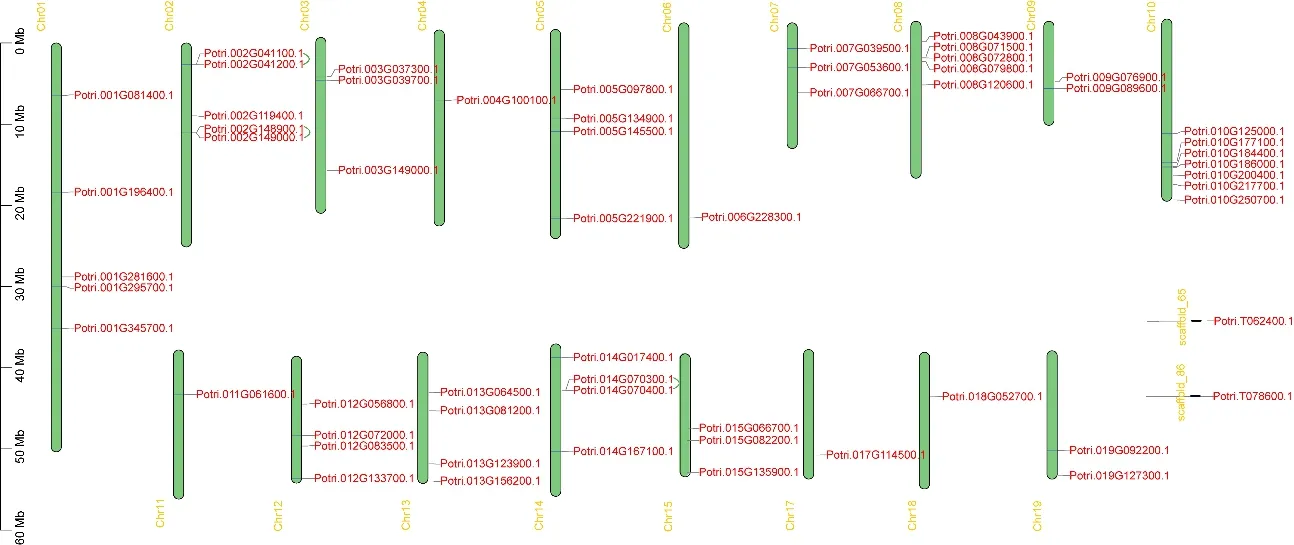
图3 LBD 基因的染色体定位Fig.3 Chromosomal location of LBD gene
串联重复和片段重复是基因家族扩张的主要机制[32]。如图3 所示,LBD 家族含有3 个串联重复基因对,其中2 号染色体上包含2 个串联重复基因对,分别是Potri. 002G041100.1 和Potri. 002G041 200.1,Potri. 002G148900.1 和Potri. 002G14900 0.1,14 号染色体上有1 个串联重复基因对,为Potri.014G070300.1 和Potri.014G070400.1。
另外发现共有23 对LBD 基因片段重复基因对,这些基因分布在不同的染色体上(图4),表明LBD 基因的扩张存在串联重复和片段重复现象。
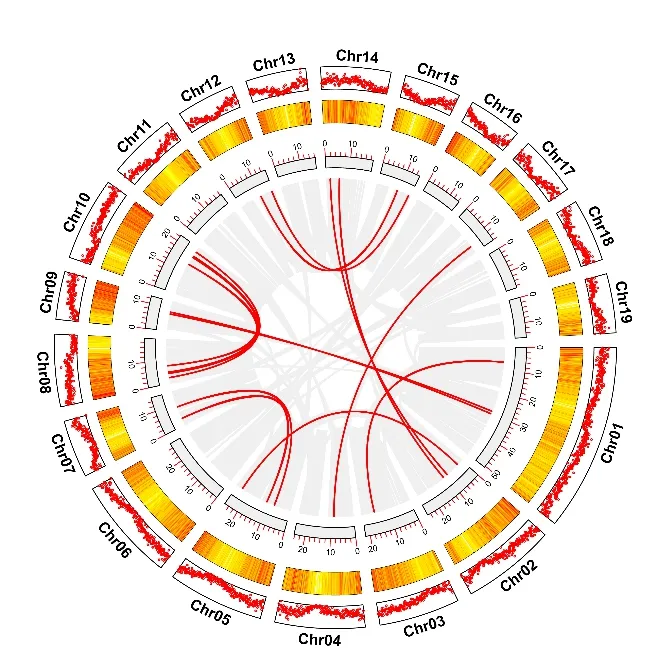
图4 LBD 基因的基因复制事件Fig.4 Gene duplication events of LBD gene
利用TBtools 计算了重复基因对之间的Ka/Ks 值(表1),这19 对基因的Ka/Ks 值均小于1,推测这些基因可能受到纯化选择。
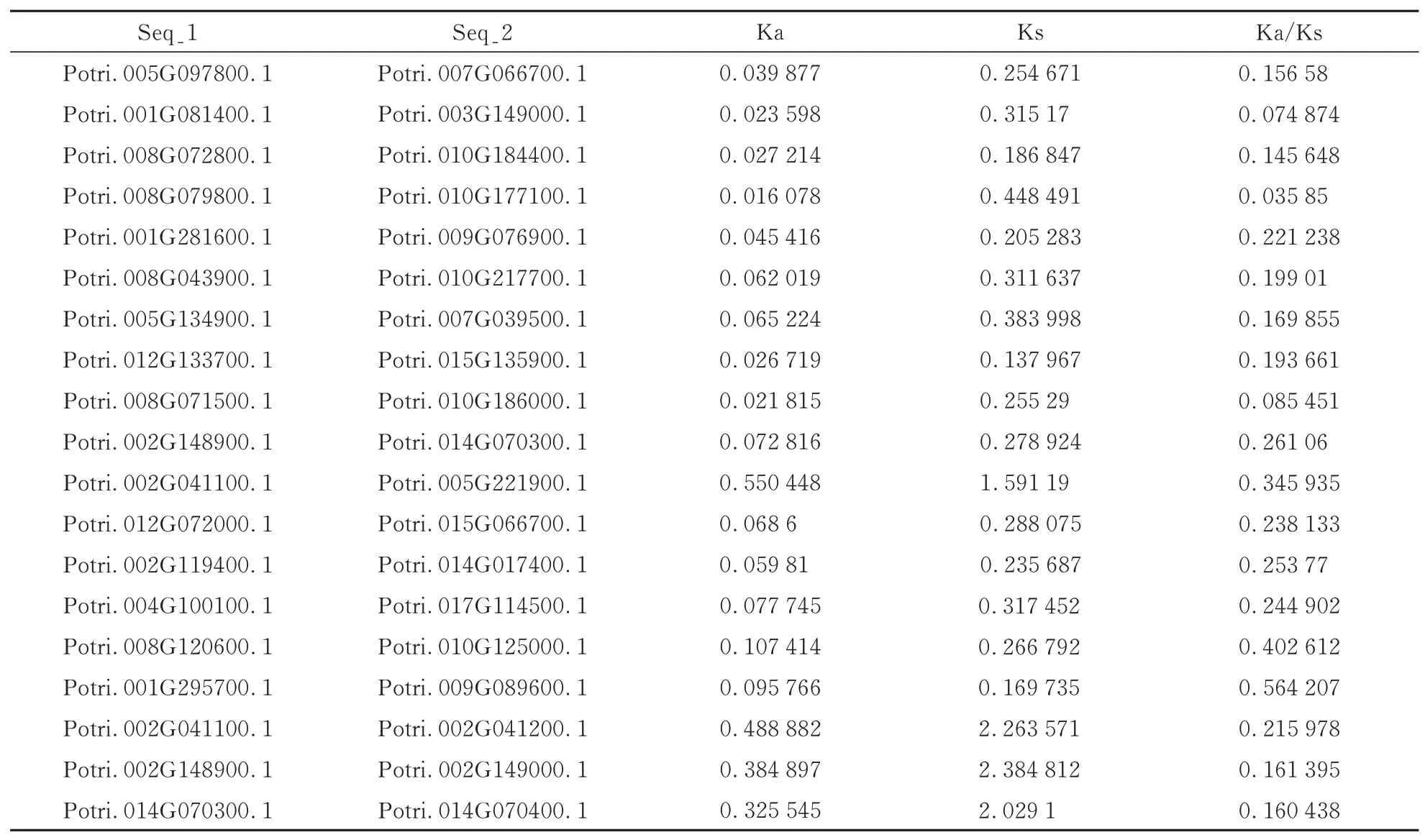
表1 重复基因对之间的Ka/Ks 值Table 1 Ka/Ks values between duplicate gene pairs
2.5 LBD 家族基因物种间共线性分析
为了进一步研究LBD 家族与其它物种之间的进化关系,构建了杨树LBD 基因和其它5 种物种之间的进化关系图谱,其中包括4 种双子叶植物(拟南芥、桉树、番茄和大豆)和1 种单子叶植物(水稻)。在水稻中,杨树LBD 家族基因与其并没有存在共线性基因对;而在拟南芥中,共发现5 对共线性基因对;在桉树中,共有17 对共线性基因对;在番茄中,共有19 对共线性基因对;在大豆中,共有34 对共线性基因对(图5)。因此推测杨树LBD 基因与双子叶植物中存在较近的进化关系。
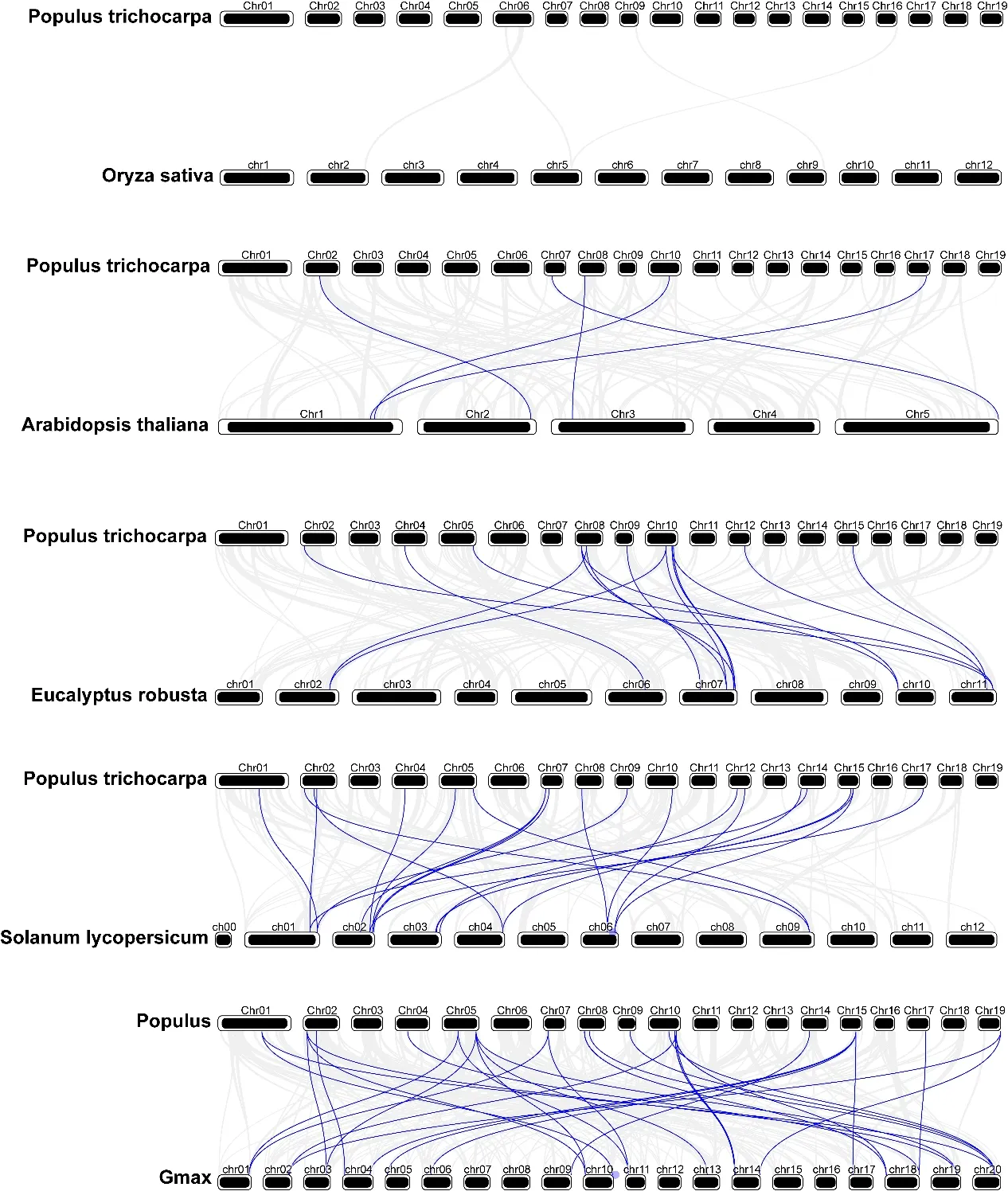
图5 小黑杨LBD 基因与其它物种的共线性分析Fig.5 collinearity analysis between LBD gene of Populus deltoides and other species
2.6 LBD 家族在盐胁迫下的表达分析
为了探索LBD 基因的表达模式,通过RNASeq 分析LBD 家族基因盐胁迫下的表达水平,共鉴定了10 个显著差异基因(DEG),差异基因分为2 组,其中Ⅰ组代表盐胁迫下调的4 个基因,分别为Potri. 014G017400.1、 Potri. 008G071500.1、Potri. 010G186000.1、Potri. 017G114500.1。Ⅱ组为盐胁迫上调的6 个基因,分别是Potri.005G1455 00.1、Potri. 010G177100.1、Potri. 002G119400.1、Potri. 012G056800.1、 Potri. 004G100100.1、Potri.009G089600.1(图6)。

图6 盐胁迫下叶片中差异表达基因(DEGs)的分析Fig.6 Analysis of differentially expressed genes(DEGs)in leaves under Salt Stress
2.7 LBD 家族定量分析
为了验证RNA-Seq 数据的准确性,随机挑选8 个DEG 进行了RT-qPCR 分析(图7)。RT-qPCR 验证的相对表达水平与RNA-Seq 分析的mRNA 丰度基本一致。因此可以断定RNA-Seq的数据可靠。
3 讨论
LBD 基因家族是植物特有的一类转录因子,在植物生长发育调控和逆境胁迫响应过程中起着重要作用[8-9]。目前,越来越多的LBD 家族基因被报道,例如,在葡萄中共鉴定出30 个LBD 基因[33];在大麦中共鉴定出24 个LBD 基因[34];而在萝卜中共鉴定出59 个LBD 基因[35]。本研究中,通过对杨树全基因组进行生物信息学分析,共有58 个LBD蛋白家族成员被鉴定出。发现大多数杨树LBD 蛋白的序列保守性较高,除Potri.015G135900.1 外,其它LBD 蛋白的N 末端均含有保守基序Motif1、Motif2 和Motif4,且分布在350 氨基酸以内,我们推测它们功能相似。
串联重复和片段重复是基因家族扩张的主要机制[36],本研究中共有19 对重复基因对被发现,其中串联重复基因对有3 对,而片段重复基因对有16对,因此,猜测在LBD 家族的进化过程中由片段重复机制作为主导,而串联重复机制作为辅助。在遗传学中,Ka/Ks 的比值是异义替换和同义替换的比值,用于表示进化过程中是否受到自然选择的作用,当Ka/Ks 的比值小于1,则认为是纯化选择,当Ka/Ks 的比值等于1,则认为是中性选择,而当Ka/Ks 的比值大于1,则认为是正向选择[37]。而本研究结果中,重复基因对的Ka/Ks 值均小于1,因此推测这些基因可能受到纯化选择。另外,探索了LBD 家族基因与不同物种之间的进化关系,发现LBD 家族基因与双子叶植物中大豆的亲缘关系最好,共发现34 对共线性基因对;而与单子叶植物中水稻的亲缘关系最差,并没有存在共线性基因对。因此,推测与单子叶植物相比,LBD 家族基因与双子叶植物的亲缘关系更为紧密。在萝卜中,与拟南芥中同源基因功能相似,Rsa10025702可能参与角果或种子的发育过程,且LBD 家族多个基因可能参与角果或种子的发育过程[35];在雷蒙德氏棉中,与拟南芥中同源基因功能相似,Gorai. 006G033100、Gorai. 007G075700和Gorai. 012G063800可能参与叶发育过程的调控,Gorai. 007G056300、Gorai. 007G222000和Gorai. 008G081100可能参与了花青素合成和氮代谢途径的调控[38];在普通烟草中,与拟南芥中同源基因功能相似,NtLBD86~93、NtLBD95、NtLBD97可能参与氮素代谢以及积累花青苷,NtLBD05、NtLBD58~59等6 个基因可能参与叶极性建立、花器官发育及形态建成[14]。因此,推测LBD 家族基因在杨树生长发育过程中也发挥重要作用。此外,LBD 家族基因在应答非生物胁迫中发挥着重要作用,例如,在玉米中LBD5和LBD33可参与调控玉米GAs 及ABA 的合成,同时影响幼苗发育及对干旱的应答[39];在拟南芥中LBD15能够直接调控下游靶基因ABI4基因的表达,通过参与ABA信号通路提高转基因株系的耐旱性[40];在大麦中HvLBD19基因受激素NAA 的诱导,过量表达Hv-LBD19基 因 能 提 高 耐 湿 性[34]。因 此,我 们 推 测LBD 家族基因在杨树应答非生物胁迫中也发挥重要作用。
启动子区域中的顺式作用元件在基因调控和表达中起重要作用[41]。在辣椒CaMAPK7的启动子中,发现W-box,TCA,ERF 等多种与生物及非生物逆境胁迫相关的顺式作用元件,且CaMAPK7在青枯病菌攻击和热应激等胁迫下转录上调[42];在家蚕丝素P25蛋白基因启动子中,PSGF 元件对A3启动子在后部丝腺的活性具有一定的增强作用,进一步验证了PSGF 调控元件的功能[43];在白桦BpBEE1基因启动子中含有与多种激素应答相关的元件,且经MeJA、SA、BL 和ABA 处理后,白桦叶脉和根中GUS 活性增加,启动子活性也显著增强[44]。本研究中,我们发现杨树LBD 基因启动子区域含有大量与激素相关的响应元件,另外,也发现了与生长发育以及应答非生物胁迫相关的元件,这些结果表明LBD 基因可能在杨树的生长发育以及应答非生物胁迫方面发挥着重要作用。
利用RNA-Seq 鉴定基因的表达,进而筛选出关键基因已经成为现阶段研究的热点。本试验中,利用RNA-Seq 共鉴定了10 个与盐胁迫相关的LBD 家族基因,而RT-qPCR 与RNA-Seq 分析的mRNA 丰度基本一致,这也证明转录组数据的可靠性,说明这些基因能够受到盐胁迫的诱导,因此,猜测这些基因有可能在盐胁迫中也发挥重要的作用,后续会通过获取转基因植物进一步分析这些基因是否具有应答盐胁迫的能力。
4 结论
本研究在杨树中共鉴定了58 个LBD 基因,这些基因均匀分布在16 条染色体和2 个支架上。并发现杨树LBD 家族基因之间的重复事件多达19对,其中片段重复16 对,串联重复3 对。此外,分析了杨树与其它5 个物种之间LBD 基因的同源进化关系,结果表明与单子叶植物相比,LBD 与双子叶植物具有更强的同源关系。另外对其启动子分析发现了大量与激素、非生物胁迫和生长发育相关的顺式作用元件,还通过RNA-Seq 和RT-qPCR 分析了盐胁迫下LBD 家族基因的表达模式。本研究结果为小黑杨LBD 基因的功能鉴定以及耐盐胁迫基因的筛选提供了理论依据。

