吡唑并[1,5-a]嘧啶-3-碳腈类衍生物的合成及抑菌活性
李思辉,赵明霞,陶佳丽,杨禹龙,刘倩,姜俊兵,*
(1.山西农业大学 动物医学学院,山西 晋中 030801;2.山西工程技术学院 矿业工程系,山西 阳泉 045000)
吡唑并嘧啶是由一个吡唑环和一个嘧啶环组成的稠杂环化合物,2 个活性单元的同时存在使得吡唑并嘧啶类衍生物具有良好的生物活性。据文献报道,吡唑并嘧啶类衍生物可作为Akt(蛋白激酶B)、Cdk4/6(细胞周期蛋白依赖性激酶)等抑制剂,对Hela,HepG2,Caco-2 等癌细胞有较好的抑制效果[1-3];也可通过有效抑制NO 的产生和COX-2,IL-6 等炎症因子的表达达到抗炎效果[4-5];还可以作用于昆虫GABA(γ-氨基丁酸)受体,抑制氯离子内流,起到杀虫作用,对丝虫、球虫、疟原虫等多种寄生虫都有较好的杀灭作用[6-9];其对大肠杆菌、伤寒沙门氏菌、枯草芽孢杆菌和金黄色葡萄球菌等也显示出较好的抑菌活性[10],在镇静[11]、抗病毒[12]方面也有影响,在医药和农药领域广泛应用。吡唑并[1,5-a]嘧啶类化合物是吡唑并嘧啶类化合物中的一类重要成员,在药物靶标的合成和研制中意义重大。吡唑并[1,5-a]嘧啶可以通过影响PDE2(磷酸二酯酶)改善阿尔茨海默症[13];对多种癌细胞的抑制有重要意义[14],并且对白念珠菌、肺炎链球菌、黄曲霉菌等都具有较好的抑制作用[15-16]。
发根农杆菌是一种广泛存在于世界范围的革兰氏阴性菌,具有宿主范围广、易传播、难治愈、危害大的特点,可通过侵染植物受伤部位产生冠瘿瘤。发根农杆菌常发生于根茎部和嫁接处,感染初期,患病植物的症状并不明显,待晚期时,易出现植物弱生长,落花落果,严重时甚至干枯死亡,导致作物大量减产,对园艺植物和农业生产有巨大危害[17-19]。
基于吡唑并[1,5-a]嘧啶类化合物优良的抗菌活性,本研究以7-氯-5-(氯甲基)吡唑并[1,5-a]嘧啶-3-碳腈为原料,通过改变7 位及5 位的取代基,设计并合成了17 个吡唑并[1,5-a]嘧啶-3-碳腈衍生物,产物经1H NMR、13C NMR 及MS(ESI)表征,并采用牛津杯法[20]检测其对发根农杆菌的抑菌活性,初步讨论了其结构与抑菌活性之间的关系,旨在为进一步结构优化和发现抗菌谱更广、抗菌活性更高的新型吡唑并[1,5-a]嘧啶-3-碳腈类化合物提供理论依据。
1 材料与方法
1.1 主要仪器与试剂
RY-1 熔点测试仪(天津市精拓仪器有限公司);Bruker AvanceⅢHD 400 MHz 型核磁共振仪(DMSO-d6为 溶 剂,TMS 为 内 标);UPLC ICLASS-XE-VOG2-XSQTOF 型超高效液相-质谱联用仪。SPX-250B-Z 型生化培养箱(上海博迅),BSD-TX270 恒温振荡器(上海博迅),牛津杯(上海兢翀有限公司)等。
LB 培养基(北京索莱宝科技有限公司),2-氟-4-氨基苯腈、3-羟基哌啶、4-氨基吗啉、二甲胺、4-苯基哌啶、1-(4-吡啶)哌嗪、4-(1-哌啶基)哌啶、氨基丙二酸二乙酯、4-氨基水杨酸甲酯、3-氨基苯乙炔、4-羟基哌啶购于上海韶远科技有限公司。所用试剂均为分析纯。
1.2 化合物的合成
本研究以7-氯-5-(氯甲基)吡唑并[1,5-a]嘧啶-3-碳腈为原料,设计并合成了17 个吡唑并[1,5-a]嘧啶-3-碳腈化合物(化合物2-5,7a,7b,8ak),其合成路线如图1 所示。

图1 化合物2-5,7a,7b,8a-k 的合成路线图Fig.1 Synthetic route of compounds 2-5,7a,7b,8a-k
1.2.1 5-(氯甲基)-7-(3-氰基-4-氟苯氨基)吡唑并[1,5-a]嘧啶-3-甲腈(7a)合成在150 mL 的圆形瓶中加入化合物1(6 mmol,1.36 g),2-氟-4-氨基苯腈(7.2 mmol,979.2 mg)和60 mL 乙醇。混合物加热回流,TLC 检测3 h 后反应完毕,将反应体系冷却至室温,析出淡黄色沉淀,抽滤,用冷乙醇洗涤,干燥,得到化合物7a。5-(氯甲基)-7-(1,3-二乙氧羰基丙基氨基)吡唑并[1,5-a]嘧啶-3-甲腈(2),5-(氯甲基)-7-(3-甲氧羰基-4-羟基苯氨基)吡唑并[1,5-a]嘧啶-3-甲腈(4),5-(氯甲基)-7-(3-乙炔基苯氨基)吡唑并[1,5-a]嘧啶-3-甲腈(7b)参照化合物7a 的合成方法合成。
1.2.2 5-(氯甲基)-7-(1,3-二羧丙基氨基)吡唑并[1,5-a]嘧啶-3-甲腈(3)的合成
将化合物2(1 mmol,351 mg)溶于四氢呋喃(6 mL),氢氧化钠(4 mmol,160 mg)溶于蒸馏水(3 mL)中滴加至上述溶液,混合物加热回流,TLC检测2 h 后反应完毕,旋蒸除去四氢呋喃,水溶液用稀盐酸中和至中性,析出絮状沉淀,抽滤,固体用水和冷乙醇洗涤,干燥,得到化合物3。
5-(氯甲基)-7-(3-羧基-4-羟基苯氨基)吡唑并[1,5-a]嘧啶-3-甲腈(5)参照化合物3 的合成方法合成。
1.2.3 5-(3-羟基哌啶)-7-(3-氰基-4-氟苯氨基)-吡唑并[1,5-a]嘧啶-3-碳腈(8a)的合成
在25 mL 的圆形瓶中加入化合物7a(0.6 mmol,195.6 mg),3-羟基哌啶(0.9 mmol,90.9 mg),碳酸钾(0.9 mmol,124.2 mg)和N,N-二甲基甲酰胺(3 mL)。混合物加热至40 ℃,TLC 检测,5 h 后反应完毕,将反应体系冷却至室温,加入15 mL 冷水,析出黄色沉淀,抽滤,用水洗和冷乙醇洗涤,干燥,得到化合物8a。
化合物8b~8k 参照化合物8a 的合成方法合成。
1.3 抑菌试验
1.3.1 化合物的抑菌作用
用DMSO 溶液分别将6 个化合物配置为6 mol·L-1的基准溶液,然后用蒸馏水进行梯度稀释,将6 个化合物稀释为2,4,6,8,10,12 mmol·L-1的溶液。
取出预先保存的发根农杆菌A599 室温解冻,接种于加有利福平的LB 固体培养基上,28 ℃培养36 h 后,挑取单菌落于LB 液体培养基中,28 ℃,200 r·min-1震荡培养。采用牛津杯法测定样品抑菌活性,以发根农杆菌为受试菌,取100 μL 菌液(浓度为107CFU·mL-1)均匀涂布于LB 固体培养基,放置4 个灭菌的牛津杯,并将100 μL 不同浓度的样品溶液分别加入牛津杯中,每个浓度设3 个重复,以0.2% DMSO 溶液为阴性对照,于28 ℃恒温培养36 h,观察抑菌效果,并测量抑菌圈直径大小。初步筛选出抑菌效果较好的化合物7a 和7b,用同样的抑菌试验方法测试化合物8a~8k 的抑菌作用。
1.3.2 数据统计分析
使用Mircosoft EXCEL 和SPSS 21.0 软件进行数据处理,并采用单因素分析进行统计分析及显著性检验,试验数据以“Mean±SE”表示,P<0.05 表示差异显著。
2 结果与分析
2.1 合成
本文所合成的抑制剂和探针及中间产物经1H NMR、13C NMR、MS 表征确定结构正确。
5-(氯甲基)-7-(1,3-二乙氧羰基丙基氨基)吡唑并[1,5-a]嘧啶-3-甲腈(2),黄色固体,产率79%,m. p. 287~288 ℃;1H NMR(400 MHz,CDCl3):δ 8.31(s,1H,-CH),7.52(d,1H,J=6.80 Hz,-NH),6.38(s,1H,-CH),4.98(d,1H,J=6.92 Hz,-CH),4.64(s,2H,-CH2),4.39(q,4H,J=7.08 Hz,-CH2),1.35(t,6H,J=7.08 Hz,-CH3).13C NMR(100 MHz,CDCl3) : δ 169.29, 165.42, 154.02, 150.91,116.62,92.21,84.35,66.78,49.20,16.84.MS(ESI+)m/z:366.2[M+H]+。
5-(氯甲基)-7-(1,3-二羧丙基氨基)吡唑并[1,5-a]嘧啶-3-甲腈(3),黄色固体,产率78%,m. p. 136~137 ℃;1H NMR(400 MHz,D2O):δ 8.37(s,1H,-CH),6.25(s,1H,-CH),4.57(s,2H,-CH2),4.55(s,1H,-CH).13C NMR(100 MHz, DMSO-d6): δ 172.50, 160.86,150.45,147.62,147.02,114.50,89.19,78.82。
5-(氯甲基)-7-(3-甲氧羰基-4-羟基苯氨基)吡唑并[1,5-a]嘧啶-3-甲腈(4),黄色固体,产率79%,m. p. 230~231 ℃;1H NMR(400 MHz,DMSO-d6):δ 8.80(s,1H,-CH),7.85(d,1H,J=9.16 Hz,-ArH),7.08(s,2H,-ArH),6.93(s,1H,-CH),4.77(s,2H,-CH2),3.89(s,3H,-CH3).13C NMR(100 MHz,DMSOd6) : δ 168.54, 160.87, 150.60, 147.08,145.67, 143.04, 131.35, 114.36, 113.72,111.26,110.46,90.72,79.83,52.41,45.82.MS(ESI+)m/z:358.1[M+H]+。
5-(氯甲基)-7-(3-羧基-4-羟基苯氨基)吡唑并[1,5-a]嘧啶-3-甲腈(5),黄色固体,产率80%,m. p. 197~198 ℃;1H NMR(400 MHz,DMSOd6):δ 10.75(s,1H,-NH),8.79(s,1H,-CH),7.86(d,1H,J=8.88 Hz,-ArH),7.01(s,2H,-ArH),6.91(s,1H,-CH),4.77(s,2H,-CH2).13C NMR(100 MHz,DMSO-d6):δ 171.25, 162.08, 160.69, 150.60, 147.07,145.73, 142.79, 131.50, 114.03, 113.78,111.03,90.64,79.76,45.83. MS(ESI+)m/z:344.1[M+H]+。
5-(氯甲基)-7-(3-氰基-4-氟苯氨基)吡唑并[1,5-a]嘧啶-3-甲腈(7a),黄色固体,产率76%,m. p. 285~286 ℃;1H NMR(400 MHz,DMSOd6):δ 10.78(s,1H,-NH),8.82(s,1H,-CH),8.05(dd,1H,J=5.60 Hz,J=2.40 Hz,-ArH),7.86-7.89(m,1H,-ArH),7.69(t,1H,J=8.80 Hz,-ArH),6.72(s,1H,-CH),4.75 (s,2H,-CH2).13C NMR (100 MHz,DMSO-d6):δ 161.12,151.07,147.70,147.22,134.11, 133.66, 130.63, 118.54, 118.34,114.32,113.97,101.56,90.21,80.10,46.24.MS(ESI+)m/z:327.1[M+H]+。
5-(氯甲基)-7-(3-乙炔基苯氨基)吡唑并[1,5-a]嘧啶-3-甲腈(7b),黄色固体,产率78%,m.p. 148~149 ℃;1H NMR(400 MHz,DMSOd6):δ 10.69(s,1H,-NH),8.80(s,1H,-CH),7.46-7.56(m,4H,-ArH),6.66(s,1H,-CH),4.76(s,2H,-CH2),4.31(s,1H,-CH).13C NMR (100 MHz,DMSO-d6):δ 161.04,151.13, 147.62, 147.20, 137.18, 130.58,130.41, 128.41, 126.13, 123.52, 114.43,89.89,83.15,82.32,79.96,46.34. MS(ESI+)m/z:308.1[M + H]+。
5-(3-羟基哌啶)-7-(3-氰基-4-氟苯氨基)-吡唑并[1,5-a]嘧啶-3-碳腈(8a),黄色固体产物,产 率59%,m. p. 180~181 ℃;1H NMR(400 MHz,DMSO-d6):δ 8.75(s,1H,-CH),8.01(t,J=2.80 Hz,1H,-ArH),7.87(dd,1H,J=8.00 Hz,J=3.60 Hz,-ArH),7.65(t,1H,J=8.80 Hz,-ArH),6.60(s,1H,-CH),4.73(s,1H,-OH),4.19(s,1H,-CH),3.67(s,2H,-CH2),2.65-2.78(m,2H,-CH2),2.54(d,2H,J=7.60 Hz,-CH2),1.91-2.01(m,2H,-CH2),1.55(dd,2H,J=8.00 Hz,J=4.40 Hz,-CH2).13C NMR (100 MHz,DMSO-d6):δ 164.68,151.16, 147.21, 146.84, 134.83, 133.04,130.03, 118.49, 118.28, 114.63, 113.98,101.60,89.42,79.40,69.85,63.00,61.22,52.93,34.94. MS(ESI+)m/z:392.1[M+H]+。
5-(吗啉氨基)-7-(3-氰基-4-氟苯氨基)-吡唑并[1,5-a]嘧啶-3-碳腈(8b),黄色固体,产率76%,m. p. 194~195 ℃;1H NMR(400 MHz,DMSO-d6):δ 8.19(s,1H,-CH),7.41(t,1H,J=9.20 Hz,-ArH),7.33(dd,1H,J=5.60 Hz,J=2.40 Hz,-ArH),7.24-7.28 (m,1H,-ArH),6.05(s,1H,-CH),5.91(s,1H,-NH),4.46(s,1H,-CH2),4.01(t,1H,J=10.80 Hz,-CH2),3.88(d,2H,J=12.80 Hz,-CH2),3.68(dd,2H,J=12.40 Hz,J=2.40 Hz,-CH2),3.45(t,2H,J=11.60 Hz,-CH2).13C NMR (100 MHz,DMSO-d6):δ 160.13,151.89, 147.28, 146.54, 135.59, 130.12,128.12, 121.06, 120.83, 118.40, 115.16,107.86, 90.75, 78.55, 63.69, 44.88. MS(ESI+)m/z:393.2[M+H]+。
5-(二甲氨基)-7-(3-氰基-4-氟苯氨基)-吡唑并[1,5-a]嘧啶-3-碳腈(8c),黄色固体,产率89%,m. p. 210~211 ℃;1H NMR(400 MHz,DMSO-d6):δ 10.59(s,1H,-NH),8.75(s,1H,-CH),8.01(dd,1H,J=5.60 Hz,J=2.80 Hz,-ArH),7.84-7.88(m,1H,-ArH),7.68(t,1H,J=8.80 Hz,-ArH),6.53(s,1H,-CH),3.49(s,2H,-CH2),2.19(s,6H,-CH2).13C NMR (100 MHz,DMSO-d6):δ 164.66, 151.19, 147.15, 147.00, 133.16,133.07, 130.19, 118.55, 118.35, 114.66,114.03,101.64,89.28,79.41,65.10,45.71.MS(ESI+)m/z:336.1[M+H]+。
5-(4-苯基哌啶-1-基)-7-(3-氰基-4-氟苯氨基)-吡唑并[1,5-a]嘧啶-3-碳腈(8d),浅红色固体,产率87%,m. p. 240~241 ℃;1H NMR(400 MHz,DMSO-d6):δ 8.71(s,1H,-CH),8.03(dd,1H,J=5.60 Hz,J=2.40 Hz,-ArH),7.81-7.85(m,1H,-ArH),7.67(t,1H,J=8.80 Hz,-ArH),7.16-7.30(m,5H,-ArH),6.65(s,1H,-CH),3.57(s,2H,-CH2),2.96(d,2H,J=11.20 Hz,-CH2),2.17(t,2H,J=11.60 Hz,-CH2),1.73(d,2H,J=12.00 Hz,-CH2),1.59(q,2H,J=12.40 Hz,-CH2).13C NMR (100 MHz, DMSO-d6) : δ 164.58,151.46, 147.11, 147.00, 146.58, 132.95,132.86, 129.59, 128.76, 127.16, 126.47,118.48, 118.27, 114.81, 114.03, 101.27,89.21,79.12,63.83,54.23,42.01,33.69. MS(ESI+)m/z:452.2[M+H]+。
5-(4-(吡啶-4-基)哌嗪)-7-(3-氰基-4-氟苯氨基)-吡唑并[1,5-a]嘧啶-3-碳腈(8e),浅红色固体,产率:83%,m.p. 252~253 ℃;1H NMR(400 MHz,DMSO-d6):δ 8.74(s,1H,-CH),8.14(t,2H,J=5.20 Hz,J=1.20 Hz,-CH),8.02(dd,1H,J=5.60 Hz,J=2.80 Hz,-ArH),7.82-7.86(m,1H,-ArH),7.66(t,1H,J=9.20 Hz,-ArH),6.81(q,2H,J=5.20 Hz,J=1.20 Hz,-CH),6.67(s,1H,-CH),3.61(s,2H,-CH2),3.30(d,4H,J=4.00 Hz,-CH2),2.58(d,4H,J=4.00 Hz,-CH2). MS(ESI+)m/z:454.2[M+H]+。
5-(4-(哌啶-1-基)哌啶)-7-(3-氰基-4-氟苯氨基)-吡唑并[1,5-a]嘧啶-3-碳腈(8f),黄色固体,产率86%,m. p. 148~149 ℃;1H NMR(400 MHz,DMSO-d6):δ 8.71(s,1H,-CH),8.00(dd,1H,J=5.60 Hz,J=2.80 Hz,-ArH),7.78-7.82(m,1H,-ArH),7.67(t,1H,J=9.20 Hz,-ArH),6.56(s,1H,-CH),3.50(s,2H,-CH2),2.88(d,2H,J=11.20 Hz,-CH2),2.29(t,2H,J=11.20 Hz,-CH2),2.01(t,2H,J=11.60 Hz,-CH2),1.68(d,2H,J=11.20 Hz,-CH2),1.48(d,2H,J=4.40 Hz,-CH2),1.38-1.44(m,11H,-CH2,-CH).13C NMR(100 MHz, DMSO-d6): δ 164.53, 151.48,147.16, 146.99, 132.98, 132.89, 129.55,118.48, 118.28, 114.81, 114.00, 101.24,89.07,79.04,63.34,62.22,53.26,50.04,27.93,26.19,24.72. MS(ESI+)m/z:459.3[M+H]+。
5-(二甲氨基)-7-(3-乙炔基苯氨基)-吡唑并[1,5-a]嘧啶-3-碳腈(8g),黄色固体,产率75%,m. p. 135~136 ℃;1H NMR(400 MHz,DMSOd6):δ 8.73(s,1H,-CH),7.54(s,1H,-ArH),7.52(d,2H,J=4.80 Hz,-ArH),7.44(d,1H,J=4.40 Hz,-ArH),6.58(s,1H,-CH),4.30(s,1H,-CH),3.48(s,2H,-CH2),2.18 (s,6H,-CH3).13C NMR (100 MHz,DMSO-d6):δ 161.20,151.01,147.96,147.50,139.09, 135.40, 134.73, 129.05, 129.02,116.71,114.27,111.31,90.18,80.22,64.20,46.15. MS(ESI+)m/z:317.4[M+H]+。
5-(4-羟基哌啶)-7-(3-乙炔基苯氨基)-吡唑并[1,5-a]嘧啶-3-碳腈(8h),黄色固体,产 率80%,m. p. 228~229 ℃;1H NMR(400 MHz,DMSO-d6):δ 8.73(s,1H,-CH),7.56(s,1H,-ArH),7.51(t,2H,J=2.80 Hz,-ArH),7.42-7.44(m,1H,-ArH),6.70(s,1H,-CH),4.54(s,1H,-OH),4.27(s,1H,-CH),3.51(brs,3H,-CH2,-CH),2.71(dd,2H,J=11.60 Hz,J=7.60 Hz,-CH2),2.14(t,2H,J=10.00 Hz,-CH2),1.69(dd,2H,J=10.40 Hz,J=5.60 Hz,-CH2),1.33-1.40(m,2H,-CH2).13C NMR (100 MHz, DMSO-d6) : δ 165.03,151.30, 147.07, 146.76, 137.69, 130.36,129.85, 127.80, 125.56, 123.39, 114.69,88.88,83.09,82.14,79.23,66.30,63.52,51.41,34.87. MS(ESI+)m/z:373.2[M+H]+。
5-(4-苯基哌啶-1-基)-7-(3-乙炔基苯氨基)-吡唑并[1,5-a]嘧啶-3-碳腈(8i),黄色固体,产 率78%,m. p. 154~155 ℃;1H NMR(400 MHz,DMSO-d6):δ 8.75(s,1H,-CH),7.60(s,1H,-ArH),7.52(t,2H,J=2.80 Hz,-ArH),7.44-7.46(m,1H,-ArH),7.30(t,2H,J=7.60 Hz,-ArH),7.17-7.23(m,3H,-ArH),6.77(s,1H,-CH),4.24(s,1H,-CH),3.59(s,2H,-CH2),2.95(d,2H,J=11.20 Hz,-CH2),2.50(brs,1H,-CH),2.17(t,2H,J=11.20 Hz,-CH2),1.76(d,2H,J=12.0 Hz,-CH2),1.56-1.66(m,4H,-CH2).13C NMR(100 MHz,DMSO-d6):δ165.01,151.35,147.13, 146.81, 146.57, 137.73, 130.47,129.96, 128.81, 127.74, 127.14, 126.46,125.76,123.35,114.72,88.98,83.14,82.01,79.26,63.76,54.22,41.92,33.68. MS(ESI+)m/z:433.2[M+H]+。
5-(4-(吡啶-4-基)哌嗪)-7-(3-乙炔基苯氨基)-吡唑并[1,5-a]嘧啶-3-碳腈(8j),黄色固体,产 率78%,m. p. 238~239 ℃;1H NMR(400 MHz,DMSO-d6):δ 8.75(s,1H,-CH),8.16(s,2H,J=6.40 Hz,-CH),7.58(s,1H,-ArH),7.51(d,2H,J=5.60 Hz,-ArH),7.38-7.40(m,1H,-ArH),6.81(d,2H,J=6.80 Hz,-CH),6.75(s,1H,-CH),4.25(s,1H,-CH),3.62(s,2H,-CH2),3.29(brs,4H,-CH2),2.58(brs,4H,-CH2).13C NMR(100 MHz,DMSO-d6):δ 164.10,154.97,151.40,150.20, 147.12, 146.86, 137.89, 130.48,129.82, 127.74, 125.64, 123.29, 114,72,108.84,89.19,83.18,82.11,79.28,63.19,52.60, 46.02. MS (ESI+) m/z: 435.2[M+H]+。
5-(4-(哌啶-1-基)哌啶)-7-(3-乙炔基苯氨基)-吡唑并[1,5-a]嘧啶-3-碳腈(8k),黄色固体,产 率75%,m. p. 123~124 ℃1H NMR(400 MHz,DMSO-d6):δ 8.72(s,1H,-CH),7.42-7.56(m,4H,-ArH),6.68(s,1H,-CH),4.25(s,1H,-CH),3.50(s,2H,-CH2),2.87(d,2H,J=10.40 Hz,-CH2),2.43(brs,4H,-CH2),2.04(t,1H,J=10.40 Hz,-CH),1.64(brs,2H,-CH2),1.47(brs,2H,-CH2),1.23-1.38 (m,8H,-CH2).13C NMR (100 MHz,DMSO-d6) : δ 9165.69, 150.39, 146.44,145.16, 135.93, 130.47, 130.15, 126.65,124.20,123.75,113.39,88.28,82.24,81.37,78.82,63.97,62.36,53.75,50.30,28.13,26.32, 24.77. MS (ESI+) m/z: 440.3[M+H]+。
2.2 抑菌试验
2.2.1 抑菌试验初筛选结果
化合物1~5,7a,7b 在不同浓度下对发根农杆菌的抑菌作用如表1 所示。由表1 可知,化合物2,3 在各个浓度均无明显抑菌作用;化合物1,4,5,7a,7b 对发根农杆菌的抑菌作用随着化合物浓度的升高而增强;与化合物1,4,5 相比,化合物7a 和7b 的抑菌效果整体显著增强,抑菌圈直径分别为32、21 mm,且化合物7a 的抑菌效果更佳。

表1 化合物1~5,7a,7b 对农杆菌的抑制效果Table 1 Inhibitory effect of compounds 1~5,7a,7b on Agrobacterium tumefaciens 单位:mm
2.2.2 化合物8a~8k 的抑菌作用
化合物8a~8k 在不同浓度下对发根农杆菌的抑菌作用如表2 所示。由表2 可知,8a~8k 在浓度为2 mmol·L-1时,对发根农杆菌均无抑菌作用,从4 mmol·L-1开始,8a~8k 对发根农杆菌的抑制作用呈现随药物浓度增加而增强的趋势,且在浓度为12 mmol·L-1抑菌效果最好。在浓度为4 mmol·L-1时,化合物8a 出现抑菌圈,其它化合物无抑菌效果;在浓度为6 mmol·L-1时,化合物8f 的抑菌效果最好,8a 次之,均显著强于其它试验组;在浓度为8 mmol·L-1时,化合物8a,8d 和8f 的抑菌效果较好,其抑菌圈大小无显著差异,抑菌效果均显著强于其它试验组;在浓度为10 mmol·L-1时,化合物8a和8f 抑菌效果较好,其抑菌圈大小无显著差异,8d和8e 次之,其抑菌圈大小无显著差异,抑菌效果均显著强于其它试验组;在浓度为12 mmol·L-1时,化合物8f 的抑菌效果最好,8a 次之,且8f 的抑菌圈显著大于8a,抑菌圈直径为42.7 mm,抑菌效果均显著强于其它试验组;与各试验组相比,阳性组有较强的抑菌活性。
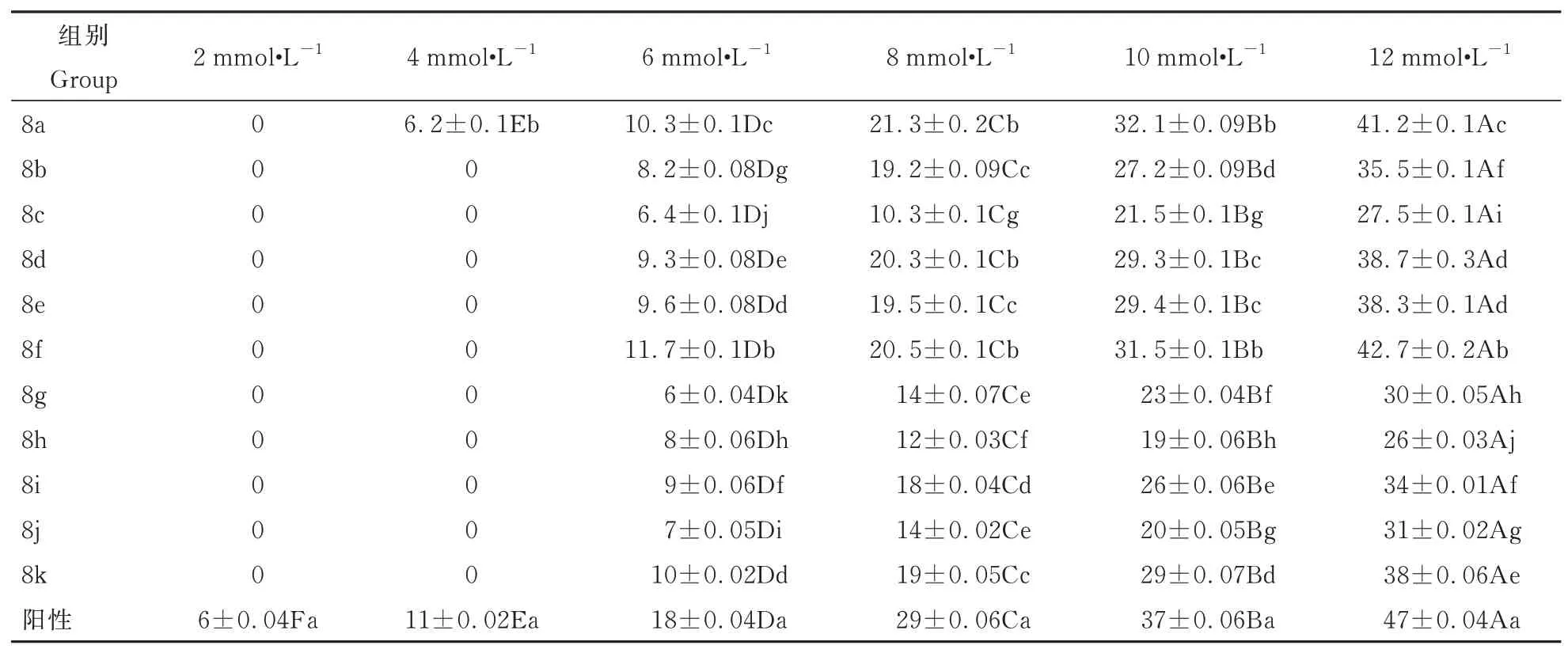
表2 化合物8a~8k 对农杆菌的抑制效果Table 2 Inhibitory effect of compounds 8a~8k on Agrobacterium rhizogenes 单位:mm
3 讨论
化合物2,4,7a,7b 可以通过化合物1 与相应氨基化合物在乙醇中回流得到,反应时间为2~3 h,产物收率高,作为前体化合物合成步骤简短、操作方便。化合物2 和4 与氢氧化钠在四氢呋喃和水混合溶液中发生水解反应,水解完全后用稀盐酸调至中性产生沉淀,抽滤洗涤后得到化合物3 和5,产率也相对较高。化合物7a 和7b 与不同的取代胺在N,N-二甲基甲酰胺中碳酸钾存在下40 ℃反应得到目标化合物8a~8k。对目标化合物8a~8k 合成的时间和温度进行了摸索,通过TLC 检测反应完成情况,发现室温下该反应时间过长并且反应不完全,最终选择在40 ℃条件下反应,时间为4~8 h。对目标化合物收率做了对比,发现反应过程中含疏水性基团的胺反应活性优于含亲水性基团的胺,且位阻小的胺反应时间更短,产率相对较高。由于目标化合物8a~8k 不溶于水,在后处理的方法上采用了加水溶解碳酸钾同时析出固体产物后抽滤的方式进行,相比萃取法产率更高。
通过比较化合物1~5,7a 和7b 对发根农杆菌的抑菌效果发现,在吡唑并[1,5-a]嘧啶类化合物7 位引入的取代基中,苯环对抑菌活性的增强有积极作用,且7 位引入三键取代基有助于提高吡唑并[1,5-a]嘧啶衍生物的抑菌活性,引入3-氰基-4-氟苯基的化合物7a 抑菌效果要好于引入3-乙炔基苯基的化合物7b。因此,本试验在7a 和7b 的基础上,对其5 位进行修饰改造,得到化合物8a~8k,通过抑菌结果的分析可以看出,与修饰前相比,化合物8a~8k 的抑菌活性大部分增强;当吡唑并[1,5-a]嘧啶7 位的取代基相同,5 位用不同的取代基进行修饰后,5 位引入(哌啶基)哌啶的化合物8f 和8k抑菌活性相对较好,且化合物8f 的抑菌活性要好于化合物8k。
4 结论
本研究以7-氯-5-(氯甲基)吡唑并[1,5-a]嘧啶-3-碳腈为原料,通过对其7 位及5 位进行结构改造,设计并合成了17 个吡唑并[1,5-a]嘧啶-3-碳腈的衍生物,其结构1H NMR、13C NMR 及MS(ESI)表征,通过抑菌试验从1~5,7a,7b 中筛选出了抑菌效果较好的化合物7a 和7b,并在此基础上对其5 位进行修饰,得到11 个化合物8a~8k,并进行抑菌试验检测,结果显示,8f 在浓度为12 mmol·L-1时的抑菌效果最好,抑菌圈直径达到42.7 mm。表明吡唑并[1,5-a]嘧啶-3-碳腈化合物7 位氨基连有3-氰基-4-氟苯基,5 位取代基为(哌啶基)哌啶时,体外抗菌活性最好,这为进一步研究抗菌谱更广、抗菌活性更高的新型吡唑并[1,5-a]嘧啶-3-碳腈类化合物提供了理论依据。

