外泌体circRPPH1促进结直肠癌增殖和转移①
陈 亮 王晓龙 曹天生 林 波 曹洪涛 杨建荣 张文伟 汤婷婷 倪志福 王 波
(南方医科大学附属花都医院胃肠外科,广州市花都区人民医院,广州 510800)
结直肠癌(colorectal cancer,CRC)是全球范围内最常见的恶性肿瘤之一,其发病率和病死率均逐年提高[1-2]。目前,CRC 的主要治疗方法仍是手术切除,适当情况下辅以化疗和放疗,虽然可提高CRC患者五年生存率,但预后及复发主要取决于其病理分期,因此并未得到理想改善[3-4]。基于此,研究CRC 的发生发展机制,寻找新的有效分子靶点,早期预防和合理治疗对提高CRC 患者生存率具有重要意义。
外泌体是细胞释放到外环境的一类微小囊泡,其作用细胞外载体介导了癌细胞与其微环境的相互作用,在癌症发展中起重要作用[5]。外泌体中包含的物质有蛋白质、脂质、微小RNA(microRNA,miRNA)、环状RNA(circular RNA,circRNA)等,可传递到不同类型细胞,发挥免疫应答、抗原呈递、细胞间通讯等多种功能[6-7]。circRNA 是一种无 3'端和5'端的闭合环状非编码RNA,近年越来越多证据表明,circRNA 在包括CRC 在内的多种肿瘤生长和转移中发挥重要调控作用[8-10]。本研究通过分析GEO数据库,筛选CRC 组织中差异表达的circRNA,发现circRPPH1(hsa_circ_0000515)在 CRC 组织中呈显著高表达,进一步研究了circRPPH1 在CRC 细胞增殖和转移中的作用,并初步分析了其潜在的致癌分子机制。
1 材料与方法
1.1 材料
1.1.1 CRC 组织样本来源和细胞系 收集60 例CRC 患者肿瘤组织及对应癌旁非肿瘤组织。所有患者均接受肿瘤切除术,术前未进行放化疗、免疫治疗等,术中采集肿瘤组织及癌旁非肿瘤组织,在液氮中速冻后保存于超低温冰箱中备用。人CRC细胞 SW620、SW480、LoVo 和 HCT116、人正常肠上皮细胞NCM460 均购于中国科学院上海细胞库,培养于含10%胎牛血清的DMEM 培养液,37 ℃、5%CO2培养,待细胞生长至80%~90%融合时加入胰酶消化传代。
1.1.2 主要试剂 TRIzol 试剂(美国Invitrogen 公司);逆转录试剂盒(TaKaRa公司);ExoQuick外泌体分离试剂盒(北京博迈斯科技发展有限公司)。
1.2 方法
1.2.1 差异表达circRNA分析 从GEO(https://www.ncbi. nlm. nih. gov/geo/query/)数 据 库 GSE126094获取CRC组织和癌旁组织样本的高通量测序数据。通过量化和背景校正,得到circRNA 在CRC 组织和癌旁组织表达值,筛选标准:|log2(Fold Change)|>1和调整后的P值<0.05。
1.2.2 细胞转染 取对数生长期SW620 和SW480细胞,按照Lipofectamine3000 试剂转染说明书转染shRNA 阴性对照(sh-NC)、circRPPH1 shRNA(shcircRPPH1),48 h 后加入嘌呤霉素进行阳性克隆筛选,稳定培养后qRT-PCR检测SW620和SW480细胞circRPPH1表达,进行后续实验。
1.2.3 qRT-PCR 采用TRIzol 试剂提取组织样本和细胞总RNA,逆转录试剂盒进行反转录反应,合成cDNA,以 cDNA 为模板采用 SYBR Green 燃料法进行 qRT-PCR 反应,2−ΔΔCt计算 circRPPH1、miR-330-5p和NRAS mRNA相对表达。
1.2.4 MTT 检测细胞增殖活性 将转染后的SW620 和 SW480 细胞以 3 000 个/孔接种于 96 孔板,分别选取培养 0 h、24 h、48 h 和 72 h 的细胞进行增殖活性测定,20 µl/孔加入MTT 溶液(5 µg/ml)孵育4 h,轻轻吸取上层培养基,向培养孔中加入DMSO 150µl 充分溶解结晶物,酶标仪检测490 nm 处吸光度,并绘制细胞生长曲线,各实验组设3个复孔。
1.2.5 流式细胞术检测细胞增殖周期 收集SW620 和 SW480 细 胞 ,加 入 200 µl 细 胞 液 离 心5 min,PBS 洗涤2 次,−20 ℃下用75%乙醇固定1 h,4 ℃下预冷,冰PBS 再次清洗细胞,按细胞周期试剂盒说明操作,将 Rnase A 溶液 20 µl 加入细胞,37 ℃水浴加热30 min,加入PI 染料溶液400 µl 4 ℃避光孵育,流式细胞仪检测488 nm处细胞周期变化。
1.2.6 Transwell 小室实验检测细胞迁移和侵袭细胞迁移实验:SW620 和SW480 细胞采用不含FBS 的培养基重悬,调整密度为 1×106个/ml,取200 µl 细胞加入小室上室,将 600 µl 含 15%FBS 的培养基加入下室,37 ℃培养24 h,棉球轻轻擦去小室膜上表面未迁移细胞,甲醇固定30 min,0.2%结晶紫溶液染色30 min,显微镜下观察拍照,随机选取10 个视野进行计数分析。细胞侵袭实验:先用Matrigel在小室上室聚碳酸酯膜上预涂一层基底膜,其他步骤同细胞迁移实验。
1.2.7 外泌体提取与鉴定 分别取转染Oe-circ-RPPH1 质粒和sh-circRPPH1 及其对照质粒的SW620 和 SW480 细胞,更换新鲜的含 10%FBS 的DMEM 培养液继续培养3 d,收集上清,离心取出细胞碎片,ExoQuick 外泌体分离试剂盒提取细胞上清外泌体。透射电镜观察外泌体形态:取20µl外泌体悬液均匀涂布于电镜铜网,室温放置10 min,滤纸吸干液体,加入30µl 20 mg/ml磷钨酸对外泌体样品进行室温复染1 min,滤纸吸干液体,烤干,安装铜网于样品槽,透射电镜下观察外泌体形态并拍照,将提取的细胞外泌体蛋白经BCA 法蛋白定量,取20 µg样品采用Western blot 检测其标志蛋白CD63、CD9表达。
1.2.8 细胞共培养 分别将转染cy3-Oe-circ-RPPH1、cy3-Oe-NC、cy3-sh-circRPPH1、cy3-sh-NC 的SW620 和SW480 细胞作为供体细胞,未经任何处理的SW620和SW480细胞作为受体细胞,提前将受体细胞以1×105个/孔接种于Transwell培养板基底外侧室,培养 24 h 后收集供体细胞,1×105个/孔接种于Transwell培养板上室,补充培养基至300µl,共培养24 h 后分别收集供体细胞、细胞外泌体、受体细胞,qRT-PCR检测细胞及外泌体中circRPPH1表达。
1.2.9 双荧光素酶报告基因实验 分别将含有miR-330-5p 结合序列的circRPPH1 序列(circRPPH1 WT)及其突变序列(circRPPH1 MUT)、NRAS 的3'UTR 序 列(NRAS 3'UTR WT)及 其 突 变 序 列(NRAS 3'UTR MUT)构建双荧光素酶报告基因载体,分别与 miRNA mimics(miR-NC)、miR-330-5p mimics(miR-330-5p)共转染 SW620 和 SW480 细胞,转染48 h 后分别收集各组细胞,参照荧光素酶活性检测试剂盒操作说明书进行荧光素酶活性检测。
1.3 统计学分析 采用SPSS19.0软件进行统计学分析,两组间比较采用独立样本t检验,数据采用表示,P<0.05为差异有统计学意义,误差线代表标准差,每组实验均重复3次。
2 结果
2.1 circRPPH1 在CRC 组织和细胞中表达上调分析 GEO(https://www.ncbi.nlm.nih.gov/gds/)数据库中CRC组织和癌旁非肿瘤组织的circRNA 高通量测序数据(GSE126094),通过量化和背景校正得到CRC组织和癌旁非肿瘤组织中circRNA表达,筛选出前5 位上调的circRNA 和前5 位下调的circRNA,绘制热图(图1A),其中circRPPH1(hsa_circ_0000515)在CRC组织中高表达最为显著(图1B),经qRT-PCR验证,circRPPH1 在CRC 肿瘤组织中表达显著高于癌旁非肿瘤组织(图1C),在CRC细胞中表达显著高于正常肠上皮细胞(图1D)。进一步分析circRPPH1在SW620 和SW480 细胞中的表达稳定性,结果显示,细胞中circRPPH1 表达不受RNase R 外切酶影响(图1E、F)。转录抑制剂放线菌素D 处理SW620和SW480 细胞,指定时间点分离总RNA,qRT-PCR检测circRPPH1 和线性RPPH1 mRNA 表达,结果表明,SW620 和 SW480 细胞中,circRPPH1 半衰期超过24 h,而RPPH1 mRNA 半衰期约为3.5 h(图1G、H)。证实circRPPH1 具有不受RNA 外切酶影响、不易降解、表达更稳定的circRNA特性。
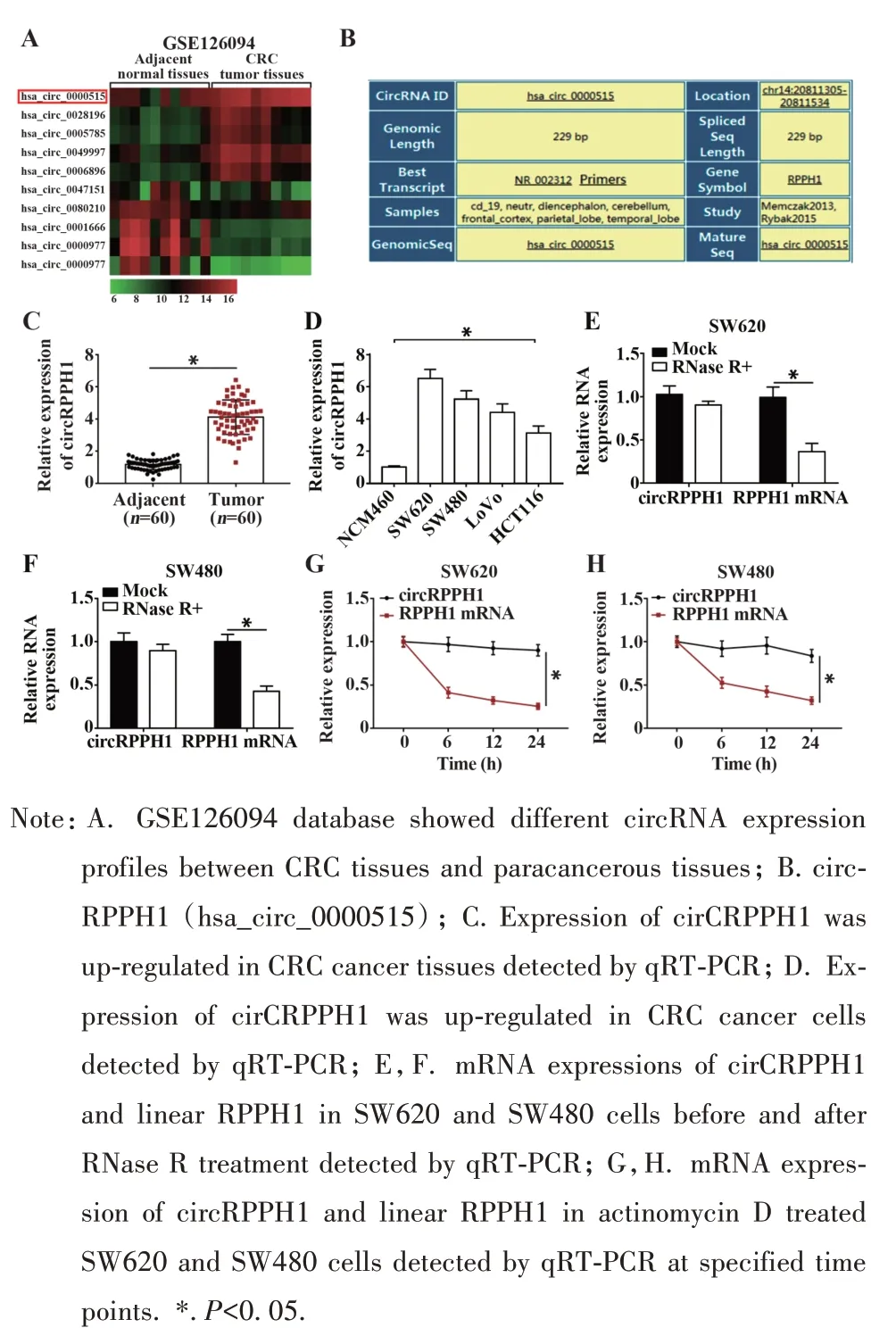
图1 circRPPH1在CRC组织和细胞中的表达和验证Fig.1 Expression and validation of cirCRPPH1 in CRC tissues and cells
2.2 敲除circRPPH1 抑制CRC 细胞增殖活性 为探讨circRPPH1 在CRC 中的生物学功能,本研究构建了敲低circRPPH1 表达的SW620 和SW480 细胞,qRT-PCR 检测circRPPH1 敲低转染效率,结果显示,与 sh-NC 组比较,sh-circRPPH1 组 SW620 和 SW480细胞circRPPH1 表达明显降低,提示转染成功(图2A)。MTT 结果显示,与sh-NC 组比较,sh-circ-RPPH1 组SW620 和SW480 细胞增殖活性明显降低(图2B、C),提示敲除circRPPH1 能够抑制CRC 细胞增殖活性。
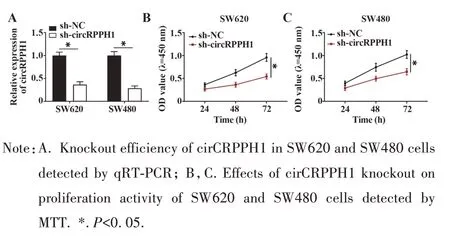
图2 敲除circRPPH1抑制CRC细胞增殖活性Fig.2 circRPPH1 knockout inhibited proliferation activity of CRC cells
2.3 敲除circRPPH1 阻滞CRC 细胞的增殖周期进展 流式细胞仪检测细胞增殖周期,结果显示,与sh-NC 组比较,sh-circRPPH1 组 SW620 和 SW480 细胞G0/G1期细胞百分比明显提高,而S 期细胞百分比明显降低,说明敲除circRPPH1 可阻滞细胞于G0/G1期,阻滞细胞向S期进展,从而抑制细胞增殖(图3)。
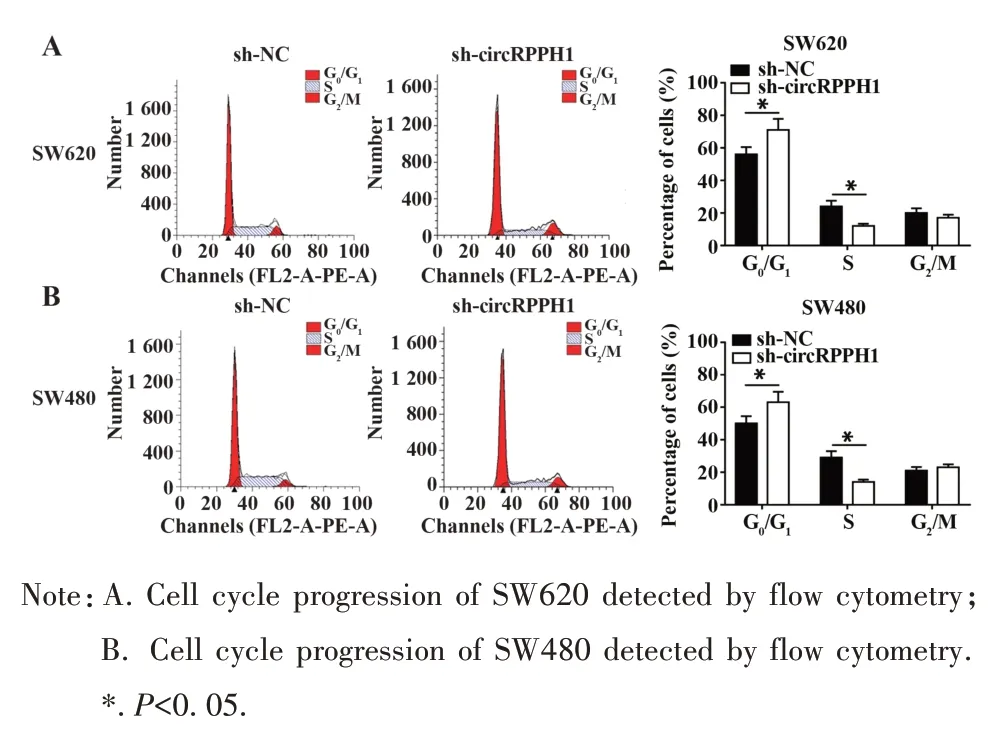
图3 敲除circRPPH1阻滞CRC细胞增殖周期进展Fig.3 circRPPH1 knockout blocked proliferation cycle progression of CRC cells
2.4 敲除circRPPH1 抑制CRC 细胞的迁移和侵袭 Transwell 小室实验检测细胞迁移和侵袭能力,结果显示,与 sh-NC 组比较,sh-circRPPH1 组 SW620和SW480 细胞迁移数和侵袭数明显减少,说明敲低circRPPH1可抑制CRC细胞迁移和侵袭(图4)。
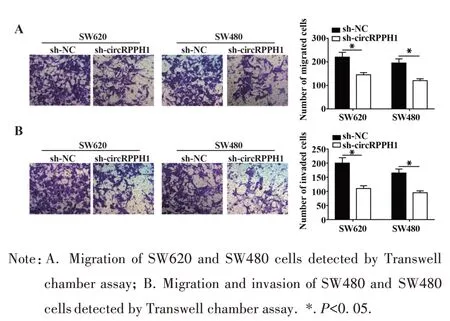
图4 敲除circRPPH1抑制CRC细胞迁移和侵袭Fig.4 Knockout of circRPPH1 inhibited migration and invasion of CRC cells
2.5 CRC 细胞通过外泌体将circRPPH1 传递给周围癌细胞 本研究进一步探讨了CRC 细胞对周围细胞的影响机制,ExoQuick 外泌体分离试剂盒分离收集CRC 细胞分泌的外泌体,透射电镜观察到外泌体呈圆形或卵圆形的囊泡结构,直径为30~100 nm(图5A);Western blot 结果表明,外泌体标志蛋白呈阳性表达(图5B)。证实外泌体分离成功。qRTPCR 检测供体细胞及其外泌体、受体细胞circ-RPPH1 表达,结果显示,与对照组比较,转染OecircRPPH1 质粒的 SW620 和 SW480 供体细胞、细胞外泌体和受体细胞circRPPH1 表达均明显升高,而转染 sh-circRPPH1 质粒的 SW620 和 SW480 供体细胞、细胞外泌体和受体细胞circRPPH1 表达均明显降低(图5C~E)。说明SW620 和SW480 细胞可通过外泌体将circRPPH1传递给周围癌细胞。
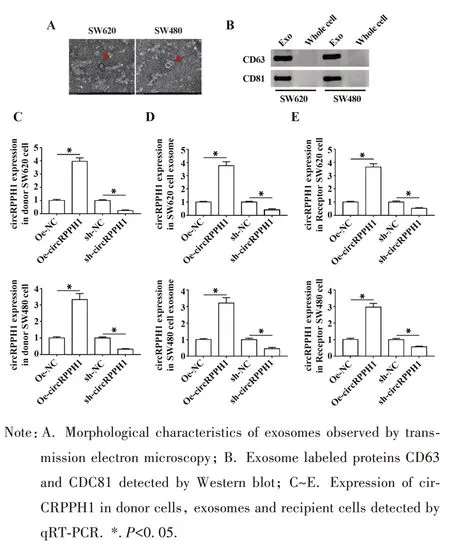
图5 CRC细胞通过外泌体将circRPPH1传递给周围癌细胞Fig.5 CRC cells deliver circRPPH1 to surrounding can⁃cer cells via exosomes
2.6 circRPPH1 在 CRC 细胞中起 miR-330-5p 海绵作用 为进一步研究circRPPH1在CRC细胞中的调控机制,利用在线生物学数据库starBase 和CircIn‑teractome 预测与 circRPPH1 相关的 miRNA,结果发现circRPPH1 与miR-330-5p 存在结合位点(图6A)。双荧光素酶报告基因检测实验表明circRPPH1 与miR-330-5p 可相互结合(图6B、C)。qRT-PCR 检测发现,miR-330-5p 在CRC 组织和细胞中表达下调(图6D、E)。

图6 circRPPH1靶向调节miR-330-5pFig.6 circRPPH1 targeting regulated miR-330-5p
2.7 NRAS 是miR-330-5p 的下游靶基因 进一步采用 starBase、miRDB 和 miRWalk 数据库预测 miR-330-5p的潜在下游靶基因,结果发现,miR-330-5p与NRAS 的3'UTR 存在结合位点(图7A);双荧光素酶报告基因检测实验表明miR-330-5p能够与NRAS的3'UTR 相互结合(图 7B、C)。TCGA(http://gepia.cancer-pku. cn/detail. php)数据库分析发现,NRAS在CRC 肿瘤组织中呈高表达(图7D)。qRT-PCR 进一步验证NRAS在CRC肿瘤组织和癌细胞均呈高表达(图7E、F)。
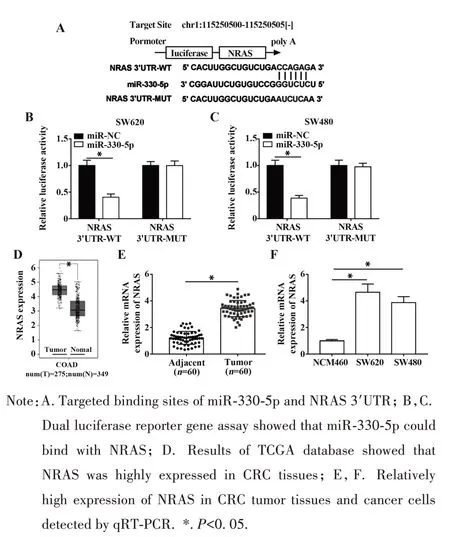
图7 miR-330-5p与NRAS的相互作用Fig.7 Interaction between miR-330-5p and NRAS
3 讨论
近年随着我国居民生活方式和饮食结构(高脂肪、高蛋白、低纤维素饮食)改变及人口老龄化加剧,CRC 发病率一直居高不下。我国肿瘤登记中心数据显示,2015 年预计新发病例约37.6 万例,在同年总新发肿瘤中位列第五,病死病例约19.1 万例,同样位居总死亡肿瘤病例第五[11]。早期发现、诊断并及时治疗可显著降低CRC 患者病死率,但现阶段CRC 早期诊断方法有限,疾病一旦进展则治疗手段仍以传统手术加辅助化疗为主,且疗效并不理想[12-13]。导致这一困境的重要原因是目前CRC 发病机制尚未阐明。因此,为提升CRC 的早期诊治率,同时让中晚期患者获得长期生存希望,深入研究并揭示CRC发病机制显得十分重要。
circRNA 是一类具有调节能力的内源性非编码RNA,通过反向剪接形成闭合环状结构,使其不易受RNA 外切酶影响,具有细胞外稳定性和进化保守性,在调控基因表达中发挥重要作用[14]。circRNA的功能多种多样,除能够发挥miRNA 海绵功能,调节亲本基因组间转录、干预剪接及与RNA 结合蛋白相互作用外,部分circRNA 还能通过自身编码蛋白参与基因表达调控[15-16]。近年研究显示,circRNA 与多种疾病发生有关,具有成为疾病诊断或预后生物标志物的潜力[17]。
多项研究表明,多种circRNA 在CRC 中异常表达,可能成为调控CRC 进展的重要靶点。如PEI等[18]研究表明,circ_0000218 在 CRC 组织和细胞中明显上调,其高表达与CRC的TNM分期与淋巴结转移密切相关,且circ_0000218 可通过miR-139-3p/RAB1A 轴调控癌细胞增殖、迁移和侵袭。YANG等[19]研究表明,circ_0137008 在 CRC 组织和细胞表达下调,过表达circ_0137008能够抑制癌细胞增殖、侵袭和转移。YAN 等[20]研究发现 circHIPK3 可作为miR-1207-5p 海绵促进其下游癌基因FMNL2 表达,进而促进肿瘤发生发展。 circRPPH1(circ_0000515)已被报道在宫颈癌中高表达,发挥促癌作用。但其在CRC 中的作用尚不清楚。本研究通过分析数据库结合实验验证,证实circRPPH1 在CRC组织和癌细胞中也呈高表达,提示circRPPH1 可能是CRC 的潜在生物标志物。通过细胞增殖、周期、迁移和侵袭实验表明,敲除circRPPH1 能够抑制CRC 细胞增殖活性,阻滞细胞周期于G0/G1期,并抑制细胞迁移和侵袭,证实circRPPH1 表达与CRC 进展有关。
细胞分泌的外泌体可通过传递其内含物(如蛋白、miRNA、circRNA)作为细胞间通讯媒介,在包括肿瘤在内的多种疾病诊断和治疗中起重要作用[21-22]。目前,有关CRC 外泌体的报道主要集中于miRNA,外泌体circRNA 在CRC 中的研究较少。本研究分离提取CRC 细胞外泌体,并通过共培养实验发现,CRC 细胞可通过分泌外泌体将circRPPH1 传递给周围癌细胞,而高表达的circRPPH1 在CRC 中发挥促癌作用,提示外泌体circRPPH1 可能是CRC潜在的生物标志物。
功能研究表明,circRNA 分子富含miRNA 结合位点,可通过海绵miRNA 正向调控其下游靶基因表达,参与转录后调控,这一作用机制被称为竞争性内源RNA机制[23-24]。本研究利用在线生物信息学数据库对circRPPH1 相关的miRNA 及其下游靶基因进行预测,并通过双荧光素酶报告基因实验验证,结果显示circRPPH1可在miR-330-5p中发挥海绵作用,而NRAS 是miR-330-5p的下游靶基因,提示靶向调控miR-330-5p/NRAS 表达可能是circRPPH1 发挥生物学功能的潜在分子机制。
综上所述,本研究明确了circRPPH1 在CRC 中的生物学功能及潜在调控机制,并证实circRPPH1可通过外泌体在CRC 细胞间传递,提示外泌体circ RPPH1可能作为潜在生物标志物促进CRC进展。
——外泌体与老年慢性疾病相关性的研究进展

