巨噬细胞RAW264.7 通过TLR4-NF-κB 信号通路调控流感病毒A/PR/8/34(H1N1)增殖的实验研究①
田 晶 隋海娟 陈 月 (锦州医科大学,锦州 121000)
流感病毒(influenza virus,IV)是呼吸道感染的重要病原体,由于变异快,尤其是动物源流感病毒在人群中的高致死率和广泛流行性已引起全世界高度关注[1]。固有免疫系统是抵抗流感病毒入侵的第一道防线,感染早期快速的固有细胞免疫应答能有效控制呼吸道上皮细胞感染及流感病毒复制[2]。巨噬细胞作为固有免疫系统重要的专职吞噬细胞,通过内化方式和溶酶体降解过程清除感染颗粒,以摄取凋亡细胞的形式去除病毒感染的细胞碎片[3]。此外,巨噬细胞M1 型(经典激活型)分泌TNF-α 和NOS 等炎症因子,帮助机体清除流感病毒。M2 型(替代激活型)具有抗炎功能,释放多种抗炎递质,参与组织修复[4-5]。巨噬细胞的双向调节作用对流感病毒免疫应答的平衡发挥重要作用。
1 材料与方法
1.1 材料
1.1.1 细胞株 小鼠巨噬细胞株RAW264.7(SCSP-5036)购于中国科学院上海细胞库。
1.1.2 主要试剂 甲型流感病毒鼠肺适应株A/PR/8/34(H1N1,PR8)由国家疾病预防控制中心流感所馈赠;RNeasy Mini Kit 试剂盒购自德国QIAGEN;One Step SYBR®Prime ScriptTMRT-PCR Kit购自日本TaKaRa公司;TLR4、NF-κB和Influenza NP 抗体购自美国 Abcam 公司;Fixation/Permeabilization solution和BD Perm/WashTMBuffer 购自美国BD 公司;细胞凋亡-Hoechst 染色试剂盒购自上海碧云天生物技术有限公司;DMEM 培养基、胎牛血清、牛血清白蛋白、TPCK-胰酶和HEPES缓冲液购自美国Gibco公司。
1.2 方法
1.2.1 流感病毒PR8 鸡胚培养 用1 ml 注射器吸取200 µl 流感病毒PR8 接种于8~11 日龄的鸡胚尿囊腔,用无菌医用胶布将裂口封好。36 ℃孵育2~3 d,将鸡胚置于−20 ℃1 h即可无菌收集尿囊液。1 200 g离心15 min 去除沉淀。取少量用于病毒滴度检测,其余1.5 ml/管分装于2 ml冻存管,−80 ℃保存。
1.2.2 红细胞凝集试验(HA)检测病毒滴度 取生理盐水至96孔U型板第2~12列(50µl/孔)。加入病毒液50µl于U型板第1、2列对应孔。混匀第2列孔中的病毒液和生理盐水,吸出50µl至第3列,混匀,依次倍比稀释。第 12 列弃去 50 µl,50 µl/孔加入1%豚鼠血红细胞悬液混匀,室温静置30 min,观察凝集现象。以凝集的最高稀释倍数为终点,其倒数即为病毒滴度。
1.2.3 流感病毒TCID50检测 RAW264.7 细胞以2×104个/孔接种于 96 孔板,37 ℃、5%CO2培养 24 h,病毒半对数稀释法:96孔板第1列竖向4孔146µl/孔加入100 倍稀释的病毒液,其他各列100µl/孔加入病毒维持液。从第1孔吸46µl至第2孔,混匀,再吸46 µl 至第 3 孔,连续进行半对数稀释(10−2~10−6.5);Hank's 液清洗细胞,将已稀释的病毒液加至96 孔RAW264.7 细胞板对应孔,各稀释度设4 个复孔,35 ℃ 1 h;Hank's 清洗,200 µl/孔加入病毒维持液(TPCK-胰酶2 µg/ml)35 ℃培养,观察细胞病变。根据 Reed 和Muench 法计算病毒滴度(TCID50/50 µl)。距离比例=(>50%的阳性%−50)(/>50%的阳性%−<50%的阳性%);TCID50对数=最高稀释对数(>50%的阳性%)+稀释系数对数×距离比例。
1.2.4 细胞分组 实验分为对照组、100 TCID50组和1 000 TCID50组。对照组:细胞生长液。100 TCID50组:100 TCID50流感病毒 PR8 吸附 1 h,Hank's 液清洗,加入病毒维持液。1 000 TCID50组:1 000 TCID50流感病毒PR8 吸附1 h,Hank's 液清洗,加入病毒维持液,细胞感染48 h时进行各指标检测。
1.2.5 Hoechst 染色 将细胞爬片置于24 孔板,接种 RAW264.7 细胞,37 ℃、5%CO2培养 24 h。100 TCID50组和 1 000 TCID50组弃孔中液体,Hank's 清洗2 遍,分别用 100 TCID50和 1 000 TCID50的病毒 PR8稀释液感染细胞 1 h,Hank's 清洗 2 遍,500 µl/孔加入病毒维持液,48 h 后吸尽液体,Hank's、PBS 清洗2 次(500 µl/孔),固定液固定 10 min,PBS 清洗 3 次(500 µl/孔),加入Hoechst 33258 染色液染色5 min(500 µl/孔),PBS 清洗3 次(500 µl/孔),取出爬片,滴加25µl抗荧光淬灭封片液于爬片细胞面,盖于洁净玻片上,荧光显微镜下观察细胞核。
1.2.6 细胞荧光染色 细胞爬片及TCID50感染同1.2.5。4%多聚甲醛固定15 min(1 ml/孔),PBS 清洗 3 次,TLR4 直接染色,Influenza NP 和 NF-κB 透膜:0.5%TritonX-100(1 ml/孔)20 min,PBS 清洗 3 次(500 µl/孔),2%BSA 封闭30 min,加入1∶100稀释的一抗 Influenza NP、TLR4 和 NF-κB p65(200 µl/孔)4 ℃孵育过夜,PBS清洗3次(500µl/孔),加入 1∶1 000稀释的FITC 标记的二抗(200 µl/孔)室温避光孵育1 h,PBS 清洗3 次(500 µl/孔),取出爬片,滴加25 µl含DAPI的抗荧光淬灭封片剂,荧光显微镜下观察。
1.2.7 流式细胞术检测RAW264.7 细胞凋亡RAW264.7 细胞接种于低黏附6 孔板,感染PR8 48 h 收集细胞,制备单细胞悬液:胰酶消化后转至15 ml 离心管,800 g 离心5 min,弃上清,加入500 µl Binding Buffer 重悬细胞。细胞染色:加入Annexin V-FITC 5 µl 和7-AAD 3 µl,过300 目尼龙筛网至BD流式管,避光5~15 min,流式细胞术检测细胞凋亡。
1.2.8 RT-PCR 检测各指标mRNA 水平 提取细胞总RNA,参照QIAGEN RNeasy mini kit 试剂盒说明书。引物由TaKaRa 公司合成(表1)。反应体系:SYBR RT-PCR Buffer 10 µl、EX TaqHS(5 U/µl)0.4 µl、PrimeScript RT Enzyme Mix 0.4 µl、PCR Forward Primer(10 µmol/L)0.4 µl、PCR Reverse Primer(10 µmol/L)0.4 µl、ROX Reference Dye(50×)0.4 µl、Total RNA 1 µl。反应条件:42 ℃ 5 min;95 ℃ 10 s;95 ℃ 3 s,60 ℃ 30 s,共 40 个循环;95 ℃ 15 s,60 ℃1 min,95 ℃ 15 s绘制熔解曲线。2−ΔΔCt计算相对表达。

表1 引物序列Tab.1 Primer sequences
1.2.9 流式细胞术检测RAW264.7 细胞Influenza NP、TLR4 和 NF-κB p65 表达 收集各组细胞,PBS清洗,加入1∶100 稀释的 TLR4,PBS 清洗,于细胞沉淀中加入 100 µl Fixation/Permeabilization solution,混匀,4 ℃避光 20 min,1 ml/管加入 Buffer,1 200 g 离心 3 min。弃上清,加入 Influenza NP/NF-κB p65(1∶100)室温避光 1 h。加入1 ml/管 Buffer,1 200 g离心3 min,弃上清,加入DyLight488 标记的二抗(1∶1 000)室温避光 30 min,1 ml/管加入 Buffer,混匀,离心3 min,弃上清,300 µl/管加入Buffer,过300目尼龙筛网至BD流式细胞管,流式细胞术检测。
1.3 统计学分析 采用SPSS22.0 和GraphPad Prism软件进行统计学分析,数据比较采用单因素方差分析、LSD 检验和Spearman 相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 鸡胚培养PR8 的滴度 HA 结果显示,流感病毒PR8 经鸡胚分离培养后,病毒滴度由培养前的1∶32提高到1∶512(图1)。

图1 鸡胚培养流感病毒后的病毒滴度Fig.1 Virus titer after influenza virus culture in chicken embryo
2.2 流感病毒TCID50病毒组织细胞TCID50是病毒感染能力的标化指标,根据Reed 和Muench 对HA进行计算,100 TCID50/50 µl=1∶28.2(图2、表2)。

表2 Reed-Muench 计算TCID50 滴度的病毒稀释度配比情况Tab.2 Virus dilution ratio of TCID50 by Reed-Muench method

图2 流感病毒TCID50(HA实验)Fig.2 TCID50 of influenza virus(HA test)
2.3 细胞形态学改变 倒置显微镜下观察对照组RAW264.7 细胞多呈圆形、类圆形,透亮状。感染10 TCID50PR8后,少量细胞呈长梭形改变,100 TCID50组细胞呈长梭形并出现伪足,胞内可见空泡和颗粒状物质,1 000 TCID50组细胞向不规则多形态转变,少量细胞破裂(图3)。Hoechst 染色可见对照组细胞的细胞核呈暗蓝色,10 TCID50组少量细胞的细胞核出现点状浓染,100 TCID50组细胞有少量细胞的细胞核呈碎块状致密浓染,1 000 TCID50组出现少量凋亡细胞,细胞核致密浓染或呈碎块状浓染,呈亮蓝色。100 TCID50组和1 000 TCID50组细胞凋亡率均高于 10 TCID50组(P<0.05),1 000 TCID50组细胞凋亡率高于100 TCID50组,但差异无统计学意义(P>0.05,图4)。

图3 光镜下RAW264.7细胞形态Fig.3 Light microscope morphology of RAW264.7 cells
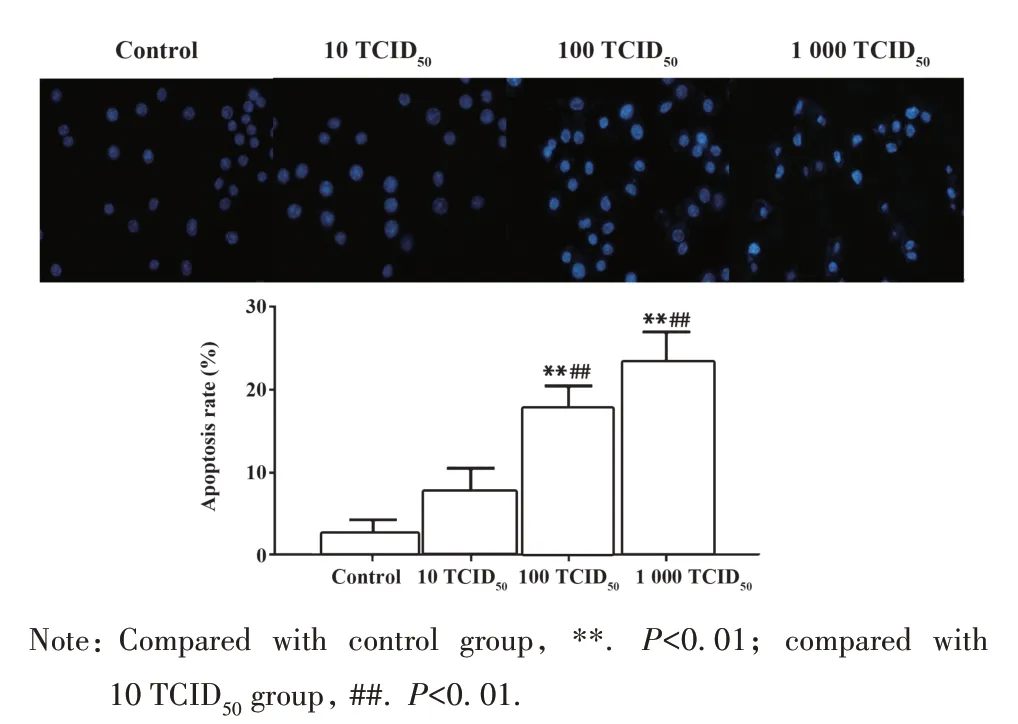
图4 RAW264.7细胞Hoechst染色Fig.4 Hoechst staining of RAW264.7 cells
2.4 RAW264.7 细胞凋亡情况 RAW264.7 细胞感染流感病毒PR8 48 h 时,100 TCID50组和1 000 TCID50组RAW264.7 细胞凋亡率均有不同程度升高(P<0.01)。100 TCID50组主要发生细胞早期凋亡,100 TCID50组细胞晚期凋亡增多,1 000 TCID50组较100 TCID50组细胞凋亡率小幅提高,但差异无统计学意义(P>0.05)。与10 TCID50组比较,100 TCID50组和1 000 TCID50组细胞凋亡率显著提高(P<0.01,图5)。
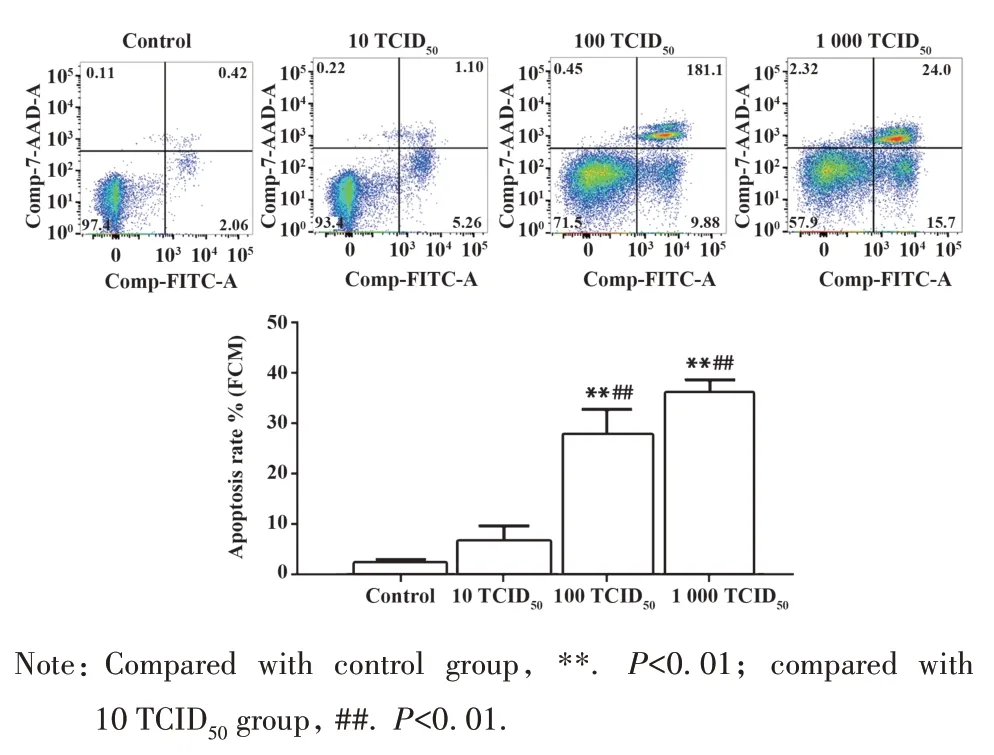
图5 RAW264.7细胞凋亡流式图Fig.5 Flow cytometric diagram of apoptosis of RAW264.7 cells
2.5 RAW264.7细胞内病毒增殖情况 qPCR 结果表明,RAW264.7 细胞感染PR8 48 h 后病毒mRNA显著升高,10 TCID50组提高 2.2×104倍(P<0.05),100 TCID50组提高9.1×104倍(P<0.01),1 000 TCID50组12.3×104倍(P<0.01),1 000 TCID50组感染水平较100 TCID50组呈上升趋势,但差异无统计学意义(P>0.05)。与 10 TCID50组比较,100 TCID50组和1 000 TCID50组病毒mRNA 表达显著增加(P<0.01,图6)。流式分析结果表明,RAW264.7细胞感染不同病毒载量PR8后胞内Influenza NP水平升高(P<0.05)。与 10 TCID50组比较,100 TCID50组和 1 000 TCID50组NP 表达显著增加(P<0.01),1 000 TCID50组较100 TCID50组NP表达小幅增加(P>0.05,图7)。
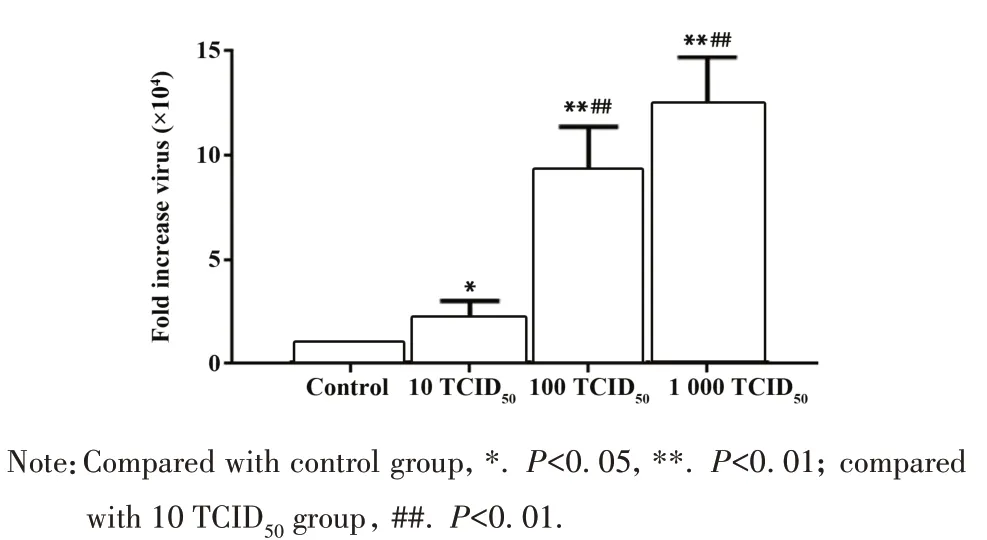
图6 RAW264.7细胞病毒相对表达Fig.6 Relative expression of virus in RAW264.7 cells
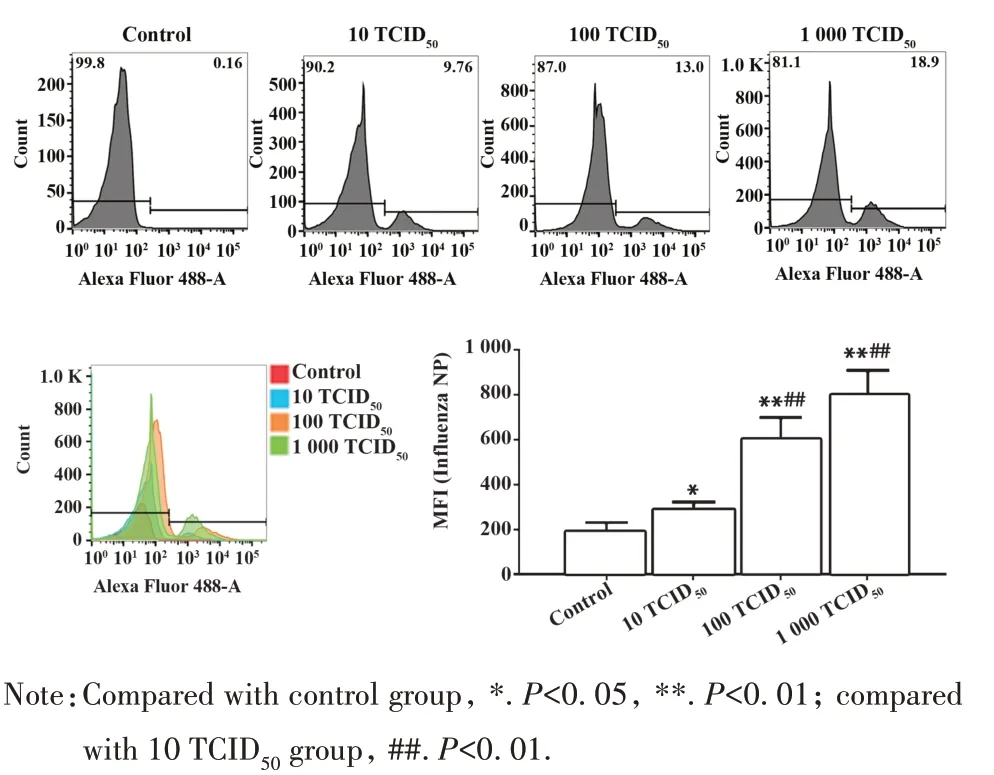
图7 FCM检测RAW264.7细胞NP表达Fig.7 NP expression in RAW264.7 cells detected by FCM
细胞免疫荧光染色对细胞蛋白表达定位可见,Influenza NP 主要表达于细胞核,正常对照组不表达Influenza NP 蛋白。流感病毒PR8 感染48 h 时,100 TCID50组和 1 000 TCID50组 Influenza NP 表达明显增强(图8)。
2.6 RAW264.7 细胞 Toll 样受体及 NF-κB p65 水平 qPCR 结果表明,RAW264.7 细胞感染PR8 48 h后TLR4 和 NF-κB p65 mRNA 水平升高(P<0.05),且1 000 TCID50组上升幅度明显高于100 TCID50组(P<0.01)。与 10 TCID50组比较,100 TCID50组和1 000 TCID50组mRNA 水平不同程度升高(P<0.05,图8)。流式分析结果表明,RAW264.7 细胞感染PR8 后胞内 TLR4 和 NF-κB p65 平均荧光强度增强(P<0.01),1 000 TCID50组强度高于 100 TCID50组(P<0.01)。与 10 TCID50组比较,100 TCID50组和1 000 TCID50组荧光强度不同程度升高(P<0.05,图9)。细胞免疫荧光染色对细胞蛋白表达定位可见,TLR4 蛋白主要表达于细胞膜,NF-κB p65 蛋白主要表达于细胞核。正常对照组少量表达TLR4 和NF-κB p65 蛋 白 ,PR8 感 染 48 h 时 10 TCID50组RAW264.7 细胞 TLR4 和 NF-κB p65 蛋白表达小范围增加。100 TCID50组和1 000 TCID50组蛋白表达增强,且1 000 TCID50组增高幅度强于100 TCID50组(图10)。

图8 RAW264.7细胞NP蛋白表达Fig.8 Protein expression of NP in RAW264.7 cells
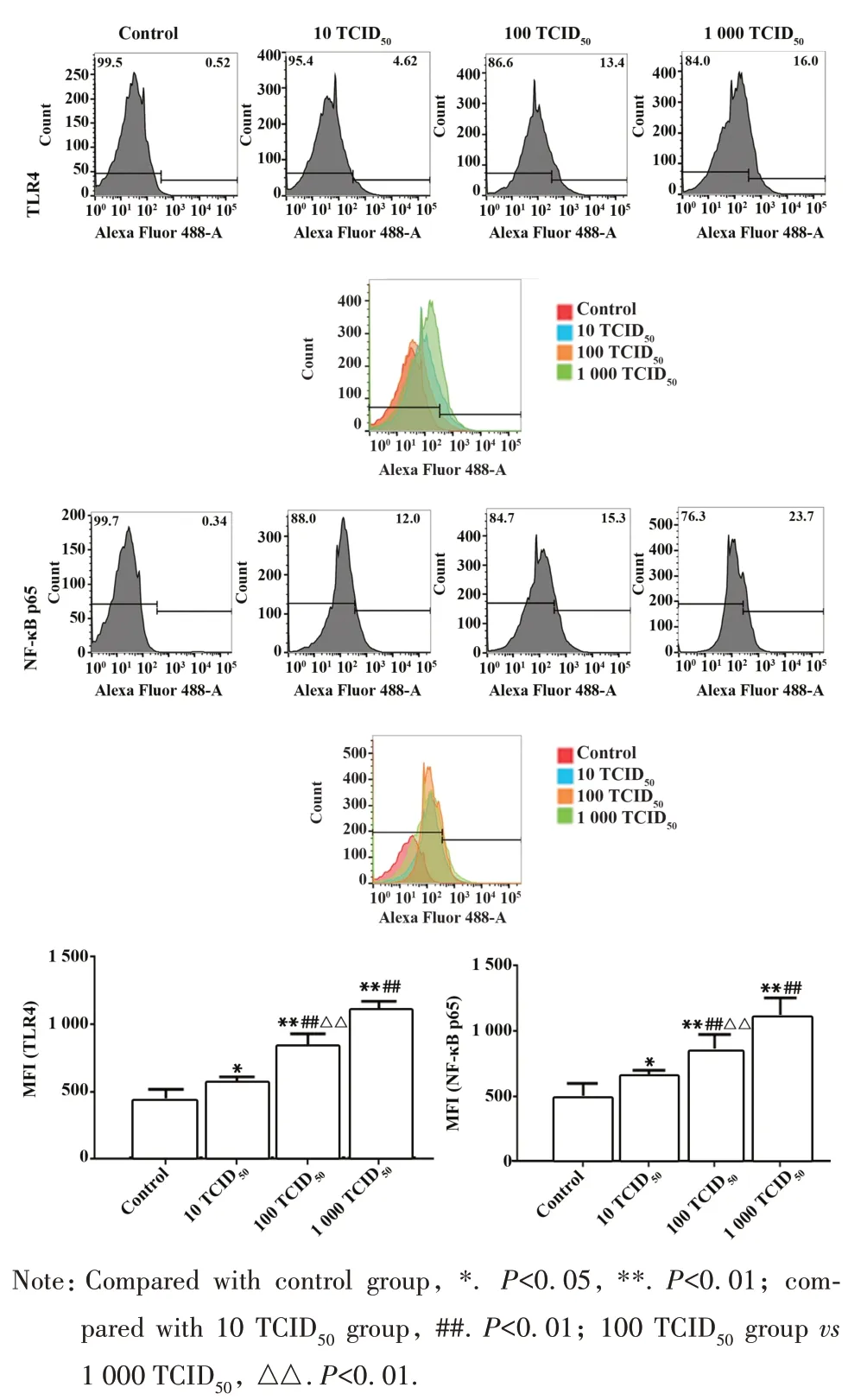
图9 FCM检测RAW264.7细胞TLR4和NF-κB p65表达Fig.9 Expressions of TLR4 and NF-κB p65 in RAW264.7 cells detected by FCM

图10 RAW264.7细胞TLR4和NF-κB p65蛋白表达Fig.10 Protein expressions of TLR4 and NF-κB p65 in RAW264.7 cells
2.7 RAW264.7细胞炎症因子水平 qPCR和ELISA结果显示,与对照组比较,10 TCID50组、100 TCID50组和1 000 TCID50组细胞IL-6、TNF-α和IFN-β mRNA水平和培养液各因子浓度均明显上升(P<0.05),且1 000 TCID50组上升幅度显著高于100 TCID50组(P<0.01)。与 10 TCID50组比较,100 TCID50组和1 000 TCID50组各因子mRNA 水平不同程度升高(P<0.05,图11)。
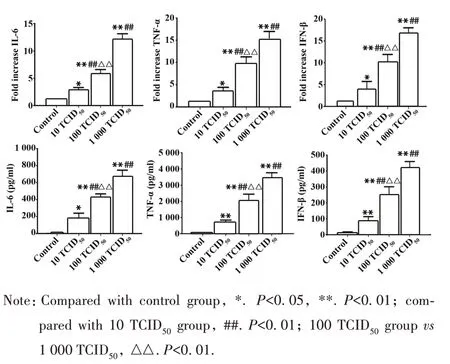
图11 RAW264.7细胞IL-6、TNF-α和IFN-β水平Fig.11 Levels of IL-6,TNF-α and IFN-β in RAW264.7 cells
2.8 RAW264.7 细胞感染剂量与各指标相关性分析 RAW264.7 细胞 感染 10 TCID50、100 TCID50和1 000 TCID50不同病毒载量PR8,感染剂量与细胞凋亡率(FCM)和胞内NP(FCM)、TLR4(FCM)、NF-κB p65(FCM)、IL-6、TNF-α 和 IFN-β(qPCR)水平呈正相 关(r=0.634,P=0.002;r=0.747,P<0.001;r=0.812,P<0.001;r=0.790,P<0.001;r=0.805,P<0.001;r=0.874,P<0.001;r=0.863,P<0.001)。
3 讨论
流感病毒感染后引起细胞膜改变、细胞损伤及死亡、炎症反应和组织免疫病理损伤,诱导一系列抗病毒免疫应答,非特异性免疫系统是抵御病原入侵的第一道防线[6]。单核-吞噬细胞系统是抗病毒免疫的重要因素,包括血循环中的单核细胞及组织中的巨噬细胞[7]。流感病毒感染后,巨噬细胞迁移至感染部位,加工处理提呈抗原,并释放大量活性递质发挥杀伤功能[8-9]。国内外研究多集中于生物制剂/化学物质活化巨噬细胞发挥抗病毒作用,但不同剂量病毒感染对巨噬细胞免疫指标的差异性影响罕见报道[10-16]。本文以 10 TCID50、100 TCID50和1 000 TCID50低、中、高剂量H1N1 型流感病毒感染RAW264.7细胞,比较巨噬细胞感染状态、凋亡率和炎症因子相关通路指标,初步探讨固有免疫细胞抗病毒的作用机制。
本研究显示RAW264.7细胞感染PR8后胞内出现空泡和颗粒状物质,100 TCID50组和1 000 TCID50组细胞核均有不同程度亮蓝色碎块状致密浓染,且细胞凋亡率显著高于10 TCID50组。RAW264.7 细胞感染 PR8 48 h 后病毒 mRNA 和 Influenza NP 显著升高,100 TCID50组和 1 000 TCID50病毒 mRNA 和 NP表达均高于10 TCID50组。提示RAW264.7 细胞感染不同病毒载量PR8 后细胞感染状态和凋亡率存在显著差异。Spearman 相关分析证实RAW264.7细胞感染低、中、高病毒载量PR8 后,感染剂量与细胞凋亡率和胞内NP水平呈正相关,RAW264.7细胞感染率存在剂量依赖性。
进一步对巨噬细胞表面Toll样识别受体和核转录因子 NF-κB p65 的研究发现,RAW264.7 细胞感染PR8 48 h 后TLR4 和NF-κB p65 mRNA、平均荧光强度和蛋白水平均显著升高,随感染剂量的增高呈上升趋势。流感病毒入侵巨噬细胞后其表面识别受体TLR4 高表达,识别病毒RNA,通过刺激MyD88和TRAF,最终激活NF-κB 信号通路,促进炎症因子的分泌。RAW264.7 细胞感染病毒后,IL-6、TNF-α和IFN-β mRNA 水平和培养液各因子浓度均显著上升,100 TCID50组和1 000 TCID50组各因子水平较比10 TCID50组有不同程度升高,且1 000 TCID50组各指标显著高于100 TCID50组。提示RAW264.7 细胞感染低、中、高病毒载量PR8后TLR4、NF-κB p65、IL-6、TNF-α 和 IFN-β 水平差异显著。Spearman 相关分析证实RAW264.7 细胞感染低、中、高不同病毒载量PR8,感染剂量与 TLR4、NF-κB p65、IL-6、TNF-α 和IFN-β 水平呈正相关,RAW264.7 细胞抗病毒状态有剂量依赖性。由此可见,高剂量病毒感染诱导巨噬细胞通过Toll-NF-κB 通路活化,产生高水平炎症因子以清除病毒,致使细胞抗病毒状态维持较高水平,最终导致高剂量1 000 TCID50组病毒增殖和细胞凋亡率较比100 TCID50组仅有小幅度升高,而无统计学意义。
综上所述,巨噬细胞RAW264.7 通过上调TLR4-NF-κB 信号通路诱导下游炎症因子表达发挥抗病毒增殖效应,且感染剂量与巨噬细胞抗病毒状态呈正相关。

