紫杉醇通过调控JAK2/STAT3通路对肝纤维化模型大鼠Th17/Treg影响的研究
冯 锦 吴建红 熊响莲 莫 若 徐容军 (武汉市金银潭医院肝病科,武汉 430010)
乙肝病毒(hepatitis B virus,HBV)是引起肝纤维化的主要原因之一,若纤维化进程无法得到有效控制,则会发展为肝硬化甚至肝癌[1]。在肝纤维化过程中,Janus 激活激酶 2(Janus-activating kinase 2,JAK2)表达和活性增加,促进信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3),诱导 IL-6 及 TGF-β1 表达,促进纤维化[2]。紫杉醇是最重要的抗癌药物之一,可用于治疗不同类型的癌症。研究显示,抑制JAK2/STAT3信号通路会提高紫杉醇对肺癌细胞的杀伤作用[3]。最近研究发现紫杉醇有望用于治疗纤维化类疾病,一项Ⅱ期临床研究显示,紫杉醇的应用有助于缓解肺癌患者的肺间质纤维化情况[4]。也有体内实验显示,紫杉醇会通过抑制TGF-β1 表达缓解大鼠肾纤维化[5],但关于紫杉醇对肝纤维化的影响及作用机制仍不明确。研究显示,免疫炎症反应在肝纤维化进程中发挥重要作用,在肝纤维化患者体内存在T 淋巴细胞亚群的改变,具有抗炎作用的T 辅助细胞17(T helper cells 17,Th17)比例提高,而具有抗炎作用的调节性T细胞(regulatory T cells,Treg)水平则降低[6]。最新一项研究显示,Th17/Treg 平衡受JAK2/STAT3 通路调控[7]。本研究主要分析紫杉醇对HBV 相关肝纤维化大鼠T 淋巴细胞亚群的影响,并分析其对JAK2/STAT3通路的影响及作用机制。
1 材料与方法
1.1 材料 SPF 级雄性HBV 转基因小鼠(北京维通利华动物公司,中国);四氯化碳、TRIzol(Sigma 公司,美国);HE染色、Masson染色和ELISA试剂盒(碧云天公司,中国);PrimeScript-RT 和SYBR Premix Ex Taq 试剂盒(TaKaRa 公司,日本);RIPA 裂解缓冲液(Beyotime,中国北京);BCA 试剂盒(武汉博斯特生物技术有限公司,中国);抗体(Abcam 公司,美国)。PVDF 膜(Bio-Rad 公司,美国);流式细胞仪及小鼠Treg/Th17 表型抗体试剂(Becton Dickinson 公司,美国);免疫磁珠(Invitrogen 公司,美国);酶标仪(Model 680,Bio-Rad,美国);组织匀浆机(Thermo Fisher Scientific公司,美国)。
1.2 方法
1.2.1 分组、建模和干预 36 只大鼠随机分为对照组、模型组和紫杉醇组(n=12)。模型组和紫杉醇组小鼠根据参考文献[8]的方法构建HBV 相关肺纤维化模型。将四氯化碳溶解于橄榄油,浓度为10%,腹腔注射,每次1 ml/kg,每周2次,连续8周,对照组注射等量生理盐水。建模期间,紫杉醇组每日尾静脉注射紫杉醇[5],在第 6、7、8 周进行,剂量为2 mg/kg,1 次/d,连续3 周。对照组和模型组幼鼠使用等量的生理盐水干预。
1.2.2 ELISA 检测肝功能 取小鼠眼眶血,以3 000 r/min 离心15 min,收集上清液,根据试剂盒说明书加入抗体和显色剂,终止显色反应后15 min 内通过酶标仪检测450 nm 处的吸光度值,然后根据标准曲线计算AST和ALT的浓度。
1.2.3 HE 染色检测肺组织损伤 小鼠经颈椎脱臼处死,收集肺动脉血管组织并置于多聚甲醛固定48 h。将固定好的组织样本利用梯度浓度乙醇脱水,然后加入二甲苯透明处理并包埋至石蜡中,使用切片机切成4µm 厚的切片。切片水化后制成玻片标本,加入苏木精孵育5 min,然后加入0.5%的伊红染色5 min,洗涤后透化,固定,在显微镜下观察。
1.2.4 Masson 染色检测纤维化 将1.2.2 中的玻片标本加入Masson 三色染料进行染色,根据试剂盒说明书方法操作,最后在显微镜下观察并拍照,利用IPP6.0 图像分析系统计算胶原蛋白的体积分数(CVF)。
1.2.5 RT-qPCR 检 测 mRNA TRIzol 法 获 得 肝 组织中的总RNA,采用逆转录试剂盒将1 µg 的RNA逆转录为cDNA(42 ℃ 60 min,70 ℃ 5 min,然后 4 ℃保存)。使用SYBR Green PCR Master Mix 和PCR 检测系统进行 qPCR 实验(95 ℃ 10 min,40 个循环,94 ℃ 15 s,60 ℃ 1 min,60 ℃ 1 min,4 ℃保存)。以GAPDH 为内参,通过比较循环阈值分析mRNA 的表达水平。
1.2.6 Western blot 检测蛋白 将心肌组织用匀浆机均匀研磨并萃取出总蛋白,通过BCA 试剂盒测定浓度。分别取40 µg 总蛋白行10%SDS-PAGE 电泳(80~120 V,90 min)。在100 mV 的恒定电压下湿转至PVDF 膜。将 1∶500 稀释的anti-TLR4、anti-NF-κB加入分离的蛋白质,并在4 ℃下孵育过夜。洗涤后室温下添加二抗孵育1 h。然后加入化学发光试剂显影。以GAPDH 为内参,Image J 软件分析目标条带的灰度值。
1.2.7 流式细胞术检测Th17 和Treg 外周血经密度梯度离心后抽吸淋巴细胞层,获得单个淋巴细胞悬浮液。细胞用20µl预冷的1×BD Mouse缓冲液在暗室、4 ℃条件下固定30 min,然后洗涤固定剂并收集细胞。细胞中加入200µl 通透缓冲液,并将细胞在37 ℃下避光孵育30 min。洗涤后将细胞分别与20µl 小鼠Treg/Th17 表型抗体试剂或对照抗体在室温下孵育30 min。然后洗掉抗体,将细胞重悬并通过FACS Calibur 流式细胞仪检测,分析Th17 和Treg的百分比。
1.2.8 Western blot 检测淋巴细胞中JAK2/STAT3通路 首先通过密度梯度离心法分离单个核细胞,使用免疫磁珠分离T 淋巴细胞,然后根据1.2.6 方法检测JAK2和STAT3蛋白表达水平。
1.3 统计学处理 统计分析使用SPSS19.0 软件。数据以表示。多组间比较进行单因素方差分析,两两比较使用SNK-q检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 紫杉醇对肝纤维化模型小鼠肝功能指标的影响 三组小鼠肝功能指标比较差异有统计学意义(P<0.05)。模型组ALT 和AST 水平显著高于对照组(P<0.05),紫杉醇组ALT 和AST 水平显著低于模型组(P<0.05),见表1。
表1 紫杉醇对肝纤维化模型小鼠肝功能指标的影响()Tab.1 Effect of paclitaxel on liver function indexes of hepatic fibrosis model mice()

表1 紫杉醇对肝纤维化模型小鼠肝功能指标的影响()Tab.1 Effect of paclitaxel on liver function indexes of hepatic fibrosis model mice()
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
AST/(U·L−1)114.68±9.67 275.12±28.061)186.34±21.342)67.473 0.000 Groups Control Model Paclitaxel n 12 12 12 F P ALT/(U·L−1)37.95±4.06 147.42±16.881)80.28±9.472)93.624 0.000
2.2 紫杉醇对肝纤维化模型小鼠肝组织损伤的影响 如图1所示,对照组肝组织染色均匀,细胞和呈圆形,细胞排列有序,肝小叶结构清晰。模型组肝细胞膨大,肝小叶结构遭到破坏,并出现严重的出血和炎症浸润。紫杉醇组可观察到肝小叶结构,炎症浸润情况较模型组轻。

图1 HE 染色检测紫杉醇对肝纤维化小鼠肝组织损伤的影响(×200)Fig.1 HE staining to detect effect of paclitaxel on liver tissue damage in mice with hepatic fibrosis(×200)
2.3 紫杉醇对肝纤维化模型小鼠肝纤维化的影响 如图2所示,红色为细胞,蓝色为被染色的胶原蛋白等纤维化组织。三组CVF 水平比较差异有统计学意义(P<0.05)。模型组CVF 水平显著高于对照组(P<0.05),紫杉醇组CVF 水平显著低于模型组(P<0.05),见表2。
表2 紫杉醇对肝纤维化模型小鼠肝纤维化的影响()Tab.2 Effects of paclitaxel on liver fibrosis in model mice with hepatic fibrosis()

表2 紫杉醇对肝纤维化模型小鼠肝纤维化的影响()Tab.2 Effects of paclitaxel on liver fibrosis in model mice with hepatic fibrosis()
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
CVF(%)0.89±0.14 11.24±1.641)4.15±0.982)167.743 0.000 Groups Control Model Paclitaxel n 12 12 12 F P
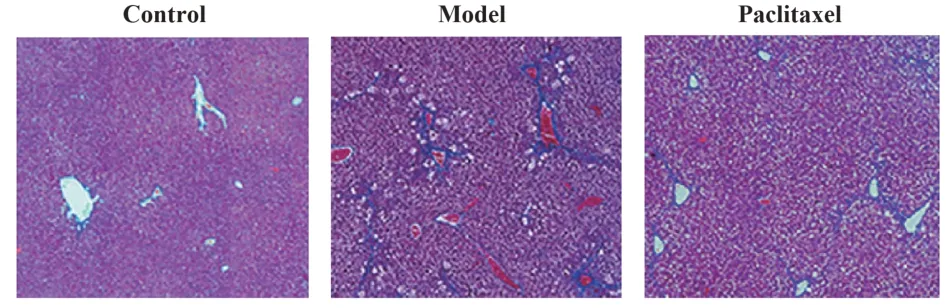
图2 Masson 染色检测紫杉醇对肝纤维化小鼠肝纤维化的影响(×200)Fig.2 Masson staining to detect effect of paclitaxel on liver fibrosis in mice with hepatic fibrosis(×200)
2.4 紫杉醇对肝纤维化模型小鼠肝组织中IL-6 和TGF-β1 蛋白表达水平的影响 三组小鼠肝组织中IL-6 和TGF-β1 蛋白表达水平比较差异有统计学意义(P<0.05)。模型组IL-6 和TGF-β1 蛋白水平显著高于对照组(P<0.05),紫杉醇组 IL-6 和TGF-β1 蛋白水平显著低于模型组(P<0.05),见图3、表3。
表3 紫杉醇对肝纤维化模型小鼠肝组织中IL-6和TGF-β1蛋白表达的影响()Tab.3 Effect of paclitaxel on expressions of IL-6 and TGF-β1 protein in liver tissue of hepatic fibrosis model mice()
表3 紫杉醇对肝纤维化模型小鼠肝组织中IL-6和TGF-β1蛋白表达的影响()Tab.3 Effect of paclitaxel on expressions of IL-6 and TGF-β1 protein in liver tissue of hepatic fibrosis model mice()
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
TGF-β1 0.72±0.07 3.87±0.351)2.18±0.202)215.743 0.000 Groups Control Model Paclitaxel n 12 12 12 F P IL-6 0.64±0.06 2.47±0.221)1.57±0.132)175.883 0.000

图3 Western blot检测紫杉醇对肝纤维化模型小鼠肝组织中IL-6和TGF-β1蛋白表达的影响Fig.3 Effect of paclitaxel on expressions of IL-6 and TGF-β1 protein in liver tissue of hepatic fibrosis model mice were detected by Western blot
2.5 紫杉醇对肝纤维化模型小鼠肝组织中JAK2和STAT3 mRNA 表达水平的影响 三组小鼠肺组织JAK2 和STAT3 mRNA 表达水平比较差异有统计学意义(P<0.05)。模型组JAK2 和STAT3 mRNA 表达水平显著高于对照组,紫杉醇组JAK2 和STAT3 mRNA表达水平显著低于模型组,见表4。
表4 紫杉醇对肝纤维化模型小鼠肝组织中JAK2 和STAT3 mRNA表达的影响()Tab.4 Effect of paclitaxel on expressions of JAK2 and STAT3 mRNA in liver tissues of model mice with hepatic fibrosis()

表4 紫杉醇对肝纤维化模型小鼠肝组织中JAK2 和STAT3 mRNA表达的影响()Tab.4 Effect of paclitaxel on expressions of JAK2 and STAT3 mRNA in liver tissues of model mice with hepatic fibrosis()
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
STAT3 mRNA 1.82±0.17 5.15±0.501)3.27±0.312)217.239 0.000 Groups Control Model Paclitaxel n 12 12 12 F P JAK2 mRNA 1.75±0.17 4.89±0.481)3.21±0.322)203.431 0.000
2.6 紫杉醇对肝纤维化模型小鼠肝组织JAK2/STAT3通路中蛋白表达水平的影响 三组小鼠肺组织JAK2/STAT3 通路中蛋白表达水平比较差异有统计学意义(P<0.05)。模型组JAK2 和STAT3 蛋白表达水平显著高于对照组,紫杉醇组JAK2 和STAT3蛋白表达水平显著低于模型组,见图4、表5。

图4 Western blot检测紫杉醇对肝纤维化模型小鼠肝组织中JAK2和STAT3蛋白表达水平的影响Fig.4 Effect of paclitaxel on expression levels of JAK2 and STAT3 protein in liver tissue of hepatic fibrosis model mice were detected by Western blot
表5 紫杉醇对肝纤维化模型小鼠肝组织中JAK2 和STAT3蛋白表达的影响()Tab.5 Effect of paclitaxel on expressions of JAK2 and STAT3 protein in liver tissues of model mice with hepatic fibrosis()

表5 紫杉醇对肝纤维化模型小鼠肝组织中JAK2 和STAT3蛋白表达的影响()Tab.5 Effect of paclitaxel on expressions of JAK2 and STAT3 protein in liver tissues of model mice with hepatic fibrosis()
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
STAT3 0.98±0.09 3.11±0.301)2.06±0.192)171.096 0.000 Groups Control Model Paclitaxel n 12 12 12 F P JAK2 0.84±0.08 3.05±0.281)2.14±0.202)175.473 0.000
2.7 紫杉醇对肝纤维化模型小鼠T 淋巴细胞亚群的影响 如图5 所示,IL-17+CD4+细胞为Th17;如图6所示,FOXO3+CD25+细胞为Treg。三组小鼠T淋巴细胞亚群比较差异有统计学意义(P<0.05)。模型组小鼠Th17 和Th17/Treg 水平显著高于对照组,Treg 水平显著低于对照组(P<0.05)。紫杉醇组Th17和Th17/Treg水平显著低于模型组,Treg水平显著高于模型组(P<0.05),见表6。

图5 紫杉醇对肝纤维化模型小鼠Th17亚群的影响Fig.5 Effect of paclitaxel on Th17 subsets in hepatic fibro⁃sis model mice

图6 紫杉醇对肝纤维化模型小鼠Treg亚群的影响Fig.6 Effect of paclitaxel on Treg subsets in hepatic fibro⁃sis model mice
表6 紫杉醇对肝纤维化模型小鼠T 淋巴细胞亚群的影响()Tab.6 Effects of paclitaxel on T lymphocyte subsets in model mice with hepatic fibrosis()

表6 紫杉醇对肝纤维化模型小鼠T 淋巴细胞亚群的影响()Tab.6 Effects of paclitaxel on T lymphocyte subsets in model mice with hepatic fibrosis()
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
Th17/Treg 0.31±0.04 1.77±0.231)0.73±0.872)97.356 0.000 Groups Control Model Paclitaxel n 12 12 12 F P Th17(%)1.05±0.16 2.75±0.381)1.94±0.202)86.586 0.000 Treg(%)3.41±0.51 1.55±0.251)2.67±0.382)92.074 0.000
2.8 紫杉醇对肝纤维化模型小鼠单个核细胞中JAK2/STAT3 通路的影响 分离外周血单个核细胞进行Western blot 实验,结果显示,三组小鼠单个核细胞中JAK2 和STAT3 蛋白表达水平比较差异有统计学意义(P<0.05)。模型组单个核细胞中JAK2 和STAT3 蛋白水平显著高于对照组(P<0.05),紫杉醇组单个核细胞中JAK2 和STAT3 蛋白显著低于模型组(P<0.05),见图7、表7。

图7 Western blot 检测紫杉醇对肝纤维化模型小鼠单个核细胞中JAK2和STAT3蛋白表达水平的影响Fig.7 Effect of paclitaxel on expression levels of JAK2 and STAT3 protein in monocytes of hepatic fibrosis model mice were detected by Western blot
表7 紫杉醇对肝纤维化模型小鼠单个核细胞中JAK2/STAT3通路的影响()Tab.7 Effect of paclitaxel on JAK2/STAT3 pathway in monocytes of hepatic fibrosis model mice()

表7 紫杉醇对肝纤维化模型小鼠单个核细胞中JAK2/STAT3通路的影响()Tab.7 Effect of paclitaxel on JAK2/STAT3 pathway in monocytes of hepatic fibrosis model mice()
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
STAT3 0.91±0.09 3.48±0.331)1.85±0.182)94.228 0.000 Groups Control Model Paclitaxel n 12 12 12 F P JAK2 0.97±0.09 3.65±0.341)1.53±0.152)97.365 0.000
3 讨论
肝纤维化可由多种因素诱发,是慢性肝损伤的伤口愈合反应,肝纤维化参与肝损伤、肝硬化抑制肿瘤的病理过程。HBV 感染是引起肝炎、肝纤维化、肝硬化的最主要因素之一,肝纤维化严重影响患者的生活质量和生命健康,但目前尚无治疗肝纤维化的特效疗法[9]。因此,寻找能够有效缓解肝纤维化的方法具有重要的临床意义。
作为一种天然产物,紫杉醇在治疗恶性肿瘤中具有广泛应用,其可通过影响微管蛋白二聚体的动态平衡诱导细胞凋亡并抑制增殖[10]。近年来研究显示,低于细胞毒性浓度的紫杉醇具有抗纤维化作用。最新研究结果显示,对于牛血清白蛋白诱导的肝纤维化模型,紫杉醇具有缓解肝损伤和抑制纤维化进程作用[11]。也有研究显示,雾化紫杉醇脂质体吸入可缓解博来霉素诱导的大鼠肺纤维化[12]。但对于HBV 相关的肝纤维化,紫杉醇是否发挥作用仍不清楚。本研究利用感染HBV 的小鼠诱导肝纤维化模型,并通过HE 染色和Masson 染色验证了建模结果。结果表明,紫杉醇干预可明显抑制肝组织损伤,保护肝功能,抑制纤维化。提示紫杉醇对于HBV 相关的肝纤维化也具有缓解作用。此外,本研究还显示模型组小鼠肝组织中JAK2、STAT3 mRNA和蛋白水平显著升高,而紫杉醇会抑制JAK2 和STAT3 的转录和翻译。JAK2/STAT3 通路的激活可提高纤维化执行因子IL-6和TGF-β1的表达水平,研究显示,JAK2/STAT3通路的提高会引起肿瘤细胞对紫杉醇的抗性,且紫杉醇对JAK2/STAT3 通路也具有抑制作用[13-15]。提示紫杉醇可能通过抑制JAK2/STAT3 通路抑制STAT3 的转录功能,从而减少IL-6和TGF-β1 的表达水平,进而抑制纤维化,保护肝功能。
近年来研究显示,HBV 感染会诱导Th17/Treg平衡失调,在合并HBV 感染的肝纤维化患者外周血中,Th17/Treg 平衡向 Th17 偏移[16]。Th17 细胞比例的升高可诱导巨噬细胞、中性粒细胞等活化并诱发炎症反应;此外,Th17 可通过诱导 IL-6 和 TGF-β1 表达促进纤维化[17]。Treg 可拮抗 Th17 及其细胞因子的功能,从而抑制纤维化[18]。重要的是,T 淋巴细胞的分化也受JAK2/STAT3 通路调控,JAK2/STAT3 通路的激活会促进单核细胞分化为Th17,并且抑制Treg 分化[19]。本研究结果显示,在 HBV 相关的肝纤维化小鼠模型中,Th17/Treg 平衡向Th17 偏移,淋巴细胞中JAK2 和STAT3 蛋白水平也升高,而紫杉醇可抑制Th17 诱导Treg,并抑制淋巴细胞中JAK2/STAT3 通路。研究显示,紫杉醇可调控接受化疗的宫颈癌患者的免疫功能,调控T 淋巴细胞分化[20]。FONG 等[21]的研究结果也显示,在癌症中,紫杉醇可调控Treg 分化调节免疫水平。提示紫杉醇不但可通过抑制肝组织中JAK2/STAT3 抑制纤维化,还可能通过抑制JAK2/STAT3 通路抑制T 淋巴细胞向Th17 分化并诱导Treg 分化,从而抑制免疫炎症反应,进一步抑制肝纤维化,保护肝功能。
综上所述,紫杉醇可减少肝组织中IL-6和TGF-β1表达,并诱导失衡的Th17/Treg 平衡向Treg 偏移,从而缓解HBV 相关的肝纤维化,且紫杉醇抗纤维化的机制可能与其具有抑制JAK2/STAT3 通路的作用有关。但关于紫杉醇抑制HBV 相关肝纤维化的疗效仍需进一步的临床研究验证,且其作用机制需要深入探究。

