调控γδT细胞受体对脑缺血再灌注小鼠Treg及细胞因子的影响①
刘宏为 李冶秋 王 勇 朱宏飞 (天门市第一人民医院神经内科,天门 431700)
心脏骤停(cardiac arrest,CA)是严重危害人类生命健康的疾病之一,虽然快速有效的心肺脑复苏(cardiopulmonary-cerebral resuscitation,CPCR)可减轻CA 的危害,但其病死率仍然很高,主要原因为器官缺氧缺血后再灌注损伤[1-4]。研究表明,大脑对缺血缺氧非常敏感,其损伤是CA 患者的主要死亡原因,67.7%院外和22.9%院内CA 患者死亡由脑损伤所致,仅12.3%CA 患者在CPCR 后具有良好的神经功能预后[5]。因此脑功能恢复是CPCR的关键。
近年T 细胞在心肌缺血/再灌注损伤中的作用逐渐被揭示,其缺失可减轻全脑缺血再灌注损伤[6]。γδT 细胞是一种作用介于固有免疫和适应性免疫的T 细胞,其分泌的细胞因子IL-17A 可增加心肌梗死面积,但其在CPCR 后全脑缺血再灌注损伤发病机制中的作用研究较少[7]。本研究建立小鼠CPCR 模型,探究γδT 细胞受体拮抗剂对Treg 及相关细胞因子的影响,旨在为研究γδT 细胞受体在CPCR 后全脑缺血再灌注损伤发病机制中的作用提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 100 只SPF 级健康成年雄性C57BL/6 小鼠,7~9 周龄、体质量 20~25 g(合格证号:11400700257295),购于北京维通利华实验动物技术有限公司[SCXK(京)2016-0006]。置于12 h 光/12 h暗(光照时间7:00~19:00)、(22±2)℃、(52±2)%湿度环境饲养,自由饮食和饮水。本研究所有动物实验均按照国家相关法律及动物伦理学要求在武汉大学动物实验中心进行。
1.1.2 主要试剂及仪器 ELISA 试剂盒、TUNEL细胞凋亡检测试剂盒(显色法)、RIPA(强)组织细胞快速裂解液、BCA 蛋白浓度测定试剂盒(增强型)、PBS磷酸盐缓冲液购自武汉贝茵莱生物科技有限公司;甲醛、无水乙醇购自国药集团化学试剂有限公司;十二烷基硫酸钠(SDS)、TEMED、过硫酸铵购自美国 Sigma;PVDF 膜、化学发光试剂、UPT 优普特实验室超纯水器购自法国Millipore;小动物呼吸机购自美国Harvard Apparatus;正置显微镜购自德国Leica;移液器购自法国Gilson;酶标仪、洗板机购自芬兰Thermo Labsystems。
1.2 方法
1.2.1 CA-CPCR 模型构建 小鼠麻醉后插管,连接小动物呼吸机行机械通气,小鼠各项指标维持如下标准10 min:直肠温度(Trec)为(37.0±0.5)℃,呼吸末二氧化碳分压(EtCO2)35~45 mmHg,心率(HR)>200 次/min,动脉血压(MAP)>60 mmHg,静脉注射70 µl 0.5 mol/L(4 ℃)KCl,关闭呼吸机诱导小鼠CA,心电图活动停止且动脉血压迅速下降至<10 mmHg即为诱导成功。经过6 min 的CA 后,手动进行CPCR(胸外按压,约300次/min),静脉注射0.5 ml肾上腺素(生理盐水溶解,16µg/ml),重新以190次/min机械通气,胸部按压根据MAP和EtCO2调整,如小鼠2.5 min 内未恢复自主循环及呼吸则宣布失败。MAP<50 mmHg 时,静脉注射0.1~0.2 ml 肾上腺素生理盐水溶液(16µg/ml);自主呼吸恢复至60次/min后45 min 停止呼吸机,拔除气管导管及各种导管并对伤口进行闭合处理,放回笼中饲养。
1.2.2 神经功能评分 小鼠苏醒后参照LONGA等[8]5 分制法进行神经功能评分。0 分:无神经功能缺损体征;1 分:左侧前肢不能完全伸展;2 分:大鼠行走时向左侧转圈;3 分:大鼠行走时身体向左侧倾倒;4 分:意识丧失,不能自发行走。分值越高表示神经功能缺损越严重,其中1~3分者为实验对象,因麻醉未清醒和经解剖证实为蛛网膜下腔出血者不计入实验组。
1.2.3 分组及处理 实验共分为3 组:对照组(无CA/CPCR 组)、CPCR组(诱发CPCR后全脑缺血再灌注损伤);CPCR+γδT细胞受体拮抗组(CPCR 处理后立即腹腔注射γδT 细胞受体拮抗药物UC7-13D5,250 µg,2 d),每组 30 只,对照组及 CPCR 组腹腔注射等体积生理盐水。
1.2.4 小鼠动脉血收集 放血处死小鼠后快速断头取脑,去除嗅球、小脑及脑干等,留取大脑,各组取部分脑组织固定,进行病理学检查、免疫组织化学检查和神经元凋亡检查,其余脑组织−70 ℃冻存待检。
1.2.5 TUNEL 凋亡检测脑组织损伤 参照试剂盒说明书进行:取1.5 cm×1.5 cm×0.3 cm 组织块,置于10%甲醛固定48 h,流水冲洗并逐级脱水,移入石蜡液中包埋,置于−20 ℃冰箱中30 min 以上切片,TUNEL 检测液处理样品,PBS 冲洗 3 次,苏木素复染,脱水,透明,封片,光镜下检查,显微镜拍照,Lecia Applaction Stiue图像系统分析样本相关部位。
1.2.6 HE 染色观察神经元损伤 切片,水浴展片,捞片,将切片小心贴附于载玻片,染色:常规脱蜡,水洗1~2 min,苏木精染色3~6 min,流水洗去苏木精1~2 min,1%盐酸乙醇处理1~3 s,水洗1~2 s,促蓝液返蓝5~10 s,流水冲洗15~30 s,0.5%伊红染色2~3 min,蒸馏水洗 1~2 s,80%乙醇清洗 15~30 s,95%乙醇清洗15~30 s,无水乙醇清洗1~2 s,二甲苯清洗2~3 s,新的二甲苯清洗2~3 s,中性树胶封固,显微镜拍照,Lecia Applaction Stiue 图像系统采集分析样本相关部位。
1.2.7 ELISA 测定 MPO、TNF-α、IL-6 和 IL-1β 浓度 ELISA 试剂盒检测 TNF-α、IL-6、IL-1β 浓度及MPO活性,按试剂盒使用说明书操作。
1.2.8 Western blot 检测脑组织Foxp3 蛋白表达将组织剪成细小碎片,按每20 mg 组织加入150~250µl 裂解液的比例加入裂解液(裂解液中加入蛋白酶和磷酸酶抑制剂),匀浆至完全裂解,4 ℃、12 000 g 离心 15 min,取上清,按 BCA 试剂说明书进行蛋白质定量,−80 ℃贮存。配制12%SDS-PAGE胶,根据蛋白定量结果取所需蛋白,加入适量缓冲液,沸水浴 10 min 后离心取上清,20 µg/孔上样,浓缩胶80 V、分离胶120 V 电泳,5%脱脂奶粉室温封闭2 h。根据说明书稀释一抗,按所需稀释浓度将一抗加入封闭液中,与膜共同室温孵育1 h,PBST 洗涤3次,5 min/次。根据用量按1∶10 000稀释HRP标记的二抗,室温孵育 1 h,PBST 洗涤 3 次,5 min/次,暗室中等量混匀ECL 发光液A、B,加在膜的正面与之充分接触,全自动化学发光分析仪检测。
1.3 统计学分析 采用SPSS17.0软件进行统计学分析,数据均采用表示。组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 TUNEL 观察脑组织损伤 CPCR 组小鼠脑组织中神经元细胞凋亡较对照组增多,CPCR+γδT 细胞受体拮抗组较CPCR组细胞凋亡减少(图1)。

图1 TUNEL检测各组小鼠脑组织损伤Fig.1 Damage of in brain tissue of mice in each group detected by TUNEL
2.2 HE 染色观察神经元损伤 CPCR 组小鼠脑缺血灶中心区出现大量死细胞或细胞呈不规则状态肿大,核膜破裂,细胞结构消失,CPCR+γδT 细胞受体拮抗组较CPCR组病理学改变有所缓解(图2)。

图2 小鼠HE病理染色Fig.2 HE staining of mice pathology
2.3 脑组织MPO活性、TNF-α、IL-6和IL-1β浓度测定 ELISA 结果显示,CPCR 组 MPO 活性、TNF-α、IL-6 和IL-1β 浓度较对照组升高(P<0.05),CPCR+γδT 细胞受体拮抗组较 CPCR 组 MPO 活性、TNF-α、IL-6和IL-1β浓度显著下调(P<0.05,图3)。
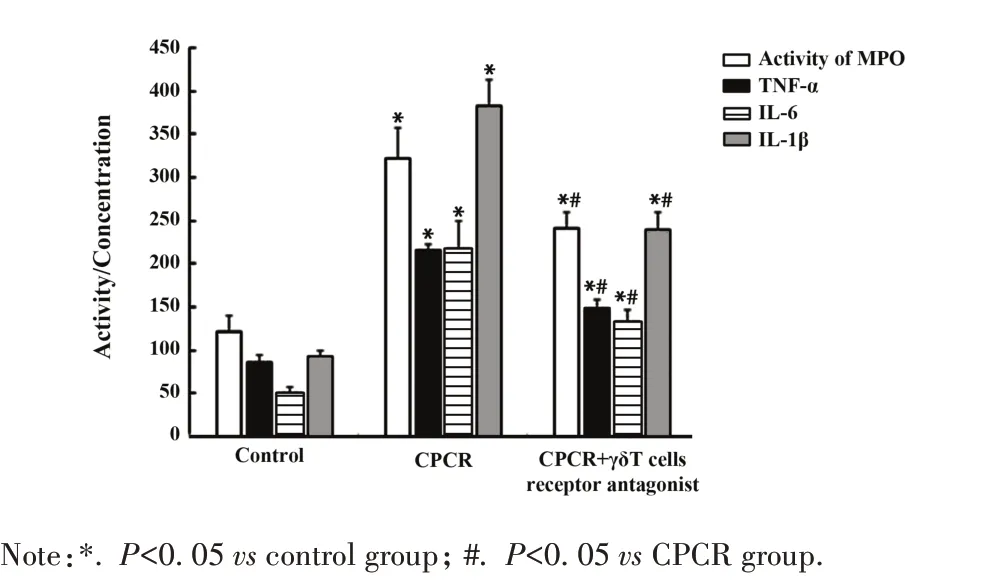
图3 各组小鼠脑组织 MPO 活性、TNF-α、IL-6 和 IL-1β浓度Fig.3 Activity of MPO,concentrations of TNF-α,IL-6,IL-1β of mice in each group
2.4 Western blot 检测脑组织Foxp3 蛋白表达Western blot结果显示,CPCR组Foxp3表达较对照组显著下调(P<0.05),CPCR+γδT 细胞受体拮抗组较CPCR组Foxp3表达上调(P<0.05,图4)。

图4 各组小鼠Foxp3表达Fig.4 Expression of Foxp3 of mice in each group
3 讨论
CA 导致的脑缺血再灌注损伤会对神经系统造成较大伤害,患者可能出现意识或警觉性降低、记忆缺失、运动不协调和癫痫发作等轻微症状,严重者可发展为脑死亡[8]。国内外对CPCR 后全脑缺血再灌注损伤的研究多数集中于氧化应激、炎症介质、神经细胞凋亡及钙超载等方面[9-10]。近年研究显示T 细胞在脑缺血再灌注损伤中也有重要作用[6]。本研究显示,CPCR 组小鼠脑缺血灶中心区出现大量死细胞或细胞呈不规则状态肿大,核膜破裂,细胞结构消失,CPCR+γδT细胞受体拮抗组较CPCR组病理学改变有所减轻,且细胞凋亡减少,提示γδT细胞在CA脑缺血再灌注中起重要作用。
炎症反应是引发脑缺血再灌注损伤的重要原因,CA/CPCR 大鼠血清 IL-1β、IL-6 和 TNF-α 浓度显著升高,抑制炎症反应对CA/CPCR 术后脑损伤保护具有重要意义[11]。研究发现,IL-1β、IL-6 等细胞因子在Th17/γδT细胞功能中发挥关键作用[12-13]。中性粒细胞为心肌缺血/再灌注损伤引起的炎症反应相关免疫细胞[14]。MPO 是炎症标志物,其活性可反映中性粒细胞的聚集程度[15-16]。Treg在心肌缺血/再灌注损伤中也发挥重要作用,可通过下调趋化因子减少嗜中性粒细胞浸润[17]。Foxp3 作为 Treg 的重要标志因子,在Treg 发育、分化和功能维持等方面发挥重要作用[18-19]。TGF-β 诱导初始 T 细胞表达 Foxp3,促使初始T 细胞分化为Foxp3+Treg,发挥免疫抑制作用,分泌抑制性细胞因子平衡Th17 细胞分泌的促炎细胞因子(如 IL-6、TNF-α)[20]。本研究表明,CPCR 组小鼠脑组织中 TNF-α、IL-6 和 IL-1β 等细胞因子浓度和MPO 活性均升高,Foxp3表达下调,提示CPCR 小鼠脑组织中存在严重炎症反应,与病理观察结果一致,经γδT细胞受体拮抗剂处理后,TNF-α、IL-6 和IL-1β 等细胞因子浓度和MPO 活性均降低,Foxp3 表达上调,提示拮抗γδT 细胞受体可抑制CPCR 小鼠脑组织炎症反应,其机制可能与Treg 分化为Foxp3+Treg,从而进行免疫抑制有关。
综上,本研究通过构建CA-CPCR 后脑缺血再灌注小鼠模型,了解到拮抗γδT 细胞受体可抑制小鼠脑组织炎症反应,对Treg 分化具有间接调控作用,有助于机体调节免疫应答与免疫抑制反应的平衡关系,进而对CA-CPCR 导致的脑缺血再灌注损伤发挥一定改善作用,为临床上降低CA-CPCR 后中枢神经系统损伤提供了参考。

