小鼠抗人B7-1单克隆抗体抑制肿瘤细胞增殖的蛋白质组学分析①
沈立军 朱雪梅 邱玉华 (苏州大学生物医学研究院,苏州 215123)
蛋白质组学是以体系中所有蛋白质为研究对象,然后进行定性、定量及相互作用分析,进而揭示蛋白质功能的一门学科。通过蛋白质组学能够找出两个甚至多个蛋白质间相互作用的关系。其中Label-free 无标记定量蛋白质组学技术是一种通过观察离子强度变化,测量两个或更多样本间表达差异蛋白的技术。Label-free 方法与其他定量蛋白质组学技术相比,无须标记,应用广泛,不受比较样品数限制,灵敏度高,重复性好,操作简便。近年来,随着先进的高通量、高灵敏和快速扫描质谱仪的快速发展,蛋白质分析鉴定技术已广泛应用于生命科学研究领域[1-2]。
B7-1(即CD80)分子是活化T 细胞的信号分子之一,主要表达于抗原提呈细胞(antigen presenting cells,APCs)表面,其与相应受体 CD28 结合可介导T细胞活化,为促使T-B细胞间的相互作用提供了重要的分子基础,从而有效地维持了机体在正常生理状态下的自我免疫应答[3-5]。相关研究发现,B7-1特异性抗体通过与APCs 表面表达的B7-1 分子相互结合,阻断或减弱B7-1-CD28 间的传递通路,抑制T 细胞增殖、促进凋亡、减少细胞因子的产生和分泌,抑制T-B 细胞间的黏附,进而抑制T 细胞介导的体液免疫应答等[6]。故此类免疫干预方法对由于免疫应答异常而引起的疾病,如自身免疫病、超敏反应和移植排斥等均具有潜在的研究和治疗意义。
研究结果表明,B7-1 分子可在人B 系恶性肿瘤细胞株中高表达,是参与T 细胞活化增殖必需的信号分子之一,推测该分子可能参与肿瘤细胞的增殖、转移及逃逸,与多种B系肿瘤的发生发展密切相关[7-9]。本文通过注射杂交瘤细胞诱导小鼠产生腹水,采用Protein A 层析技术,制备鼠抗人B7-1 单克隆抗体(命名为4E5),通过将该抗体与人B 系肿瘤细胞Daudi 共同培养,观察和分析其对肿瘤细胞体外生长和增殖的影响,在此基础上,通过Label-free定量蛋白质组学技术研究小鼠抗人B7-1 单克隆抗体抑制Daudi 细胞增殖的信号通路及机制,旨在探究B7-1 表达于B 系肿瘤表面的意义,从宏观角度为B系恶性肿瘤的发病机制、治疗及预后提供参考。
1 材料与方法
1.1 材料 SPF 级雌性裸鼠(BALB/c,3~5 周龄)购自上海实验动物中心;杂交瘤细胞株为本实验室自行制备并保存;Daudi 细胞购自ATCC 细胞库;RPMI1640 培养基、胎牛血清(FBS)购自Hyclone;胰酶购自 Mediatech;DMSO、Pristane 均购自 Sigma-Aldrich;DTT、IAA、尿素、NaHCO3均购自 Sigma;甲醇、乙醇、甲酸、蛋白酶抑制剂、乙腈均购自Thermo Fisher;MTT购自BD公司;Protein A亲和层析柱购自Merck;山羊抗小鼠 IgG-PE 购自 eBioscience;蛋白纯化仪购自GE;多功能超声仪购自Sonics;真空浓缩仪购自Eppendorf;酶标仪购自Molecular Devices;流式细胞仪购自BD 公司;Orbitrap Fusion Lumos 三合一超高分辨质谱仪购自Thermo Fisher。
1.2 方法
1.2.1 细胞培养 复苏能稳定分泌鼠抗人B7-1 单抗的杂交瘤细胞株,向培养皿中加入含10 ml/L FBS的RPMI1640 培养基,将细胞培养皿置于37 ℃、含5%CO2的培养箱中培养。
1.2.2 抗体的制备与纯化 腹腔注射0.5 ml Pris‑tane,使裸鼠致敏。离心收集生长状态良好的杂交瘤细胞,重悬并计数。向已致敏的裸鼠腹腔内注入细胞(1×107个/只),轻按裸鼠腹部,7~10 d 后腹水即可形成。抽取腹水,3 000 r/min 离心10 min,收取上清,以PBS等体积稀释,采用Protein A免疫层析法进行抗体纯化,过滤除菌后进行浓度和活性检测。
1.2.3 流式细胞术检测抗体活性 收集Daudi 细胞悬液于15 ml 离心管,1 200 r/min 室温离心5 min,弃上清,PBS 重悬细胞并计数,吸取1×106个细胞至离心管,每管加入0.2 µg 4E5 mAb 混匀,4 ℃孵育45 min,用 含 10 ml/L FBS 的 PBS 洗 涤 细 胞 3 次 ,2 000 r/min 离心5 min,弃上清,PBS 重悬,加入荧光标记的山羊抗小鼠IgG,4 ℃避光孵育染色30 min。流式细胞仪定量分析4E5 mAb 与细胞膜分子B7-1的结合。
1.2.4 MTT 法检测细胞增殖 Daudi 细胞接种于96 孔培养板(5×104个/孔),实验分为 3 组:①4E5 mAb 组(5、10、20、40 µg/ml);②同型IgG 组:等剂量的同源型IgG1 抗体;③空白对照组。培养48 h 后,每孔加入 10 µl MTT(5 mg/ml),作用 4 h 后,加入150 µl DMSO 溶液溶解结晶。读取酶标仪570 nm波长处的吸光度值(即A 值),记录结果绘制细胞生长曲线图。
1.2.5 质谱样本的处理和收集 收集处理好的Daudi 细胞,用预冷的PBS 洗涤2 次。细胞中加入含8 mol/L 尿素、1%蛋白酶抑制剂的裂解缓冲液进行超声裂解,离心取上清。向蛋白质溶液中加入终浓度为 5 mmol/L 的DTT,60 ℃条件下孵育30 min 进行还原。加入15 mmol/L 的IAA 烷基化。然后向上述体系中加入25 mmol/L 的NH4HCO3溶液置换出尿素。将胰蛋白酶和蛋白按1∶50的质量比加入胰酶,37 ℃酶切过夜。将10%TFA 加入消化后的样本终止消化,BCA 测定蛋白浓度。将该样品溶液过C18除盐小柱后收集滤液,在离心浓缩仪中常温旋干。
1.2.6 质谱检测 除盐纯化后的多肽样品通过Orbitrap Fusion Lumos 三合一质谱仪进行检测。设置质谱检测分析条件:阳离子采集模式;一级质谱扫描分辨率为60 000;高能碰撞解离(HCD)设置为15;二级质谱碰撞能量为30%。自动采集各多肽信息,获得其二级谱图。
1.2.7 数据分析 将UniProt 人源蛋白质数据库(更新于2021 年1 月 4 日)导入Proteome Discoverer 2.2(Thermo Fisher)软件,将MS/MS图谱数据输入数据库进行检索,检索方法参考文献[10],基于Labelfree定量(LFQ)在软件中表示为肽量化蛋白质丰度,将 4E5 mAb 组与同型 IgG 组均值比值≥2.0 且P<0.05 定义为蛋白表达量上调,比值≤0.5 且P<0.05定义为蛋白表达量下调。
1.2.8 平行反应监测(parallel reaction monitoring,PRM)靶向验证 选择蛋白表达量上调最显著的5个蛋白(P63218、O14813、P62861、Q9H0D6、O75340)和下调最为显著的 5 个蛋白(O43708、P35998、Q8N4Q1、Q81YS1、Q13526)进行蛋白提取,利用Skyline(v. 3.6)软件进行PRM 靶向验证。参数设置:蛋白酶为胰蛋白酶,最多允许2 次漏切位点;分析肽段长度:4~50 个氨基酸;固定氨基酸修饰:半胱氨酸烷基化、乙酰化及氧化。
2 结果
2.1 鼠抗人B7-1 单克隆抗体4E5 的制备纯化 将杂交瘤细胞注射入裸鼠腹腔后,10 只裸鼠均形成腹水,经Protein A 柱纯化抗体,共收集抗体洗脱液10.2 ml,中和过滤后测定蛋白浓度为3.83 mg/ml。
2.2 单克隆抗体4E5 活性鉴定 利用流式细胞术鉴定纯化后的抗体活性,结果显示,抗人B7-1 单克隆抗体4E5 与Daudi 细胞的阳性结合率为93.7%(图1),纯化后的抗体具有B7-1抗原结合活性。
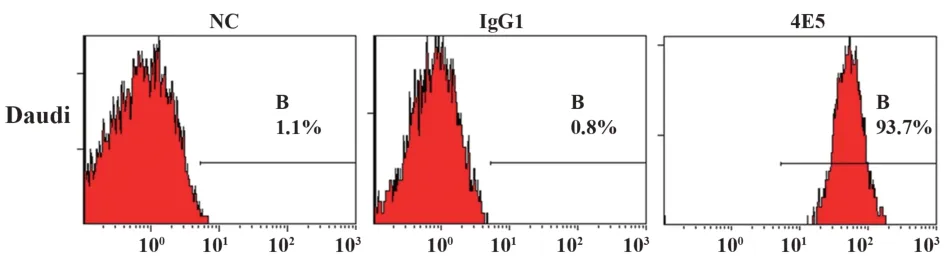
图1 4E5与Daudi细胞表面B7-1的结合率(阳性率)Fig.1 Binding rate of 4E5 mAb to membrane B7-1 of Daudi(Positive rate)
2.3 单克隆抗体4E5对Daudi细胞增殖的影响 将4E5抗体加入Daudi细胞中培养48 h,MTT 法检测结果显示,当抗体终浓度为20、40 µg/ml 时,4E5 mAb对Daudi 细胞增殖的抑制率分别为(23.52±1.25)%和(30.84±1.09)%(P<0.05,P<0.01,图2)。表明4E5 mAb可明显抑制Daudi肿瘤细胞的增殖。

图2 单克隆抗体4E5体外抑制Daudi细胞的增殖Fig.2 Inhibitory effect of 4E5 mAb on proliferation of Daudi in vitro
2.4 质谱分析结果 单克隆抗体4E5 处理Daudi细胞后的分泌蛋白经Label-free定量蛋白技术分析,共获得605 122 个二级质谱谱图数,其中与肽段相匹配的谱图数为25 362 个,有8 076 个肽段被鉴定,唯一肽段总数为7 747 个,蛋白质总数为1 705 个,如图 3A 所示。以差异倍数≥2 或≤0.5,且P<0.05 作为参考标准筛选差异蛋白,与IgG 组细胞相比,4E5组细胞中共鉴定出169个差异表达蛋白,其中131个蛋白显著上调,38 个蛋白显著下调(图3B);如图3C所示,红点在差异蛋白火山图中代表上调蛋白,蓝点代表下调蛋白,黑点代表在两组样本中未发生显著变化的蛋白;热图如图3D 所示,图中呈现的为上调和下调最显著的5 个蛋白;在这169 个差异表达蛋白中,涉及细胞增殖负调控的有11 个,涉及正调控的有1个,差异蛋白聚类热图如图3E所示。

图3 蛋白定性结果Fig.3 Results of qualitative identification of protein
2.5 PRM 靶向验证 采用靶向PRM 方法对肽段标志物进行验证,比较分析高分辨率质谱采集的10个表达差异最显著的蛋白和PRM 定量准确性,结果如表1 所示,证实PRM 的结果与蛋白组学的结果具有一致性。
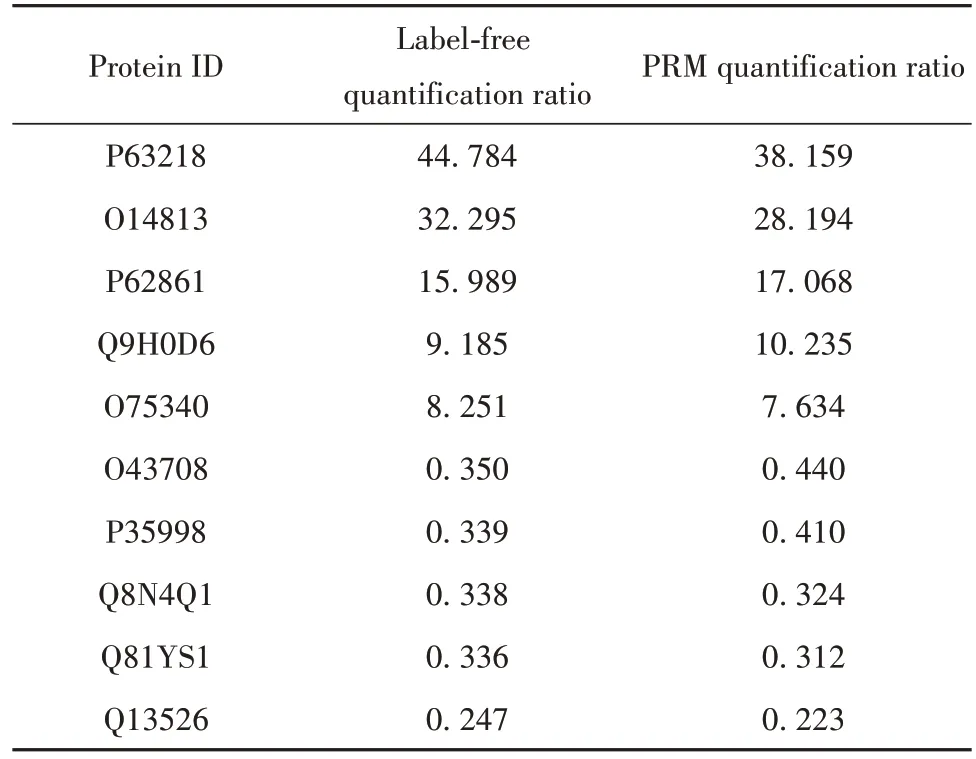
表1 PRM验证差异表达蛋白Tab.1 PRM was used to verify differentially expressed proteins
2.6 差异表达蛋白的基因本体(gene ontology,GO)注释分析 GO 分析结果显示,差异蛋白主要参与线粒体翻译的延伸和终止、细胞增殖、mRNA 的加工、剪接和翻译、细胞内蛋白运输、正转录调控、内质网到高尔基体间的囊泡运输、基因表达的正调控等生物学过程;差异蛋白主要定位于线粒体、内质网膜、高尔基体、核质等细胞器,其中大部分分布在线粒体附近;在分子功能方面,差异蛋白主要涉及调节核苷及GTP连接、调控激酶活性等,见图4。
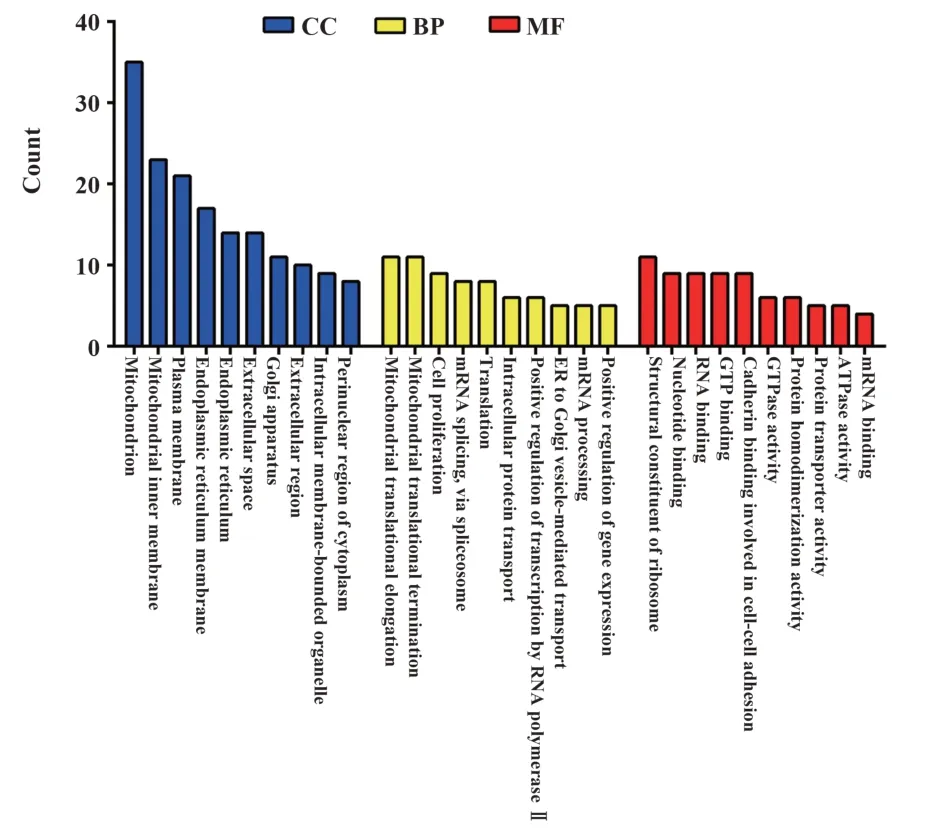
图4 差异表达蛋白在细胞成分、分子功能及生物学过程的GO富集分析Fig.4 GO enrichment analysis of differentially expressed proteins involved in cell component,molecular function and biological process
2.7 KEGG 通路分析 采用KEGG 数据库对差异表达蛋白进行通路富集分析,发现它们主要参与212 条信号通路,其中与肿瘤细胞增殖密切相关的信号通路主要有 PI3K-Akt、Ras、DNA replication、AMPK、mTOR、Hippo、VEGF、FoxO、Metabolic 等,见表2。
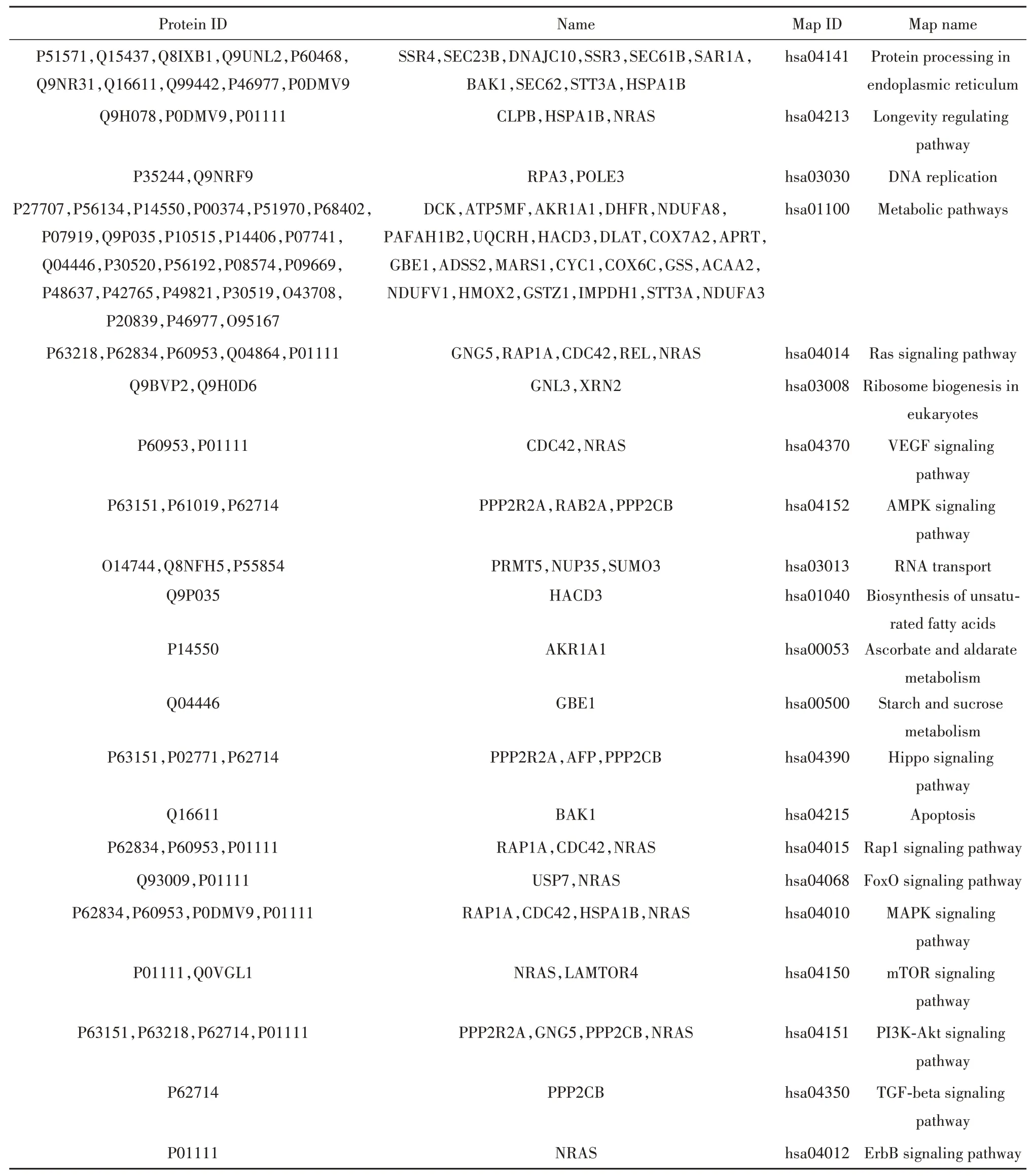
表2 KEGG通路分析与Daudi增殖相关的差异表达蛋白注释Tab.2 Annotation of differentially expressed proteins associated with proliferation of Daudi-related KEGG pathways
3 讨论
本研究利用能稳定分泌鼠抗人B7-1 mAb 的杂交瘤细胞株注射小鼠腹腔,诱导小鼠产生腹水[11-12]。采用Protein A 免疫亲和层析法纯化抗体,并通过流式细胞术鉴定抗体的纯度和活性,证实B7-1 抗体具有高特异性。
研究表明,特异性抗体具有抑瘤效应[13-14]。本研究在获取B7-1 mAb 的基础上,为探讨B7-1 在肿瘤细胞中表达的意义,以肿瘤细胞Daudi(天然高表达B7-1 分子)为实验对象,进行一系列研究。通过MTT 研究结果发现,该抗体通过与相应抗原分子B7-1 结合后在一定程度上抑制了肿瘤细胞增殖,表明肿瘤细胞表面分子B7-1 可能在肿瘤细胞的生长和增殖过程中发挥重要作用。
为进一步探讨B7-1 分子参与细胞增殖的机制,本文采用Orbitrap Fusion Lumos 三合一超高分辨质谱仪分析了小鼠抗人B7-1 单克隆抗体4E5 抑制Daudi 细胞增殖的蛋白质水平,两组细胞中共鉴定出1 705个蛋白,其中有169个差异表达蛋白。在这些差异表达蛋白中,131个蛋白表达上调,38个蛋白表达下调,涉及细胞增殖负调控的有11 个,正调控的有1个。差异表达的蛋白无疑对抑制肿瘤细胞的增殖发挥重要作用。
本研究结果表明,参与肿瘤细胞增殖调控的代表性差异蛋白有P63218、O14813、P62861、Q9H0D6、O75340、O43708、P35998、Q8N4Q1、Q81YS1、Q13526,部分代表性差异蛋白与肿瘤细胞增殖的关系已有报道[15-17]。PRM 靶向蛋白质组学技术利用高分辨率、高精度分析器采集目的肽段的所有碎片离子信息,而后选择性定量分析目标蛋白质、目标肽段,可更好地排除各种干扰因素,具有更好的高效性、准确性和灵敏度,是蛋白质组学最理想、最有效的验证手段[18-21]。本研究对5 个代表性上调差异蛋白和5 个代表性下调差异蛋白,采用PRM 手段进行靶向验证,结果证实蛋白组学结果与靶向PRM 结果一致。
GO 注释和KEGG 信号富集分析在生物信息学应用中发挥重要作用[22]。通过GO注释发现,4E5封闭的B系肿瘤细胞的差异表达蛋白主要定位于细胞器,其中又以线粒体附近最多;参与线粒体的翻译、延伸和终止,细胞增殖,mRNA的加工、剪接和翻译,细胞内蛋白运输,正转录调控等;参与29 个代谢途径,其中与细胞内部分子转运、受体活性、线粒体功能、GTP结合活性等密切相关。线粒体基因(mtDNA)表达异常可引起线粒体能量代谢障碍,进而引起神经退行性疾病、糖尿病、肿瘤等的发生[23-24]。结果显示,4E5 组细胞中线粒体相关基因(MRPL58、MRPS35、ANXA6、CLPB、TPP1、NDUFA8、BNIP1、UQCRH 等)表达发生变化,提示线粒体结构及功能异常可引起一系列的损伤过程,进而抑制肿瘤细胞增殖。
KEGG 通路富集结果显示4E5 封闭B 系肿瘤细胞可影响多个信号通路,其中与肿瘤细胞增殖密切相关的主要包括AMPK、PI3K-Akt、mTOR、Ras、DNA replication、Hippo、VEGF、FoxO、Metabolic 信号通路。AMPK 是参与能量代谢调节和多种信号传导通路的关键分子之一,其在肿瘤快速增殖的新陈代谢过程中发挥抑制作用,因此,AMPK 蛋白是各种相关疾病研究的热点[25]。KANG 等[26]发现石斑鱼在受到溶藻菌感染时,宿主发生免疫反应,CD80(B71)、P13KAkt 等表达升高刺激免疫细胞增殖,同时,具有抑制细胞增殖作用的AMPK 表达降低,帮助宿主抵御微生物病原体的侵袭。KOVACH 等[27]发现 CD80 配体和VEGF 抗体的联合用药在减少大鼠成骨细胞(OSA)异常增殖方面比任何一种抗体单独用药更为有效,VEGF 抗体靶向性OSA 细胞表面的VEGF 抗原,配体CD80 与细胞表面的CTLA-4 受体反应从而共同诱导肿瘤细胞凋亡。窦春鹏等[28]发现DC 经K-ras 突变多肽修饰后,可促进DC 表面成熟分子(CD80、CD83、CD86、HLA-DR、CD1a)高表达,进而促进DC成熟,增加CIK的增殖及对胰腺癌细胞的杀伤作用。本研究也发现,4E5 组细胞中通过封闭人B 系肿瘤细胞 Daudi 表面的 B7-1 分子导致 AMPK 信号通路发生变化,从而抑制了肿瘤细胞的快速增殖。此外,在肿瘤细胞增殖过程中发挥极其重要生物学功能的信号通路PI3K/Akt/mTOR、Ras、DNA replication、Hippo、VEGF、FoxO 等也发生了显著变化,提示4E5 也可通过其他信号通路抑制肿瘤细胞的增殖和生存,其机制有待后续探究。
综上所述,本研究通过Label-free定量蛋白质组学技术筛选出了特异性鼠抗人B7-1 单抗处理B 系肿瘤细胞Daudi后的差异蛋白,并分析了其GO 功能与KEGG 富集通路,揭示了差异蛋白参与的生物学功能及信号通路,从一定程度上为B 系肿瘤的诊断和治疗方案提供了研究方向和理论依据。

