PD-1/PD-L1抑制剂联合化疗对比免疫单药治疗晚期NSCLC疗效及安全性的Meta分析
韩丽炘,黄 玉,温娟娟
(山西大同大学医学院,山西大同 037009)
肺癌是全球癌症导致死亡最常见的原因之一,据统计,大多数晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者5年生存率仅在5%左右[1]。近年来,随着免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)的发展,多项研究证实,一线接受免疫检查点抑制剂治疗可以为肺癌患者带来长久的生存获益[2]。其中以程序性死亡受体-1(programmed cell death-1,PD-1)为靶点的帕博利珠单抗(pembrolizumab)等和以程序性死亡-配体1(programmed cell deathligand 1,PD-L1)为靶点的阿替利珠单抗(atezolizumab)等药物疗效尤为突出[3]。包括KEYNOTE-024、KEYNOTE-042[4-5]等在内的多项III 期临床试验均证实了ICIs单药疗效优于化疗。据此,FDA同意了帕博利珠单抗作为高表达PD-L1(TPS≥50%)、无EGFR 或ALK基因突变的转移性NSCLC的一线治疗[6]。之后,KEYNOTE-189[7]、KEYNOTE-407[8]临床试验证实了联合化疗也可以进一步提高晚期NSCLC的疗效。但是在2017 年CheckMate 026[9]研究中,Nivolumab 在PD-L1 表达阳性人群中却没有取得预期的疗效。
由于缺乏头对头的比较,PD-1/PD-L1 抑制剂联合化疗较其单药相比是否可以进一步改善PD-L1 表达阳性人群的治疗效果,甚至在一些PD-L1 表达阴性的人群中,运用免疫治疗是否可以使患者生存获益,这些都是亟待解决的问题。本研究通过Meta 分析,评估在不同PD-L1表达情况下,PD-1/PD-L1 抑制剂联合化疗、PD-1/PD-L1 抑制剂单药以及化疗三者在晚期NSCLC患者中的治疗效果与安全性的差异。
1 资料与方法
1.1 研究内容
纳入国内外公开发表的关于PD-1/PD-L1抑制剂单药或联合化疗对比单独化疗一线治疗晚期NSCLC的临床随机对照试验(randomized controlled trials,RCTs),语种限定为中文和英文。
1.2 文献纳入与排除标准
1.2.1 纳入标准
(1)研究类型:已公开发表的临床Ⅲ期随机对照试验。
(2)研究对象:确诊后未接受治疗的晚期(IIIBIV期)NSCLC患者。
(3)干预措施:PD-1/PD-L1 抑制剂、化疗药物、PD-1/PD-L1抑制剂+化疗药物用作一线治疗。
(4)结局指标:以无进展生存期(PFS)、总生存期(OS)指标评估预后,主要结果表现为风险比(HR)及其95%置信区间(CI)。根据常见不良反应事件评价标准4.0(CTCAE4.0)评价不良反应,分为5 级,以3~5级治疗相关不良反应发生率进行评估。
1.2.2 排除标准
①临床试验设计不严谨,未设对照组;②报告缺乏足够的数据或未能提供相关结局指标;③重复发表的研究只纳入最新的研究数据;④系统评价,荟萃分析,综述,病例报道,回顾性研究。
1.3 文献检索
按照Cochrane 手册制定相应检索策略及检索词[10]。中文检索词包括PD-1/PD-L1 抑制剂的相关药物中文名称,常用化疗药物名称如培美曲塞、顺铂等,PD-1/PD-L1 抑制剂,化疗,非小细胞肺癌(肺鳞癌、肺腺癌),免疫治疗;英文检索词包括PD-1/PD-L1抑制剂药物英文名称如pembrolizumab,nivolumab,camrelizumab 等,常用化疗药物英文名称如pemetrexed,paclitaxel,cisplatin,carboplatin,PD-1/PD-L1,chemotherapy,non-small lung cancer(NSCLC),immunotherapy。
通过计算机对PubMed,Embase,web of science,Cochrane 图书馆,中国生物医学文献数据库(CBM)、中国期刊全文数据库(CNKI)、中文科技期刊全文数据库(VIP)、万方数据库等进行检索。另外辅以手动检索,检索文献中引用的参考文献,期刊杂志、ESMO、ASCO 等重要会议摘要,作为计算机检索的补充。检索项目包括题目、摘要、关键词。检索时限自建库起至2021 年7 月,检索结果只纳入最新的和最完整的版本。
1.4 资料提取
由2名研究者独立进行数据提取并核对,提取内容包括文献一般特征、样本量、PD-L1表达情况、干预措施、结局指标及不良反应发生率等数据。研究终点为总生存期(OS)或无进展生存期(PFS),结局测量指标包括风险比(HR)及95%置信区间(CI)。
1.5 质量评估
根据Cochrane手册对纳入研究进行质量评价。纳入文献均为RCT研究,统一采用Cochrane质量评价偏倚风险表进行评估,内容包括:生成随机序列的方法、分配隐藏、参与者和实施者双盲、评估结局的盲法、结局数据缺失(失访偏倚)以及发表偏倚和其他偏倚。
1.6 统计学方法
使用RevMan 5.3 进行Meta 分析。选用卡方检验和I²值对异质性进行评估,当P>0.1,I²<50%时,表示各研究结果之间统计学异质性较小,选择固定效应(Fixed effect)模型;反之,使用随机效应(Random effect)模型。各研究间异质性过大时进一步行亚组分析。OS、PFS 等生存资料采用风险比(hazard ratio,HR)及其标准误(SE)作为检验统计量,区间估计采用95%置信区间(CI)表示,不良反应等计数资料采用优势比(odds ratio,OR)作为效应分析统计量。对于所有的统计分析,P<0.05 被认为有显著的统计学意义。本研究采用漏斗图对发表偏倚进行分析。根据PD-L1 表达情况进行亚组分析,采用R 软件进行统计汇总。
1.7 数据分析
分别对A 组(PD-1/PD-L1 抑制剂+化疗)与C 组(化疗)、B组(PD-1/PD-L1抑制剂单药)与C组(化疗)的治疗效果进行直接比较。其次,由臂C 连接,对臂A 与臂B 之间进行间接比较。调整后的间接比较使用Mauger D[11]提到的方法进行计算,公式如下:logHRAB=logHRAC-logHRBC,其标准误(SE)公式如下:SE(logHRAB)=[12]。OR的计算方法与上述公式类似。
2 结果
2.1 检索结果
按照制定的检索策略共检索相关文献2 606篇,依据纳入与排除标准进行筛选,最终纳入符合要求的13篇文献,共计7 281名患者,文献筛选流程及结果见图1。
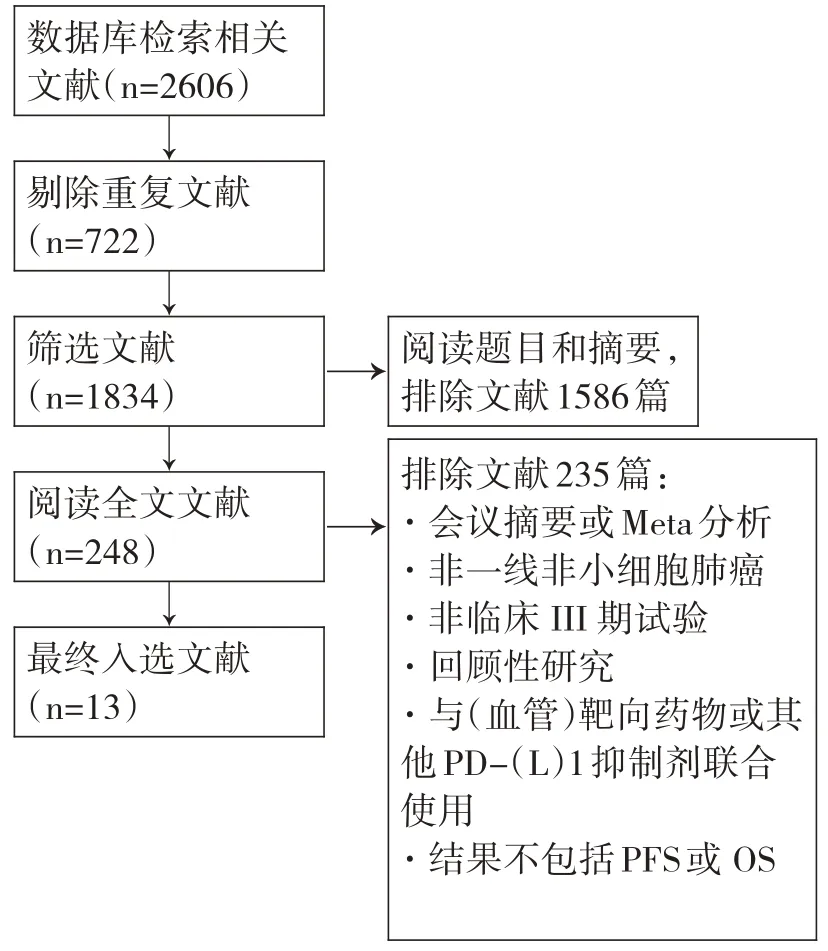
图1 文献筛选流程
2.2 纳入研究的一般特征
在纳入的13 项研究中,有八项试验是针对PD-1/PD-L1 单抗联合化疗对比化疗的疗效进行分析,5 项试验调查了PD-1/PD-L1 单抗单药与化疗治疗疗效对比。
所有试验均评估了PD-L1 的表达情况,报告了OS、PFS 结果及3~5 级不良反应数据,纳入研究的基本特征见表1。
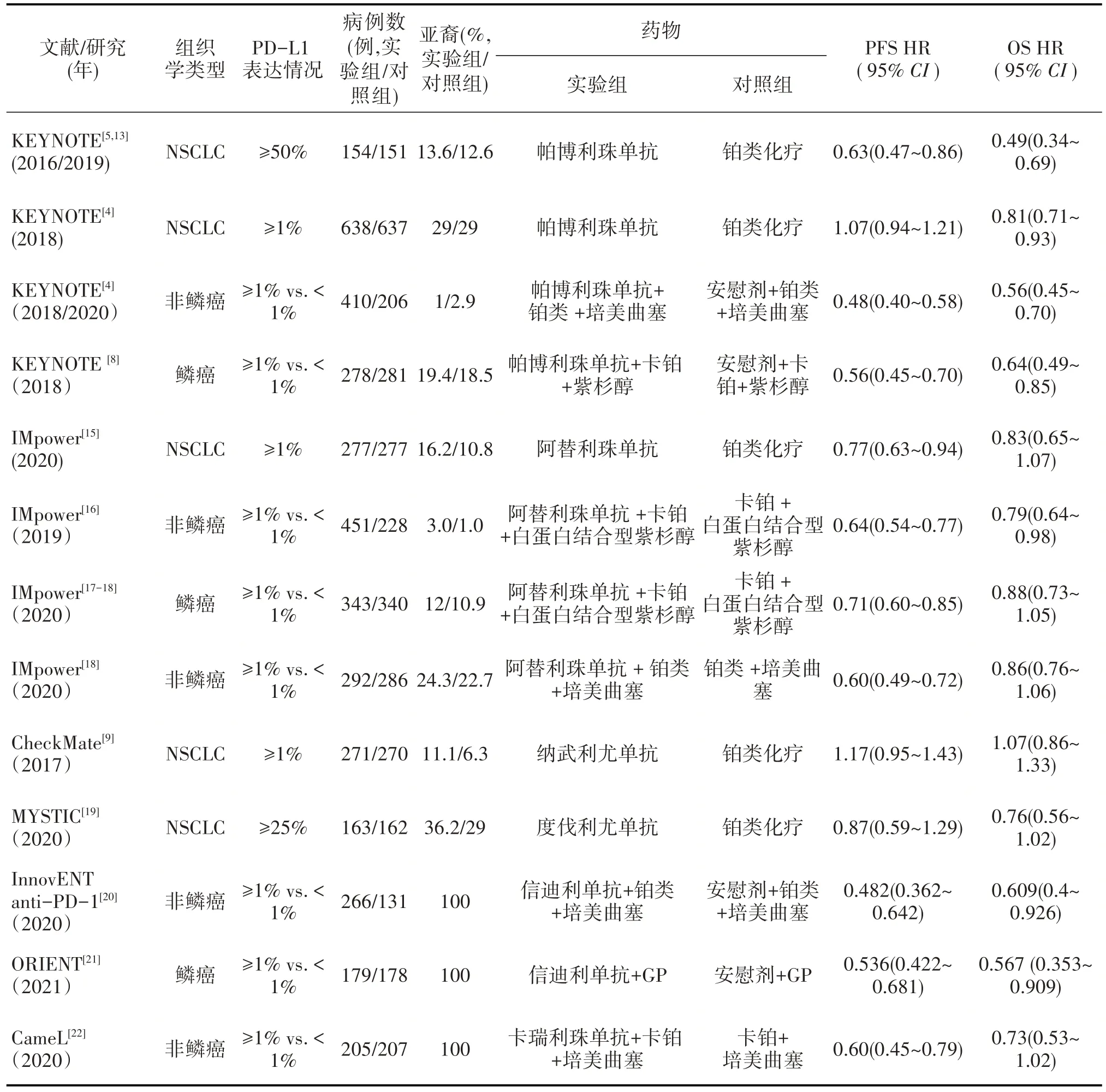
表1 纳入研究的基本特征
2.3 文献质量评价
采用Cochrane 质量评价偏倚风险表对纳入研究进行质量评价,结果显示纳入研究的质量整体良好。其中未对试验实施者和参与者以及结局评估中实施盲法是主要的高风险偏倚来源,见图2。

图2 Cochrane质量评价偏倚风险表
2.4 Meta分析结果
2.4.1 总生存期(OS)
因干预措施不同,对A 组(PD-1/PD-L1 抑制剂+化疗)与C 组(化疗)、B 组(PD-1/PD-L1 抑制剂单药)与C 组(化疗)的13 项研究直接进行亚组分析,异质性分析显示I²>50%,P<0.1,采用随机效应模型。Meta 分析结果显示,PD-1/PD-L1 抑制剂联合或不联合化疗治疗效果均优于化疗组,差异具有统计学意义(HR=0.75,95%CI0.67~0.84;P<0.01),提示在一线治疗晚期NSCLC 时,与单纯化疗相比,PD-1/PD-L1 抑制剂单药或联合化疗均可明显延长患者的总生存期。
2.4.2 无进展生存期(PFS)
纳入的13 项研究均报告了PFS 数据,异质性分析显示I²>50%,P<0.1,故采用随机效应模型。Meta 分析结果显示,PD-1/PD-L1 抑制剂联合或不联合化疗治疗效果均优于化疗组,差异具有统计学意义(HR=0.68,95%CI0.57~0.80;P<0.01),提示与单纯化疗相比,PD-1/PD-L1 抑制剂单药或联合化疗同样可明显改善患者的无进展生存期。
2.4.3 间接Meta 分析
根据前述方法,通过臂C 连接,对臂A 与臂B之间进行间接荟萃分析[11],OS 分析结果显示PD-1/PD-L1 抑制剂联合化疗(I+C)对比PD-1/PD-L1抑制剂单药(I),治疗效果无显著统计学差异(HR=0.91,95%CI0.71~1.16;P=0.4533);PFS 分析结果显示PD-1/PD-L1 抑制剂联合化疗(I+C)治疗效果优于PD-1/PD-L1 抑制剂单药(I),差异具有统计学意义(HR=0.64,95%CI0.47~0.88;P=0.0064),提示PD-1/PD-L1 抑制剂与化疗连用,一线治疗可以明显延长晚期NSCLC 患者的无进展生存期。
2.4.4 亚组分析
根据PD-L1 的表达情况对各研究进一步行亚组分析,结果显示在PD-L1 高表达(≥50%) 人群中,PD-1/PD-L1 抑制剂单药在OS 与PFS 方面均显著优于化疗(OS:HR=0.66,95%CI0.57~0.77;PFS:HR=0.76,95%CI0.60~0.95);I+C 对比化疗具有更好的PFS(HR=0.40,95%CI0.34~0.47)和OS(HR=0.63,95%CI0.50~0.79)。
在PD-L1 低表达(1%~49%) 人群中,PD-1/PD-L1 抑制剂单药对比化疗在OS 与PFS 方面没有显著差异(OS:HR=0.93,95%CI0.79~1.10;PFS:HR=1.00,95%CI0.69~1.46);I+C 对比化疗具 有更好的PFS(HR=0.63,95%CI0.55~0.71),而OS 方面的获益不明显(HR=0.81,95%CI0.60~1.09)。
在PD-L1 表达阳性(≥1%)人群中,PD-1/PD-L1抑制剂单药对比化疗在OS 与PFS 方面没有显著差 异(OS:HR=0.86,95%CI0.70~1.06;PFS:HR=0.98,95%CI0.78~1.25);I+C 对比化疗具有更好的PFS(HR=0.50,95%CI0.45~0.57)和OS(HR=0.65,95%CI0.45~0.93)。在PD-L1 表达阴性(<1%)人群中,PD-1/PD-L1 抑制剂联合化疗均可显著延长PFS(HR=0.68,95%CI0.60~0.76)和OS(HR=0.73,95%CI0.63~0.84)。
在间接分析(I+C vs I)中,无论PD-L1 表达情况如何,“I+C”对比PD-1/PD-L1 抑制剂单药均具有更好的PFS(HR=0.62,95%CI0.48~0.80),在OS 方面没有明显差异(HR=0.91,95%CI0.71~1.16)。
2.4.5 不良反应事件
在纳入的13 项研究中,8 项研究报告了“I+C vs C”的不良反应数据,各研究间存在统计学异质性(I²>50%,P<0.1),采用随机效应模型分析。Meta 分析结果显示,PD-1/PD-L1 抑制剂与化疗连用的3~5 级治疗相关不良反应事件发生率高于单独化疗,差异有统计学意义(OR=1.54,95%CI1.26~1.87;P<0.01)。
5 项研究报告了“I vs C”的不良反应数据,各研究间统计学异质性较小(I²<50%,P>0.1),采用固定效应模型分析。Meta 分析结果显示,PD-1/PD-L1抑制剂单药治疗的3~5 级不良反应事件发生率低于单独化疗,差异有统计学意义(OR=0.32,95%CI0.27~0.37;P<0.01)。
间接Meta 分析可以得出I+C 方案治疗的不良反应事件发生率要显著高于PD-1/PD-L1抑制剂单药治疗(OR=4.81,95%CI3.70~6.25)。以上分析结果提示在一线治疗晚期NSCLC 患者时,PD-1/PD-L1 抑制剂单药发生3~5级不良反应事件发生概率要显著低于单独化疗和“PD-1/PD-L1 抑制剂+化疗”的联合给药方案。
2.4.6 发表偏倚
因纳入研究数量较多,发表偏倚采用漏斗图分析,以OS 为例,HR为横坐标、LogHR为纵坐标绘制漏斗图,因研究样本总量较大,散点估计值集中在漏斗图顶部竖线附近,基本对称分布,说明纳入RCT 研究存在较小的发表偏倚,见图3。
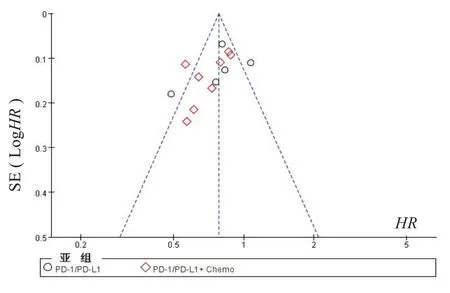
图3 OS漏斗图分析
3 讨论
近年来,随着免疫治疗的不断发展,使肺癌原本的治疗模式发生了改变,PD-1/PD-L1 抑制剂单药、PD-1/PD-L1 抑制剂联合化疗或其他免疫检查点抑制剂如CTLA-4 联合治疗等已推荐成为晚期NSCLC 患者的一线治疗,显著改善了晚期肺癌患者的生存期[6]。本研究进一步证实,不论是否联合化疗,PD-1/PD-L1 抑制剂的加入都能够明显延长患者的PFS 和OS,这与其他研究者的结论一致[23]。在间接荟萃分析中,我们发现不论PD-L1 表达如何,PD-1/PD-L1 抑制剂联合化疗较PD-1/PD-L1抑制剂单药相比能够进一步改善患者的PFS,但OS差异没有统计学意义,表明在免疫治疗中,化疗的加入有助于改善肺癌患者原有的治疗效果。在一些研究中证实,铂基化疗已被证明可以促进免疫细胞的成熟[24]。在非免疫原性肿瘤微环境中,化疗还可能将其转化为免疫原性微环境,从而提高免疫治疗的活性[25],这使得化疗与免疫治疗的联合更加合理。
我们根据PD-L1 表达情况进一步分析,发现在不同的TPS 分组中,PD-1/PD-L1 抑制剂联合化疗均取得了不错的疗效,尤其在改善PFS 方面。即使是PD-L1 低表达或阴性的患者,PD-1/PD-L1 抑制剂联合化疗也均优于单独化疗。这个结果为那些PD-L1表达阴性,但对免疫治疗有反应的晚期NSCLC 患者提供了新的治疗思路。而对于PD-L1 高表达的患者,在PD-1/PD-L1 抑制剂单药基础上加入化疗也能进一步改善患者的无进展生存期。以上研究结果强调了无论PD-L1 的表达水平怎样,免疫联合化疗在改善患者的临床治疗效果方面都具有重要意义。
在不良反应事件中,与单药相比,免疫联合化疗的3~5级治疗相关不良反应事件发生率要更高,这可能是免疫联合化疗没有明显延长患者OS 的原因之一。对于大多数不良反应,一般采用暂停给药或糖皮质激素等治疗手段,更为严重的不良反应则完全停药[26]。此外,有研究发现,免疫相关的不良事件与免疫治疗疗效成正相关[27]。我们猜测,免疫联合化疗一方面会导致更严重的不良反应事件,另一方面也可能取得更好的疗效。因此,在联合给药治疗时严格评估患者治疗的耐受性,及早预测和发现治疗相关的副作用并予以预防至关重要。
由于晚期NSCLC 疾病进展迅速,只有约不到50%的患者接受过二线治疗[28],因此,最大限度地提高一线治疗疗效,延缓耐药性的发生对治疗本身具有重要意义,而免疫联合治疗无疑是最佳的治疗选择。除去本文提到的免疫联合化疗,免疫加化疗联合靶向治疗也能取得不错的疗效。如在Impower150[29]临床试验中,免疫联合贝伐珠单抗加化疗在一线晚期非鳞癌NSCLC 中就具有更好的PFS与OS。基于本研究结果,我们建议对于肿瘤体积较大、疾病进展迅速、ECOG评分较好的患者接受免疫与化疗等的联合治疗;而肿瘤体积较小、ECOG 评分一般的PD-L1表达阳性患者接受免疫单药治疗,以获得更持久的无进展生存。
本研究分析结果是基于已发表的研究,具有一定的局限性,有些临床试验发表时随访时间不足可能造成OS 数据不成熟,导致分析结果没有统计学意义。其次,这些临床研究中没有使用统一手段检测PD-L1表达情况,可能存在检测偏倚,细针穿刺标本也不能代表肿瘤的全貌,易出现假阴性或假阳性,影响最终的分析结果。另外,本研究纳入PD-1/PD-L1 抑制剂药物种类较多,各药物特征不同可能导致疗效的差异。最后,在间接荟萃分析中对于HR等数据的估计存在局限性,降低了统计学意义,因此证据水平低于传统荟萃分析。但由于缺乏头对头比较的临床试验研究,间接荟萃分析仍然是探索PD-1/PD-L1 抑制剂单药与联合化疗之间临床疗效的直接有效的方式。
总之,不论PD-L1表达如何,在PD-1/PD-L1抑制剂单药的一线治疗中加入化疗可进一步改善晚期NSCLC患者的预后,尤其是肿瘤负荷高的患者,但需要注意不良反应的发生。

