MicroRNA-143-3p靶向RANK对牙髓干细胞凋亡及分化能力的影响
李明炜,王云霞,王 静
(1.郑州人民医院口腔科,河南 郑州 450053;2.郑州大学第一附属医院牙体牙髓科,河南 郑州 450052)
牙髓干细胞(DPSCs)是一类源于牙髓的间充质干细胞,除了具有高增殖潜能和易于冷冻保存之外,其多向分化的潜能和调节其他细胞功能的能力使它们适用于多种组织类型的再生研究[1-2]。目前,DPSCs已可被诱导分化为成牙本质细胞、成骨细胞、脂肪细胞、软骨细胞、肌细胞和神经元细胞等[3-4]。然而,目前DPSCs的详细分化机制尚不清楚,也限制了DPSCs在组织工程中的应用。微小RNA(microRNA,miRNA)是一类长度约为22 nt的单链非编码RNA,通过转录后机制对其靶点进行基因表达调控,从而在不同生物信号途径中发挥作用[5]。有报道显示,miR-143-3p可抑制人牙周膜细胞的成骨分化,也能够抑制人骨髓间充质干细胞的分化能力[6-7]。因此,本研究假设miR-143-3p可能对人牙髓干细胞(hDPSCs)的生物学功能具有一定影响,通过抑制miR-143-3p的表达观察其对hDPSCs凋亡及分化能力的影响,并探究其可能的作用机制。
1 材料和方法
1.1 细胞
收集本院口腔门诊因正畸治疗而拔除的健康、完整的前磨牙和智齿(拔牙前已征得患者知情同意),在超净工作台内分离牙髓组织,经消化、离心后,将其培养在含10%血清的DMEM培养液中,取第3~7代细胞进行后续实验研究。经鉴定,本研究分离、培养的细胞为hDPSCs。
1.2 试剂
DMEM培养液、胎牛血清(Gibco公司,美国);miR-143-3p inhibitor及其阴性对照、RANK-siRNA、双荧光素酶报告质粒pmirGLO(上海吉玛公司,中国);膜联蛋白Ⅴ(AnnexinⅤ)-异硫氰酸荧光素(FITC)/碘化丙锭(PI)细胞凋亡检测试剂盒、茜素红S染色液、青链霉素混合液(100×)(北京索莱宝科技有限公司,中国);骨保护素(OPG)、核因子κB受体活化因子(RANK)、核因子κB受体活化因子配体(RANKL)、Runt相关转录因子2(Runx2)、骨钙素(OCN)、碱性磷酸酶(ALP)、骨形态发生蛋白2(BMP2)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)兔抗人的单克隆抗体(CST公司,美国);实时定量聚合酶链反应(RT-qPCR)试剂盒(Thermo Scientific公司,美国)。
1.3 仪器
细胞培养箱(Thermo Scientific公司,美国);凝胶成像仪(Bio-rad公司,美国);倒置显微镜(OLYMPUS公司,日本);PCR仪(Applied Biosystems公司,美国);酶标仪(Thermo Scientific公司,美国);流式细胞仪(BD公司,美国);电泳仪(北京六一仪器厂,中国)。
1.4 方法
1.4.1 细胞转染与分组 取对数生长期的hDPSCs,当细胞生长汇合至80%时,参照LipofectaminTM2000试剂盒(Thermo Scientific公司,美国)说明书对hDPSCs进行分组转染,将细胞分为NC组、miR-143-3p inhibitor组、RANK-siRNA组及miR-143-3p inhibitor+RANK-siRNA组,另取正常hDPSCs作为对照组(control),使用无血清培养液进行培养。转染5 h后将各组hDPSCs更换为完全培养液,继续培养48 h后,用RT-qPCR法检测hDPSCs中miR-143-3p和RANK mRNA表达水平。
1.4.2 RT-qPCR 提取hDPSCs细胞总RNA,逆转录合成cDNA,通过荧光定量PCR仪检测各基因mRNA表达水平。以U6为miR-143-3p的内参,其他基因均以GAPDH为内参。引物序列见表1。

表1 引物序列Table 1 Primer sequences
1.4.3 流式细胞术检测hDPSCs凋亡情况 取对数期生长的hDPSCs,细胞分组同1.4.1,用磷酸盐缓冲 液(phosphate buffered saline,PBS)洗涤后,加 入binding buffer重悬,将细胞密度调整至1×106个/mL,再依次加入AnnexinⅤ-FITC和PI孵育,通过上机流式细胞仪检测细胞凋亡率。
1.4.4 茜素红染色 取对数期生长的hDPSCs,以1×105个/孔的密度接种于6孔板中,培养24 h后细胞贴壁,更换为成骨诱导培养液(DMEM完全培养液+10 ng/mL地塞米松+50 mg/mL维生素C+10 mmol/Lβ-甘油磷酸钠),每2 d更换1次成骨诱导培养液,培养21 d后弃培养上清液,用PBS清洗2次,4%多聚甲醛固定15 min,双蒸水洗涤3次,吸干水分后加入茜素红染液染色20~30 min,双蒸水洗涤5次,然后将其置于显微镜下观察拍照。在细胞培养孔中加入2 mL 10%氯化十六烷基吡啶,于室温下静置30 min后,应用酶标仪在562 nm波长处检测各孔的吸光度值。
1.4.5 Western blotting 提取细胞蛋白样品并测定其浓度,蛋白变性后,按照30μg/孔的上样量进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜,封闭,加入对应的一抗稀释液(1∶1 000)于4℃下孵育过夜,于37℃下孵育二抗(1∶1 000)2 h,洗涤后滴加适量的发光试剂于膜上,放入凝胶成像仪中显影蛋白条带。
1.4.6 双荧光素酶实验验证mi R-143-3p与RANK的靶向关系 根据在线数据库TargetScan(http://www.targetscan.org/vert_72/)的预测结果得到miR-143-3p是RANK的调控miRNA,为检测miR-143-3p与RANK的靶向关系,设计与miR-143-3p相结合的RANK 3′-UTR序列及突变序列,并插入到pmirGLO载体上(此项工作委托上海吉玛公司完成)。将hDPSCs接种到24孔板中,密度为5×104个/孔,待细胞融合至80%时,转染RANK-3′-UTR-NC/RANK-3′-UTR-WT/RANK-3′-UTR-MUT报告质粒、miR-143-3p及对照NC质粒进行共转染,检测萤火虫荧光素酶和海肾荧光素酶的活性。
1.5 统计学分析
所有数据均使用SPSS 25.0软件进行分析,计量资料以均数±标准差(±s)表示,多样本比较采用单因素方差分析,两样本比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 miR-143-3p表达变化对hDPSCs中RANK表达水平的影响
结果显示,miR-143-3p在hDPSCs中的表达水平与RANK的表达水平成反向调控关系。转染后,与control组比较,NC组miR-143-3p的表达水平无显著改变(P>0.05);与control组和NC组比较,miR-143-3p inhibitor组miR-143-3p的表达水平显著降低(P<0.05)。相反的是,与control组和NC组比较,miR-143-3p inhibitor组RANK的表达显著升高(P<0.05)。详见图1。
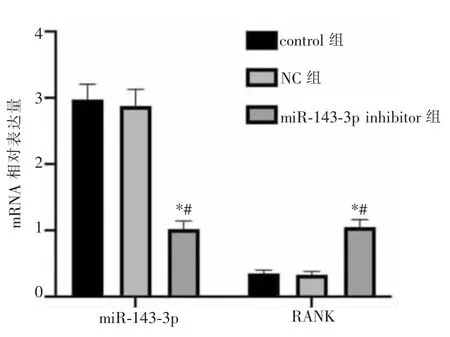
图1 miR-143-3p表达变化对RANK mRNA表达水平的影响Figure 1 The effect of miR-143-3p expression level changes on the RANK mRNA expression level
2.2 miR-143-3p对hDPSCs凋亡的影响
与control组和NC组比较,miR-143-3p inhibitor组细胞凋亡率增加,而RANK-siRNA组凋亡率降低(P<0.05)。miR-143-3p inhibitor+RANK-siRNA组细胞凋亡率高于RANK-siRNA组,而低于miR-143-3p inhibitor组(P<0.05)。详见图2~3。
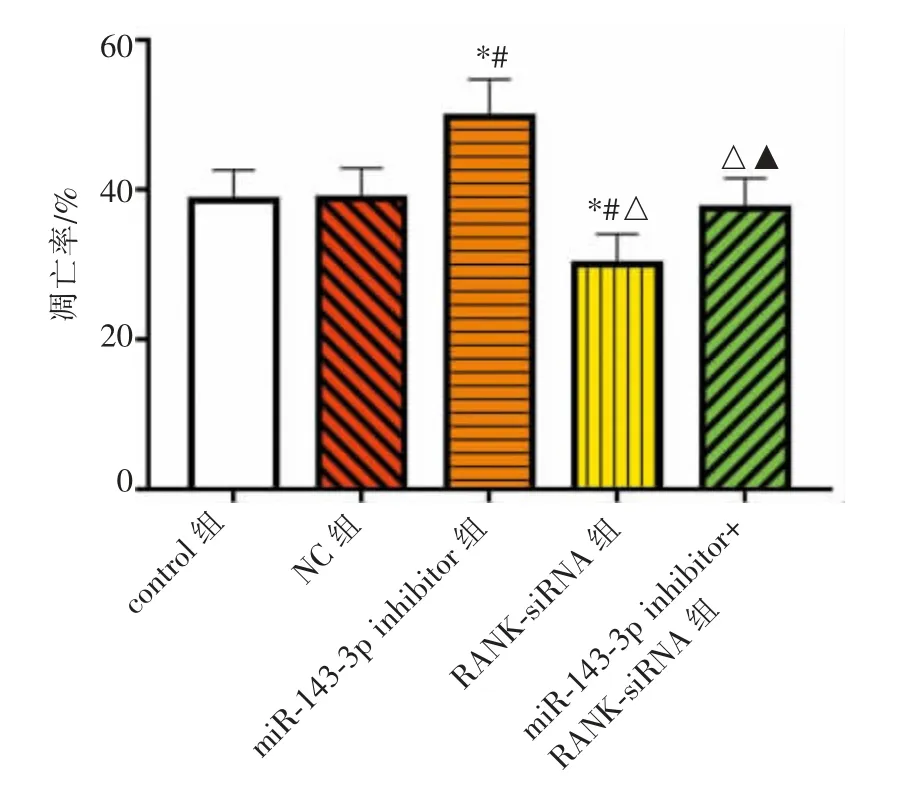
图2 各组细胞凋亡率比较Figure 2 Comparison of cell apoptosis rate in each group
2.3 miR-143-3p对hDPSCs成骨分化的影响
茜素红染色显示,与control组和NC组比较,miR-143-3p inhibitor组细胞染色显著加深,矿化结节增多,相应吸光度值增加(P<0.05),而RANKsiRNA组则出现相反的结果,即矿化结节减少,染色程度减轻,吸光度值降低(P<0.05)。miR-143-3p inhibitor+RANK-siRNA组茜素红染色程度、矿化结节和吸光度值较RANK-siRNA组增加,而较miR-143-3p inhibitor组减少(P<0.05)。详见图4~5。
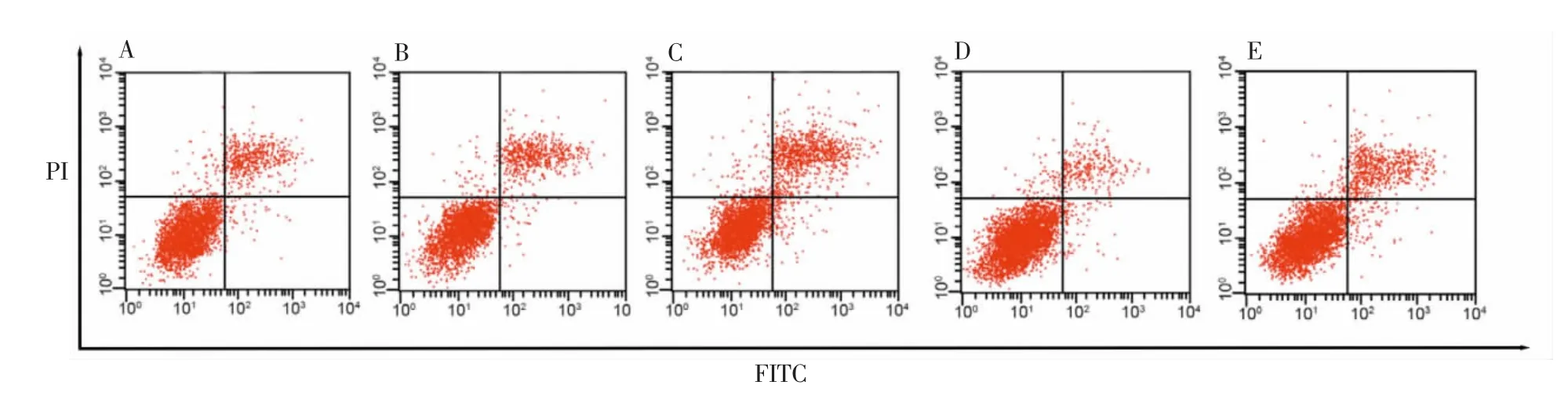
图3 细胞凋亡检测结果Figure 3 Results of cell apoptosis detection

图4 茜素红染色结果(×200)Figure 4 Alizarin red staining results(×200)

图5 茜素红染色吸光度值比较Figure 5 Comparison of absorbance values of alizarin red staining
2.4 miR-143-3p对hDPSCs中OPG、RANK、RANKL、Runx2、OCN、ALP、BMP2 mRNA表达的影响
与control组和NC组比较,miR-143-3p inhibitor组细胞的OPG mRNA表达水平降低,RANK、RANKL及细胞骨向分化相关基因的mRNA表达水平上调;RANK-siRNA组相反,其OPG mRNA表达水平增加,RANK、RANKL及细胞骨向分化相关基因的mRNA表达水平降低(P<0.05)。miR-143-3p inhibitor+RANK-siRNA组的OPG mRNA表达水平低于RANK-siRNA组而高于miR-143-3p inhibitor组,RANK、RANKL及细胞骨向分化相关基因的mRNA表达水平高于RANK-siRNA组而低于miR-143-3p inhibitor组(P<0.05)。详见图6。

图6 miR-143-3p对hDPSCs中各基因表达的影响Figure 6 The effect of miR-143-3p on the expression of genes in hDPSCs
2.5 miR-143-3p对hDPSCs中OPG、RANK、RANKL、Runx2、OCN、ALP、BMP2蛋白表达的影响
与control组和NC组比较,miR-143-3p inhibitor组细胞的OPG蛋白表达水平降低(P<0.05),RANK、RANKL及细胞骨向分化相关蛋白的表达水平上调,RANK-siRNA组则出现相反的结果(P<0.05)。MiR-143-3p inhibitor+RANK-siRNA组的OPG蛋白表达水平低于RANK-siRNA组而高于miR-143-3p inhibitor组,而其RANK、RANKL及细胞骨向分化相关蛋白的表达水平高于RANK-siRNA组而低于miR-143-3p inhibitor组(P<0.05)。详见图7。

图7 miR-143-3p对hDPSCs中各蛋白表达的影响Figure 7 The effect of miR-143-3p on the expression of proteins in hDPSCs
2.6 miR-143-3p对RANK的靶向调控作用
通过数据库TargetScan对miR-143-3p的靶基因进行预测和鉴定,RANK被预测为miR-143-3p的潜在靶基因。双荧光素酶报告结果显示,miR-143-3p显著降低了RANK-3′-UTR-WT的细胞中荧光素酶活性(P<0.05),而在RANK-3′-UTR-MUT和RANK-3′-UTR-NC的细胞中,荧光素酶活性无显著变化(P>0.05)。详见图8。
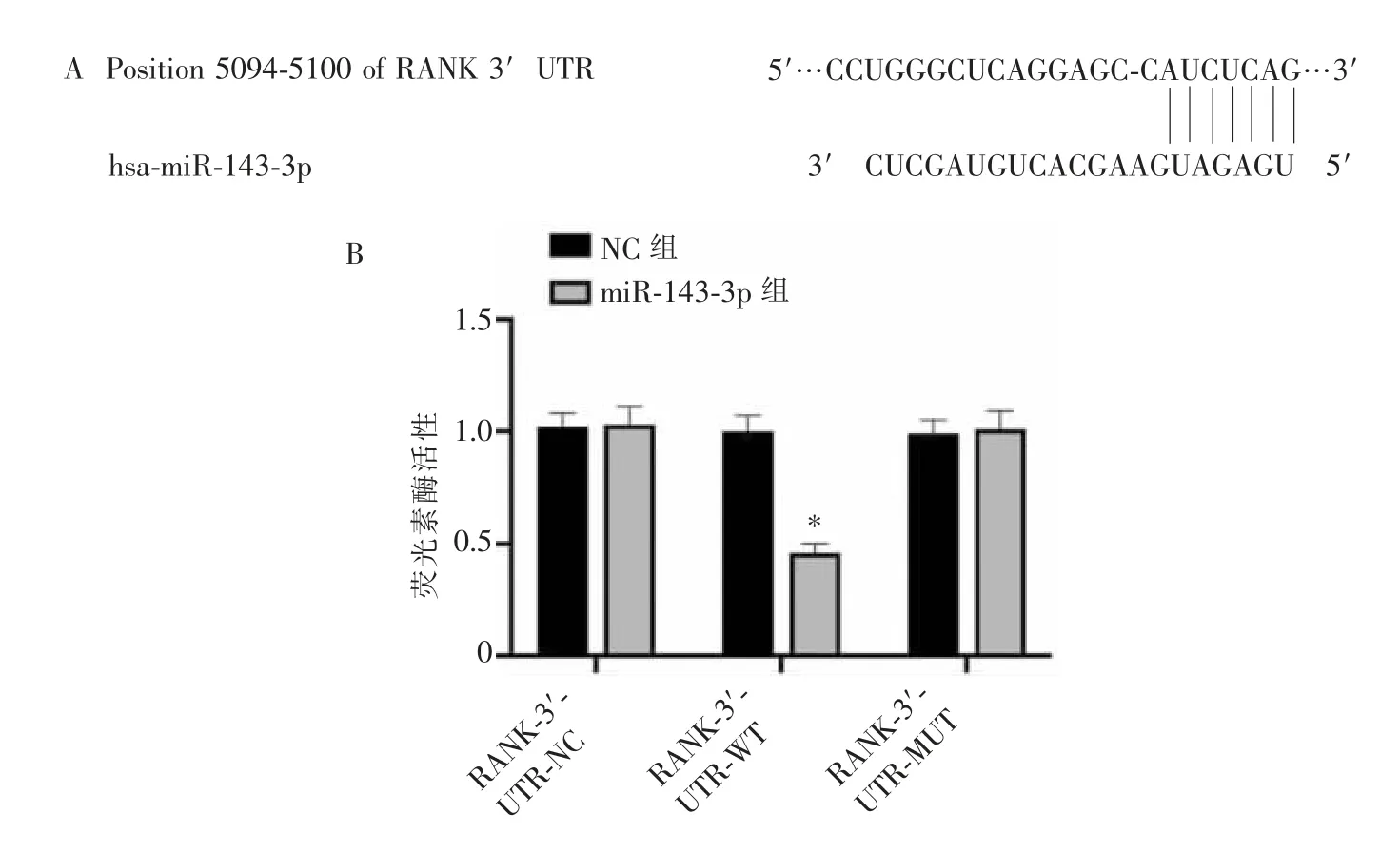
图8 miR-143-3p与RANK 3′UTR潜在结合点(A)及荧光素酶活性(B)Figure 8 Potential binding sites(A)and luciferase activity(B)of miR-143-3p and RANK 3′UTR
3 讨论
随着对非编码RNA(non-coding RNA)的深入研究,miRNAs在细胞增殖、凋亡、分化等生物活动中的重要作用逐渐被揭示。如Tao等[8]研究发现,miR-142a-3p通过靶向肿瘤坏死因子α诱导蛋白2(tumor necrosis factorα-induced protein 2,TNFAIP2)和葡萄糖转运蛋白3(glucose transporter 3,GLUT3)诱导细胞凋亡和巨噬细胞极化。Wang等[9]发现miR-543通过靶向丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和Wnt/β-catenin通路抑制TGF-β处理的子宫内膜基质细胞的迁移和上皮-间充质转化。此外,也有研究表明,下调的miR-143-5p可通过OPG/RANKL信号通路增强Runx2的表达以促进DPSCs向成牙本质细胞分化[10]。作为肿瘤坏死因子受体超家族的成员,RANK可以被RANKL激活,并在牙周炎和血管钙化导致的牙髓组织损伤中发挥重要作用[11]。在本研究中,我们假设miR-143-3p可能对hDPSCs的生物学功能具有一定影响,对hDPSCs中miR-143-3p的表达进行了下调处理,结果显示,miR-143-3p在hDPSCs中的表达与RANK的表达成反向调控关系,miR-143-3p的下调使RANK的表达显著升高,而抑制miR-143-3p的表达诱导了hDPSCs凋亡;相反的是,沉默RANK则使hDPSCs的凋亡率降低。
目前,hDPSCs已被证明在牙本质、牙髓修复和再生中发挥重要作用,是用于再生治疗的牙科干细胞之一,这与其较强的骨向分化潜能密切相关[12]。
OPG/RANKL/RANK途径与机体维持骨代谢生理平衡密不可分,是正常骨重建过程所必须的信号调节机制,影响着破骨细胞的活性及存活情况[13]。破骨细胞的形成、分化和激活需要RANK和RANKL之间的相互作用,另一方面,OPG特异性结合RANKL并抑制RANK与RANKL相互作用,破骨细胞生成被OPG中断,随后破骨细胞的活性及骨吸收均减少[14]。研究表明,OPG/RANKL/RANK途径亦与牙周炎、牙源性肿瘤等颌面部骨缺损疾病的发生、发展有关[15]。Runx2是调控成骨分化的主要转录因子之一,与BMP2一样均是较强的成骨激动剂,ALP为早期成骨细胞分化的代表性标志物,其活性反映了细胞成骨分化趋势,OCN是骨基质中特异性非胶原蛋白,其表达反映成骨细胞活性和骨转换情况,上述指标均在成骨细胞的形成、分化、活性和功能中具有重要作用[16-18]。本研究中,相比control组和NC组,抑制miR-143-3p可见hDPSCs细胞有更多的矿化结节和染色加深,同时,OPG mRNA和蛋白表达降低,RANK、RANKL、Runx2、OCN、ALP、BMP2 mRNA和蛋白表达增加,提示下调的miR-143-3p可通过激活OPG-RANKL-RANK轴诱导细胞凋亡并促进hDPSCs的骨向分化。当RANK被沉默后,hDPSCs矿化结节减少,染色变浅,OPG mRNA和蛋白表达增 加,RANK、RANKL、Runx2、OCN、ALP、BMP2的mRNA和蛋白表达水平降低,提示RANK-siRNA可逆转抑制miR-143-3p诱导的hDPSCs的成骨分化。为了验证miR-143-3p对RANK的靶向调控作用,本研究通过TargetScan对miR-143-3p的靶基因进行预测和鉴定,结果显示,RANK可能为miR-143-3p的靶基因,这一结果得到了双荧光素酶报告的验证,miR-143-3p显著降低了RANK-3′-UTR-WT的细胞中的荧光素酶活性,而在RANK-3′-UTR-MUT和RANK-3′-UTR-NC的细胞中,荧光素酶活性无显著变化,提示miR-143-3p可能通过靶向RANK发挥其对hDPSCs的凋亡和成骨分化的调节作用。
综上所述,miR-143-3p的下调可通过上调其靶基因RANK的表达激活OPG/RANKL轴,从而调节hDPSCs的凋亡和分化。本研究仅在细胞水平进行了初步研究,hDPSCs通过成骨诱导培养液诱导分化,与hDPSCs在体内环境的生物学活动仍有一定差距,需要结合体内试验进一步探索。

