HIF-1α介导破骨细胞对小鼠髁突软骨发育的影响
别苗苗,唐 燚,康非吾
(上海牙组织修复与再生工程技术研究中心,同济大学口腔医学院,同济大学附属口腔医院口腔颌面外科,上海 200072)
低氧诱导因子-1α(HIF-1α)是发育、生理及病理过程中重要的调节因子[1],作为有转录活性的核蛋白,其具有广泛的靶基因谱,可通过不同的信号通路作用于已知的100多个靶基因[2],进而调节细胞代谢、细胞周期、细胞凋亡及胞内氧化还原稳态等众多过程。HIF-1α参与所有有核细胞响应氧分压水平的重要途径,因此被称为生理及病理过程中的“高度参与因子”[3],在发育和稳态所需的各种缺氧相关过程中发挥作用。
已有研究表明,低氧信号通路对骨骼发育和内环境稳定有重要影响,低氧诱导因子在骨发育和骨重建中发挥重要作用[4-5]。HIF-1α信号通路对骨形成和骨吸收均有重要作用,该信号通路上调可影响成血管成骨功能,促进骨形成和血管形成[6];另一方面,其又可增加破骨细胞的数量及破骨活性[7-8]。同时,低氧条件下骨细胞内HIF-1α信号通路通过经典Wnt/β-catenin通路可间接通过调控成骨、成血管功能来调节骨改建过程,表明HIF-1α在骨相关细胞间的相互作用调节中有着重要作用[9]。
低氧环境亦是软骨细胞成熟和纵向骨生长的必要条件,HIF-1α已被认为是软骨细胞存活和发挥功能的关键因子[10-11]。破骨细胞是骨改建过程中发挥骨吸收功能的唯一细胞。对于HIF-1α是否参与调控关节软骨下骨区内破骨细胞的生物学行为,影响关节软骨的发育,目前知之甚少。课题组前期研究[12]发现,HIF-1α介导破骨细胞在小鼠髁突发育过程中发挥作用。然而,不同的长骨内关节软骨和软骨下骨的成骨方式及血供等均有较大差异,HIF-1α是否同样影响不同长骨来源的破骨细胞的生物学行为,包括调控关节软骨和软骨下骨的发育,未见相关报道。因此,本文拟对此进行对比研究,为关节软骨和软骨下骨发育的理论基础和相关疾病的预防和治疗提供理论参考。
1 材料和方法
1.1 实验动物
本实验的实验用鼠HIF-1αfl/fl和Ctsk-cre C57小鼠分别购买于美国Jackson实验动物中心及上海南方模式生物科技股份有限公司。对2种小鼠交配后的子代进行基因型鉴定后,获得破骨细胞内特异性敲除HIF-1α的HIF-1αfl/fl;Ctsk+C57小鼠(cKO组),将其用于后续实验。小鼠均饲养于同济大学口腔医学院SPF级动物房内,给予12 h光照和12 h无光饲养环境,室内温度保持在25℃,相对湿度为55%,给予自由饮水和饮食。所有动物实验经同济大学伦理委员会批准(批件号:2018009)。
1.2 microCT及三维重建
取同窝对照组及cKO组每组各3只小鼠股骨用于micro-CT扫描。扫描所用设备为micro-CT机(Scanco Medical AG公司,瑞士)。将股骨长轴平行于扫描管长轴放入直径48 mm的样品管中进行扫描,扫描参数为电压70 kV、电流200μA、分辨率24.2μm。扫描完成后,采用设备配套软件进行三维重建。
1.3 组织学免疫荧光染色
将小鼠麻醉后灌流,股骨组织收样,用4%多聚甲醛固定48 h后,用10%乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)脱钙2个月,组织脱水后石蜡包埋,切成4μm切片。将石蜡切片放置在60℃恒温箱中烘烤120 min,用二甲苯脱蜡,梯度乙醇水化,透明质酸酶37℃抗原修复1 h,用磷酸盐缓冲液(phosphate buffered saline,PBS)洗3遍,山羊血清封闭1 h后,滴加一抗,4℃下过夜,PBS洗3遍,滴加荧光二抗IgG室温孵育45 min,室温下用4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)孵育5 min,PBS充分冲洗,用抗荧光淬灭水溶性封片剂封片,于荧光显微镜(尼康公司,日本)下拍照。
2 结果
2.1 破骨细胞内HIF-1α敲除对小鼠股骨和下颌骨形态发育的影响
对10周龄的同窝鼠和cKO鼠的股骨和下颌骨进行micro-CT扫描,结果表明cKO组的股骨、股骨头和骺端等相较于同窝对照鼠,无形态和大小差异(图1A、B);cKO组的下颌骨髁突为中心凹陷的浅盘形较同窝对照组的半球形髁突,有形态和大小的差异(图1C、D)。
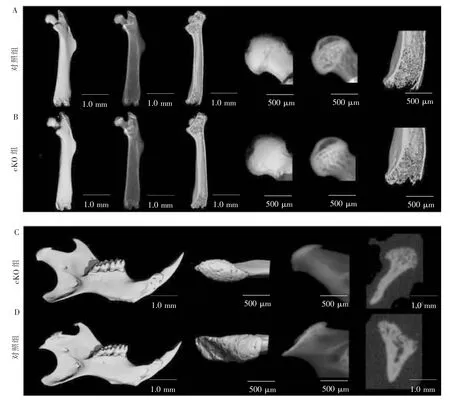
图1 同窝对照组、cKO组小鼠的股骨和下领骨形态对比Figure 1 Morphological comparison of femur and mandible between the control and cKO group
2.2 破骨细胞内HIF-1α敲除对关节软骨层和软骨下骨层形态结构的影响
通过对2个时间点的股骨头、股骨骺端、髁突软骨和软骨下骨进行阿利新蓝(alcian blue,AB)及甲苯胺蓝(toluidine blue,TB)组织学染色,发现cKO组小鼠股骨头的肥大软骨层变薄,细胞排列欠规则,软骨下骨骨小梁数目减少、厚度增加,骨小梁交联度降低(图2A);而股骨骺端无明显差异(图2B);髁突形态发生明显变化,髁突关节面失去原有凸形结构,呈水平凹形,前后径及近远中径增大,髁突宽度、长度明显缩短,软骨层结构紊乱明显,纤维软骨层明显变厚,软骨下骨层骨小梁数目减少(图2C)。

图2 同窝对照组、cKO组小鼠关节软骨和软骨下骨层形态结构对比Figure 2 Comparison of morphological structure of articular cartilage and subchondral bone layer between the control and cKO group
2.3 HIF-1α促进小鼠发育过程中股骨及下颌骨软骨下骨区破骨细胞形成和破骨活性
在5周龄和8周龄2个时间点,对同窝鼠和cKO组小鼠的股骨和下颌骨进行抗酒石酸酸性磷酸酶染色,发现5周龄cKO组股骨头和骺端软骨下骨区破骨细胞数量和大小稍小于同窝对照组,且出生后8周时,破骨细胞数量和大小的减少,更为明显(图3A、B);cKO组髁突软骨下骨区破骨细胞数量和大小,在不同时间点均低于同窝对照组(图3C)。
通过组织蛋白酶K(cathepsin K,CTSK)定位软骨下骨区的多核破骨细胞,并对HIF-1α表达进行共定位检测,相较cKO组,在对照组股骨头软骨下骨区可见更多HIF-1α标记的破骨细胞(图3D);同时相较cKO组,对照组内亦可见更多基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)阳性的破骨细胞(图3E)。
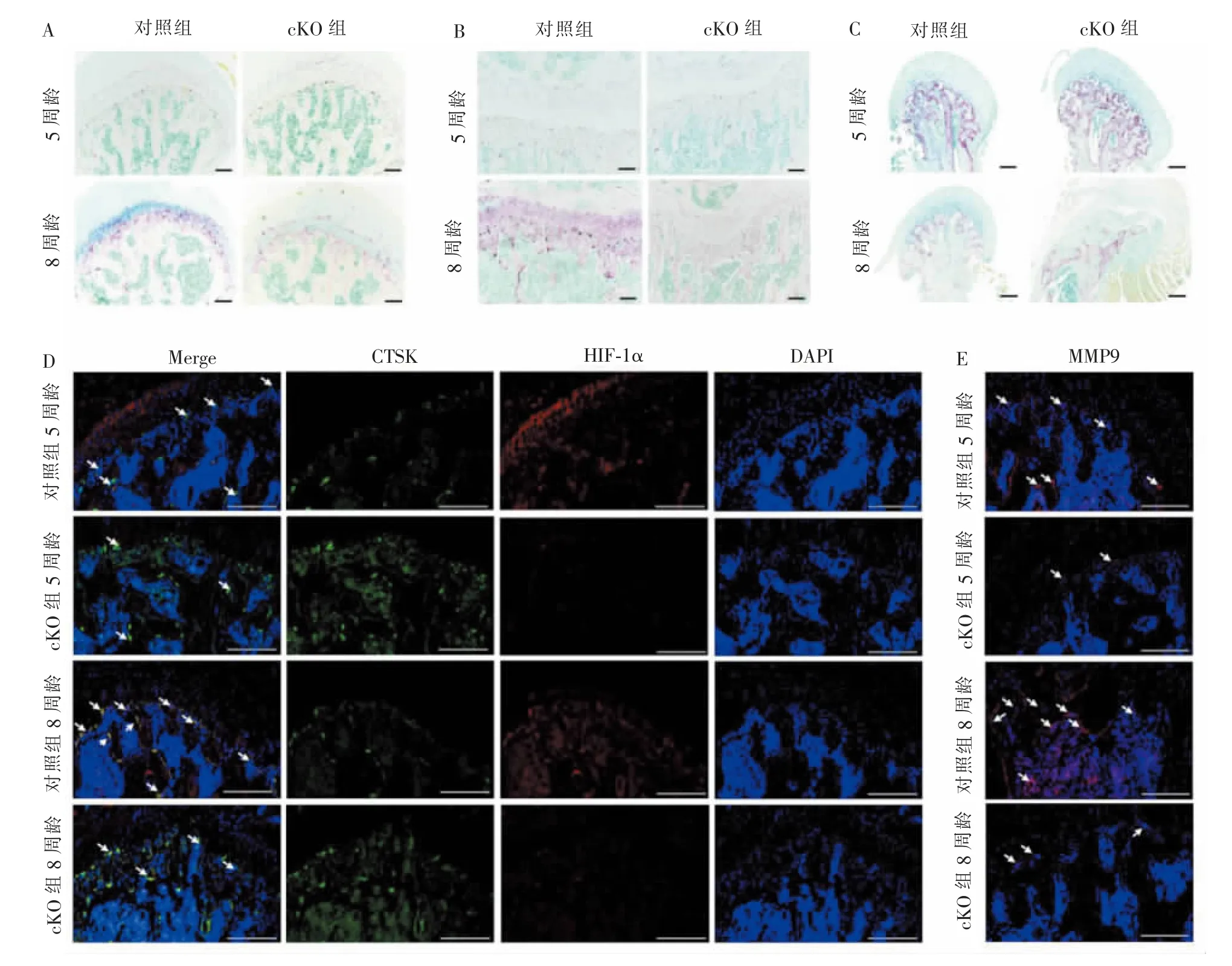
图3 同窝对照组、cKO组小鼠股骨和下领骨软骨下骨区破骨细胞数量和破骨活性对比Figure 3 Comparison of number and activity of osteoclasts in subchondral layers of femur and mandible between the control and cKO group
3 讨论
关节软骨是一种无血管、无神经、无淋巴的结缔组织,通过滑膜液和软骨下骨的扩散获得营养和氧供。因此,关节软骨在整个生命周期中都维持在低氧环境中,从关节软骨表面到深层存在约1%~6%的氧浓度梯度[13];同时,处于血运末端的软骨下骨区内的骨相关细胞亦处于相对低氧的环境中。已有研究[13]表明,低氧对于软骨细胞存活及功能和关节软骨发育具有重要意义。同时,低氧在软骨相关疾病中亦有较多报道,股骨头坏死是血液供应破坏所导致的股骨头低氧性损伤,有研究[14]表明HIF-1α可能参与了低氧引起的股骨头坏死的发病机制。然而软骨下骨区的低氧环境对于关节软骨及软骨下骨的影响尚待阐明。破骨细胞作为骨改建活动中唯一的骨吸收功能细胞,在髁突和股骨头等关节发育过程中,负责软骨基质的清除和调控成骨相关细胞成骨。以往研究[15-16]及课题组前期研究[17]均表明,HIF-1α应答低氧刺激可调控破骨细胞分化和活性,同时HIF-1α介导破骨细胞在髁突软骨发育过程中发挥重要作用。然而,髁突软骨和长骨关节软骨的来源、发育方式和血供等均有不同[18-21]。因此,本文就HIF-1α是否在长骨的股骨头及骺端发育中同样发挥重要作用进行了探究,结果表明,在破骨细胞内特异性敲除HIF-1α后,小鼠股骨头软骨下骨区骨小梁数量减少、厚度增加、交联度降低;肥大软骨层变薄,细胞排列欠规则;但骺端软骨和软骨下骨层没有产生明显影响。上述结果提示,在长骨股骨头发育过程中,低氧亦可通过调控破骨细胞生物学行为来参与软骨和软骨下骨的改建,但在改建过程中低氧对软骨下骨区破骨细胞的调控作用效果远不如髁突软骨下骨区明显,其原因需要进一步的实验探究。
本实验组织学层面所观察的时间点仅有5周和8周2个时间点,股骨头和髁突形态结构在8周龄时的差异较5周龄更为明显,但对HIF-1α介导破骨细胞调控软骨和软骨下骨发育的探究,需要增加更多时间点的观察。在2个组别的长骨软骨层厚度和软骨下区骨小梁改建中,长骨股骨头较骺端差异明显,可能与骺端关节软骨下骨区血运更为丰富有关。
本研究通过组织学染色证实,HIF-1α可响应低氧环境调控破骨细胞的形成、大小及数量。染色结果表明,破骨细胞内特异性敲除HIF-1α的模式鼠软骨下骨区破骨细胞数量和破骨活性降低,且出生后8周的差异较出生后5周时更为明显;肥大软骨层厚度差异也更为明显,软骨下骨区骨小梁内可见更多未改建的残留软骨。同时,MMP9的组织学免疫荧光染色表明,HIF-1α可能通过调控破骨细胞分泌MMP9等功能性产物,影响破骨活性。
综上所述,在长骨和颌骨的关节软骨和软骨下骨发育过程中,HIF-1α可能介导破骨细胞的形成和破骨活性影响骨改建,或通过调节细胞间作用影响骨改建,其具体细胞和分子机制及对股骨和下颌骨发育调控效果存在差异的原因有待进一步探究。

