人源抗菌肽LL-37 对柯萨奇B3 病毒诱导的病毒性心肌炎小鼠病毒复制及炎症反应的影响△
刘 敬,李 薇,孙国文
(1.郴州市第一人民医院儿童心胸血管中心,湖南郴州 423000;2.郴州市第一人民医院儿童重症监护室,湖南郴州 423000)
病毒性心肌炎(viral myocarditis,VMC)是由嗜心性病毒直接或间接损伤引起的心肌局限性或弥漫性炎症病变。目前已知多种病毒能导致VMC,其中以柯萨奇病毒(Coxsackie virus,CV)B、CVA 和腺病毒最常见[1]。根据病毒对乳鼠的致病特点和病毒抗原性差异,其中CVB3 致病力最强,因而常用CVB3诱导制备VMC 动物模型[2]。Toll 样受体(tolllike receptor,TLR)是固有免疫模式的识别受体,可识别病原微生物并做出一系列反应。TLR-4 作为I型跨膜受体,识别多种病毒抗原,经髓细胞样分化因子(myeloid differentiation factor 88,MyD88)诱导下游核转录因子κB(nuclear factor-κB,NF-κB)激活,调控多种炎症细胞因子[如白细胞介素(interleu⁃kin,IL)-1β、IL-6 和肿瘤坏死因子(tumor necrosis factor,TNF)-α]的表达水平[3]。LL-37是人类抗菌肽中唯一已知的组织蛋白酶家族成员,其除了具有广谱的抗菌活性外,还可以通过TLR-4/NF-κB活性通路调节多种炎症反应[4]。近年还发现,LL-37 通过与细胞膜和病毒外壳之间的相互作用产生抗病毒作用,且作用于多种病毒[5]。但LL-37 对CVB3诱导的VMC 小鼠是否具有抗病毒和抗炎症作用还未知。本研究通过构建CVB3 诱导的VMC 模型小鼠,经人源抗菌肽LL-37处理后,探讨LL-37对病毒性心肌炎小鼠心肌组织病毒复制和炎症反应的影响,并且阐述其可能的分子机制。
1 材料与方法
1.1 实验动物及病毒株
无特定病原体(SPF)级雄性5~6 周龄BALB/c小鼠48只,体质量18~20 g,购自湖南太平生物科技有限公司,动物许可证编号:SCXK(湘)2015-0004。小鼠均在湿度40%~60%、温度(21±2)℃的饲养环境中饲养,适应性饲养1 周后进行实验处理。
将CVB3 在HeLa 细胞中活化扩增后,采用Reed-Muench 法对病毒进行滴度测定,以50%的病变细胞为判断标准,计算半数组织培养感染量(TCID50)为10-7/0.1 mL。
1.2 主要试剂
人源抗菌肽LL-37 购自南京莱昂生物科技有限公司;苏木素和伊红染液购于美国Sigma 公司;心肌肌钙蛋白I(cardiac troponin,cTnI)、肌酸激酶同工酶(creatine kinase isoenzyme MB,CK-MB)和肌红蛋白(myoglobin,Mb)试剂盒购自南京建成生物工程研究所;心肌组织IL-1β、IL-6 和TNF-α 浓度检测的酶联免疫吸附试验(enzyme-linked immu⁃nosor bent assay,ELISA)试剂盒购于深圳晶美生物技术有限公司;Reverse Transcription System 试剂盒购于美国PROMEGA公司;SYBR荧光定量试剂盒购于大连宝生物公司;兔抗鼠TLR4、p-NF-κB p65、MyD88 和GAPDH 抗体均购于英国ABCAM 公司。
1.3 动物模型建立及分组
将48只BALB/c小鼠随机分为正常对照(Blank)组、模型(VMC)组、LL-37 低剂量(LL-37-L)组和LL-37高剂量(LL-37-H)组,每组12只小鼠。VMC组和LL-37 高、低剂量组小鼠通过腹腔注射0.1 mL 100 TCID50 的CVB3溶液建立VMC小鼠模型,而Blank 组小鼠注射等量不含病毒的培养液。以CVB3 注射当天记为第0 天,根据前期预实验结果确定LL-37 浓度,从第1 天开始LL-37-L 组和LL-37-H 组小鼠每天分别腹腔注射0.75 mg/kg 和3 mg/kg 浓度的人源抗菌肽LL-37,而Blank 组和VMC 组小鼠在同一时刻采用同样的方法注射等量0.9%氯化钠溶液,连续干预7 d 后,各组小鼠眼球取血后处死并取心肌组织。小鼠注射病毒第3天开始出现精神萎靡,活动量减少,体温下降,体质量持续降低等情况。
1.4 心肌组织苏木精-伊红染色
沿右心室游离壁正中间切开,取1/2 心脏组织,迅速置于4 %多聚甲醛溶液中固定,经常规包埋、固定后,切成5~7 μm 厚度的石蜡切片。将石蜡切片经二甲苯、梯度浓度乙醇处理后,加入苏木素染色10 min,用蒸馏水冲洗,吸干水分后,再加入伊红染液染色2 min。经乙醇、二甲苯处理后,滴加中性树脂封片。将制备好的切片置于显微镜下观察心肌组织炎症病理变化,根据心肌组织病理积分[6]统计心肌组织炎症病理情况。每个样本随机取3 张切片,每张切片上随机取5 个视野,计算视野内炎症细胞浸润、细胞坏死所占面积,无病变计0 分,病变面积占比<25%计1 分,25%~50%计2 分,51%~75%计3 分,>75%计4 分,最后积分取平均值。
1.5 全自动生化仪检测血清心肌损伤标志物
每组小鼠眼球取血,室温静置2 h 后,血清自然析出。3 000 r/min 离心10 min 后,取上清液保存至-80 ℃冰箱中待测。采用全自动生化仪检测血清心肌损伤标志物cTnI、CK-MB 和Mb 浓度。
1.6 50%终点法测定心肌组织CVB3 病毒滴度
取部分心脏组织,剪碎并研磨,在4 ℃下3 000 r/min 离心10 min 后,取上清液,将上清液以10 倍梯度稀释法(10-1~10-6)稀释。将HeLa 细胞以1.0×104/mL 加入96 孔培养板中,置于37 ℃培养箱中培养至约80%。然后每个浓度上清液取0.2 mL 加入HeLa 细胞培养板中,37 ℃培养,每个浓度设3 个复孔。逐日观察HeLa 细胞病变情况,连续观察5 d,细胞病变达50%以上计为阳性。根据Reed-Muench 法计算心肌组织中CVB3 的TCID50。
1.7 心肌组织中炎症因子IL-1β、IL-6 和TNF-α浓度检测
取部分心脏组织,用组织捣碎机12 000 r/min上下研磨制备组织匀浆液。利用小鼠IL-1β、IL-6和TNF-α ELISA 检测试剂盒检测组织匀浆液中炎症因子IL-1β、IL-6 和TNF-α 的浓度。
1.8 心肌组织CVB3 mRNA 表达水平检测
取部分心脏组织,无菌剪刀剪碎后,液氮研磨呈粉末状,采用TRIzol 试剂提取组织总RNA,分光光度计法测定RNA 纯度。根据逆转录试剂盒操作说明,配制逆转录体系,震荡混匀后置入聚合酶链反应(polymerase chain reaction,PCR)仪中,42 ℃,1 h;95 ℃,5 min,将RNA 逆转录为cDNA。根据荧光定量试剂盒说明书,以GAPDH 为模板,进行PCR 扩增反应。引物序列:CVB3 上游引物:5′-CGGTACCTTTGTGCGCCTGT-3′;下游引物:5′-CAGGCCGCCAACGCAGCC-3′;GAPDH 上游引物:5′-ACTAGGCGCTCACTGTTCTC-3′;下游引物:5′-ATCC GTTGACTCCGACCTTC-3′。PCR 反应条件:95 ℃5 min,95 ℃30 s,60 ℃30 s,循环35 次。利用2-ΔΔCt法计算各组小鼠心肌组织中CVB3 mRNA的相对表达量。
1.9 Western blot 法检测心肌组织TLR-4、MyD88和p-NF-κB p65 蛋白表达
取部分心脏组织,无菌剪刀剪碎后立刻加入预冷的蛋白裂解液,冰浴反应30 min 后,4 ℃12 000g离心5 min,收集上清液,采用BCA 试剂盒检测提取出的蛋白浓度。将蛋白样品调至等浓度后,98 ℃水浴3 min变性。将蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳分离蛋白后,湿转至聚偏二氟乙烯(polyviny lidene fluoride,PVDF)膜。用5 %脱脂牛奶室温封闭2 h 后,TBST 清洗PVDF 膜,分别加入一抗GAP⁃DH(稀释1∶10 000)、TLR-4(稀释1∶1 000)、MyD88(稀释1∶500)和p-NF-κB p65(稀释1∶1 000)置于4 ℃孵育过夜。TBST 漂洗PVDF 膜3 次后,加入辣根过氧化物酶标记的二抗,在摇床上室温轻摇1 h。TBST 清洗3 次后,用ECL 发光显影后,在凝胶成像仪中拍照扫描进行分析。用Image J 软件对条带进行灰度值检测,目的蛋白的相对表达量为目的蛋白的灰度值与内参GAPDH 灰度值的比值。
1.10 统计学分析
采用SPSS 19.0 统计软件进行数据分析。小鼠心肌病理积分、血清cTnI、CK-MB 和Mb 浓度、CVB3 病毒滴度和CVB3 mRNA 相对表达量、组织IL-1β、IL-6和TNF-α浓度以及组织TLR-4、MyD88和p-NF-κB p65/NF-κB p65 蛋白表达水平等符合正态分布计量资料采用()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t法。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠心肌组织病理变化
Blank 组小鼠心肌组织结构完整,细胞排列整齐有序,无明显炎症病理情况;VMC 组小鼠心肌组织结构紊乱,细胞间质出现大量炎症细胞浸润和大片细胞坏死区;LL-37-L 组小鼠心肌组织有少量炎症细胞浸润情况,细胞坏死区较小且分散;LL-37-H 组小鼠心肌组织细胞排列有序,炎症细胞浸润较模型组明显减少,无明显细胞坏死区(图1)。各组小鼠心肌病理积分比较,差异有统计学意义(F=396.25,P<0.001);与Blank 组比较,VMC组小鼠心肌病理积分明显升高,差异有统计学意义[(3.18±0.33)分vs.(0.00±0.00)分,P<0.05];VMC 组与LL-37-L 组小鼠心肌病理积分[(2.94±0.28)分]比较,差异无统计学意义(P>0.05);而LL-37-H 组小鼠心肌病理积分明显低于VMC 组,差异有统计学意义[(1.56±0.27)分vs.(3.18±0.33)分,P<0.05]。

图1 各组小鼠心肌组织光学显微镜下图像(苏木精-伊红染色,×400)
2.2 各组小鼠血清心肌损伤标志物浓度变化
与Blank 组比较,VMC 组小鼠血清cTnI、CKMB 和Mb 浓度均明显升高(P<0.05);与VMC 组比较,LL-37-H组小鼠血清cTnI、CK-MB和Mb浓度均明显降低(P<0.05),而LL-37-L组小鼠的血清cTnI、CK-MB 和Mb 浓度差异无统计学意义(P>0.05),见表1。
表1 各组小鼠血清心肌损伤标志物浓度比较[n=12,]
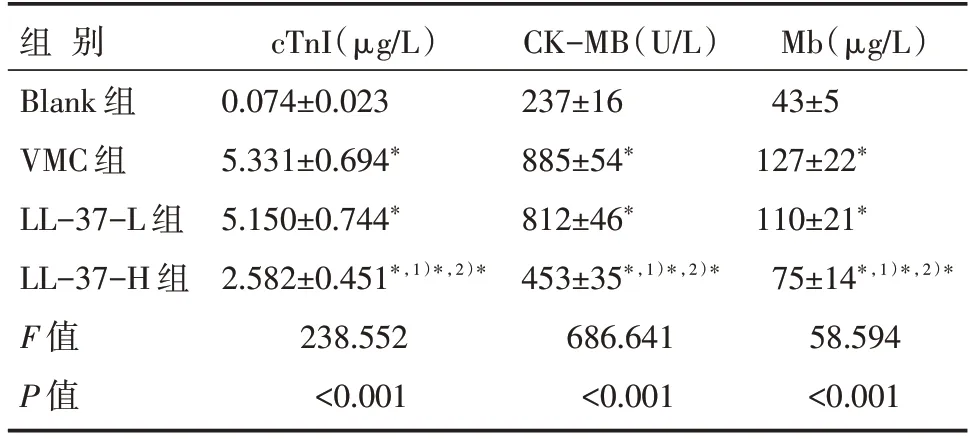
表1 各组小鼠血清心肌损伤标志物浓度比较[n=12,]
注:与Blank 组比较,*P<0.05;与VMC 组比较,1)*P<0.05;与LL-37-L 组比较,2)*P<0.05
2.3 各组小鼠心肌组织CVB3 病毒滴度及CVB3 mRNA 表达水平比较
与Blank 组比较,VMC 组小鼠心肌CVB3 病毒滴度和CVB3 mRNA 相对表达量均明显升高(P<0.05);与VMC 组比较,LL-37-H 组小鼠心肌CVB3病毒滴度和CVB3 mRNA 相对表达量均明显降低(P<0.05);而LL-37-L 组小鼠心肌CVB3 病毒滴度和CVB3 mRNA 相对表达量差异无统计学意义(P>0.05),见表2。
表2 各组小鼠心肌组织CVB3 病毒滴度以及CVB3 RNA表达水平比较 [,n=12]
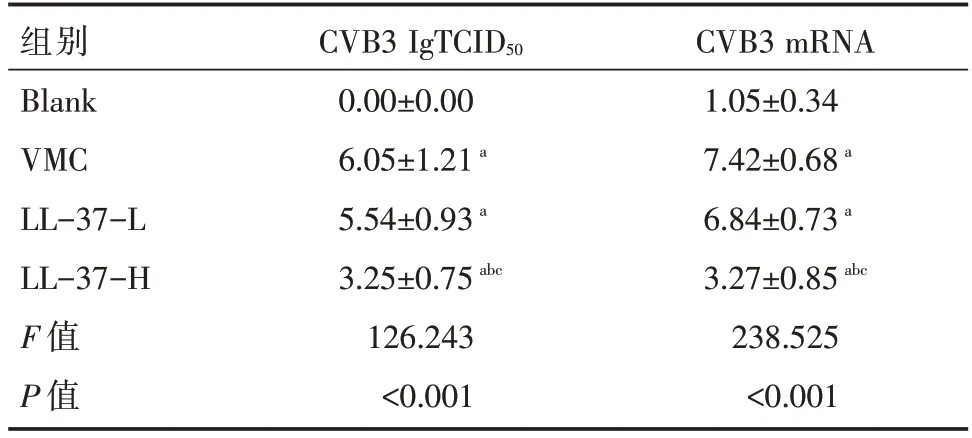
表2 各组小鼠心肌组织CVB3 病毒滴度以及CVB3 RNA表达水平比较 [,n=12]
注:与Blank 组比较,*P<0.05;与VMC 组比较,1)*P<0.05;与LL-37-L 组比较,2)*P<0.05。
2.4 各组小鼠心肌组织炎症因子浓度比较
与Blank 组比较,VMC 组小鼠心肌组织炎症因子IL-1β、IL-6 和TNF-α 浓度均明显升高(P<0.05);与VMC 组比较,LL-37-H 组小鼠心肌组织IL-1β、IL-6 和TNF-α 浓度均显著降低(P<0.05),而LL-37-L 组小鼠心肌组织IL-1β、IL-6 和TNF-α浓度差异无统计学意义(P>0.05),见表3。
表3 各组小鼠心肌组织炎症因子IL-1β、IL-6 和TNF-α浓度比较 [n=12,pg/mL,]
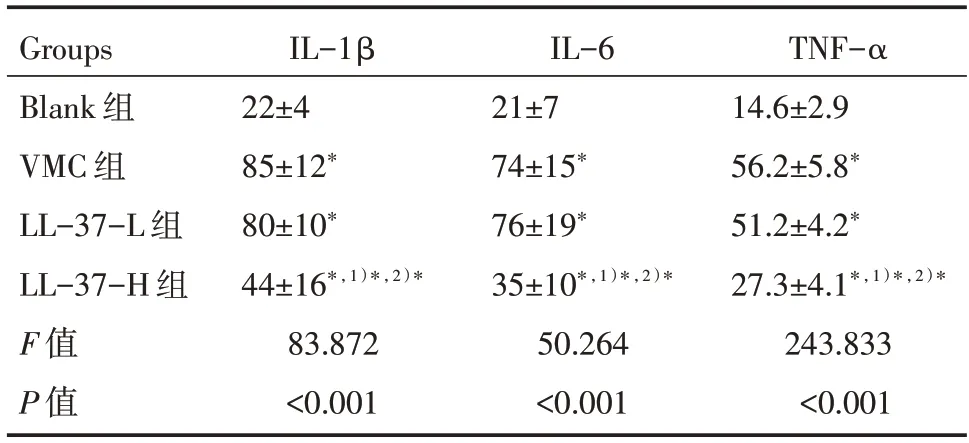
表3 各组小鼠心肌组织炎症因子IL-1β、IL-6 和TNF-α浓度比较 [n=12,pg/mL,]
注:与Blank 组比较,*P<0.05;与VMC 组比较,1)*P<0.05;与LL-37-L 组比较,2)*P<0.05
2.5 各组小鼠心肌组织中TLR-4、MyD88和p-NFκB p65/NF-κB p65 蛋白表达水平变化
与Blank 组比较,VMC 组小鼠心肌组织炎症因子TLR-4、MyD88 和p-NF-κB p65/NF-κB p65 蛋白表达水平均明显升高(P<0.05);与VMC 组比较,LL-37-H 组小鼠心肌组织TLR-4、MyD88 和p-NF-κB p65/NF-κB p65 蛋白表达水平显著降低(P<0.05),而LL-37-L 组小鼠心肌组织TLR-4、MyD88 和p-NF-κB p65/NF-κB p65 蛋白表达水平差异无统计学意义(P>0.05),见图2。
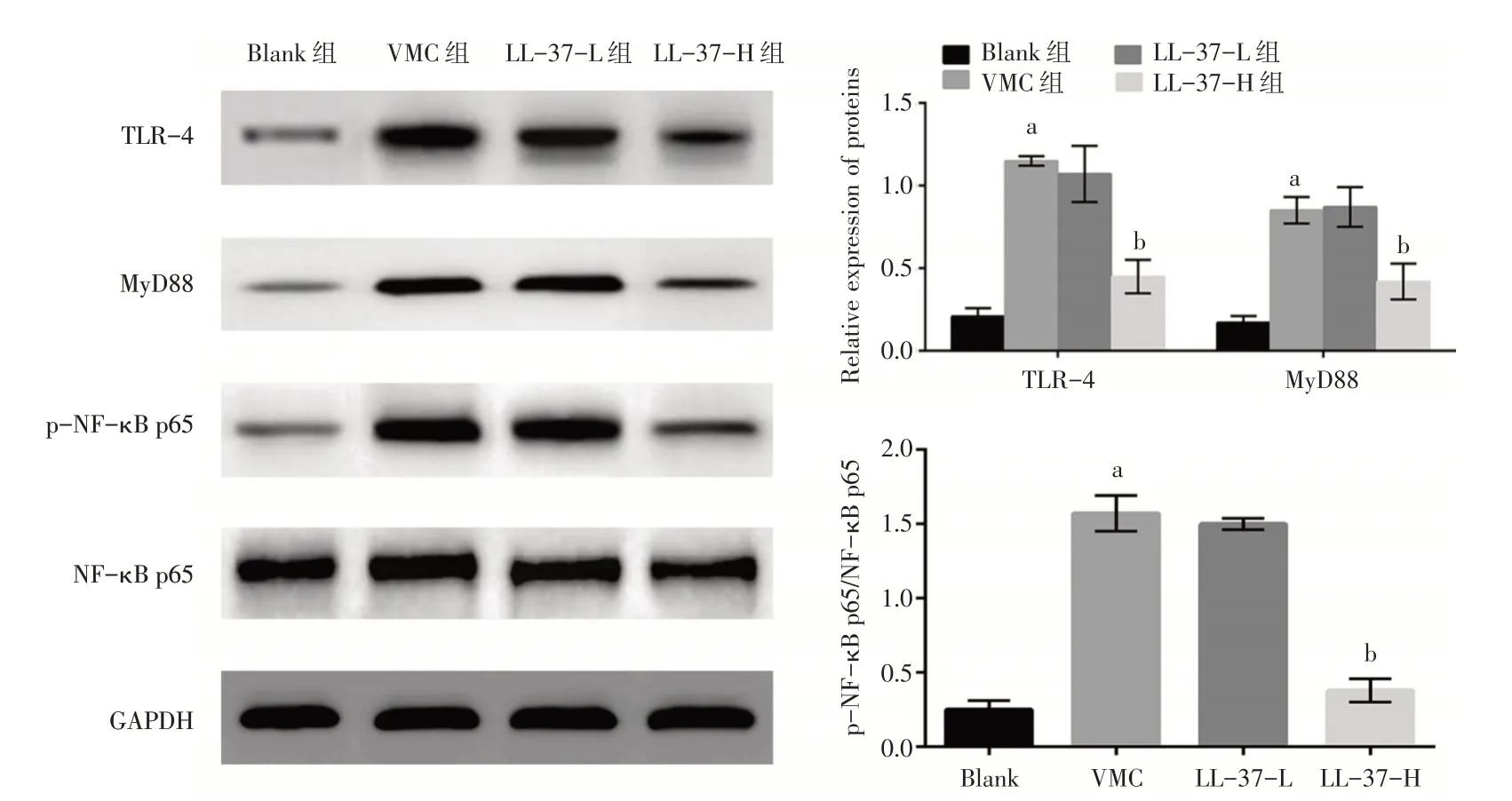
图2 各组小鼠心肌组织TLR-4、MyD88和p-NF-κB p65/NF-κB p65 蛋白表达水平比较
3 讨论
CVB3 是一种全球流行的小克氏病毒科肠道病毒,为无包膜的单链RNA 病毒,常与病毒性心肌炎有关。研究显示,CVB3 经腹腔注射感染Balb/c 小鼠建立VMC 模型中,其病理改变与小儿VMC 病理改变类似[7]。另外,CVB3 诱导的VMC小鼠炎症反应增强[8],并且促进心肌组织CVB3 病毒复制[9],最终导致心脏功能障碍。本研究结果显示,VMC 小鼠心肌组织病理形态发生显著变化,出现组织结构紊乱,细胞间质炎症细胞浸润和坏死。不仅如此,心肌组织炎症细胞因子浓度均升高,这些结果表明VMC 小鼠存在严重炎症反应。另外,VMC 小鼠心肌组织中CVB3 病毒高度复制,证明CVB3 诱导的VMC 小鼠模型构建成功。病毒感染心脏后出现炎症反应,并且伴随VMC 的病理过程,在VMC 急性期(病毒感染3~4 d)和亚急性期(病毒感染5~14 d),心肌细胞表达大量促炎细胞因子,包括IL-1β、IL-6 和TNF-α[10]。TLRs是连接天然免疫与获得性免疫的桥梁,在天然免疫细胞浸润心肌组织之前,TLRs 将病原体相关分子模式(PAMPs)识别为模式识别受体(PRRs),将PAMPs 作为病原体的保守基序和损伤相关分子模式(DAMPs)识别为模式识别受体[11]。在TLR 中,TLR4 在心脏中的表达水平最高,参与了多种病原体诱导的炎症反应[12]。当TLR4 识别出CVB3 的双链RNA 作为PAMPs 后,TLR4可通过MyD88 依赖性途径激活NF-κB,激活NF-κB 作为转录因子转移到细胞核,促进促炎症或炎症细胞因子的表达[13]。本研究结果表明,TLR-4、MyD88 和p-NF-κB p65在CVB3 诱导的小鼠心脏中的表达水平较正常对照组显著升高,进一步验证了TLR-4/NF-κB 信号通路激活参与CVB3 诱导VMC 的炎症反应。因此,阻断TLR4 是治疗炎症相关的心脏疾病的有效途径。同时,NF-κB 信号转导可介导急性VMC 的心肌炎症反应和代谢重构,而抑制NF-κB 信号转导可通过抑制炎症反应减弱多种病原体诱发的心肌炎[14]。
抗菌肽是抵御入侵病原体的第一道防线,其中人源抗菌肽LL-37 主要由中性粒细胞和上皮细胞产生。除了抗菌活性外,LL-37 还具有多种生物学活性,包括调节炎症反应和抗病毒作用[4,5]。研究表明,LL-37 通过抑制炎性细胞因子IL-6、IL-1β 和TNF-α 的产生,提高脓毒症小鼠的生存率[15]。据报道,LL-37 的抗病毒活性主要通过与病毒外膜的相互作用来介导,包括人类免疫缺陷病毒(HIV)-1、甲型流感病毒(IAV)、呼吸道合胞病毒(RSV)、感冒病毒(HRV)、牛痘病毒(VACV)、单纯疱疹病毒(HSV)、寨卡病毒(ZIKV)和丙型肝炎病毒(HCV)[5]。但人源抗菌肽LL-37 对CVB3 诱导的VMC 能否产生抗病毒作用尚不清楚。本研究结果显示,高浓度人源抗菌肽LL-37 对CVB3 诱导的VMC 有治疗作用,明显降低心肌组织炎症反应和CVB3 病毒复制,说明LL-37 对CVB3 诱导的VMC 也具有抗炎抗病毒作用。人源抗菌肽LL-37作为先天性宿主防御系统的效应分子,能明显阻止免疫识别受体TLR-4 释放[16],下调NF-κB 活性[17],进而抑制下游炎症细胞因子的表达。但人源抗菌肽LL-37 能否通过调控TLR-4/NF-κB 信号通路活性减轻CVB3诱导的VMC尚不清楚。本研究结果显示,人源抗菌肽LL-37 降低CVB3 引起的心肌组织炎症反应和病毒复制,改善心肌组织炎症损伤,可能与CVB3 诱导的VMC 心肌组织TLR-4/NF-κB 信号通路活性抑制有关。
综上所述,人源抗菌肽LL-37 降低CVB3 诱导的心肌组织炎症水平和CVB3 病毒复制,治疗心肌损伤,可能与心肌组织TLR-4/NF-κB 信号通路活性的抑制有关,对临床治疗CVB3 诱导的VMC 具有指导意义。

