采用TMT技术解析辣椒雄性不育关键蛋白研究
覃 成, 杨仕梅, 罗希榕, 李唐燕, 李 靖, 郭 娅,陀海燕, 涂韦波, 邱化荣
( 1.遵义职业技术学院现代农业系/贵州省遵义辣椒种质资源保护及繁育种植工程研究中心, 贵州 遵义 563006;2.遵义市农业科学研究院/遵义市作物基因资源与种质创制重点实验室, 贵州 遵义 563006)
辣椒(CapsicumannuumL.)为一年生或多年生茄科草本植物,原产中南美洲热带和亚热带地区,在全世界范围内广泛种植,是我国主要种植的蔬菜品种之一[1]。目前贵州辣椒的种植规模、加工业规模、产品集散规模等均居全国第一,总产值近80亿元,占全球贸易额的1.8%(http://www.fao.org)。辣椒现已成为贵州农业生产结构调整和乡村振兴战略的重要蔬菜种类。
在辣椒生产用种方面,与主要农作物(如玉米和水稻等)和其他大多数蔬菜作物(如番茄和大白菜等)一样,杂种一代是目前和今后的主要利用形式。因此,高效选育优良杂种一代以及大量繁殖高质量的种子是辣椒选育工作者不断追求的目标。目前,大量繁殖辣椒杂种一代种子的方法主要有人工去雄和利用雄性不育系进行人工授粉两种。由于后者可免除人工去雄,达到提高杂种一代种子纯度和降低杂种一代繁种成本的目的,从而成为大量繁殖辣椒杂种一代种子的理想途径。因此,如何更好地利用辣椒雄性不育选育优良杂种一代的研究备受关注。
辣椒中已报道的雄性不育类型主要有两种,即质核互作雄性不育(Cytoplasmic Male Sterility,CMS)和细胞核雄性不育(Genic Male Sterility,GMS)。其中,CMS是由细胞质和细胞核互作产生的,对于诸如辣椒这类以果实作为收获对象的作物而言,在利用CMS时,必须同时选育出不育系、保持系和恢复系以实现“三系”配套,其中以不育系×恢复系来大量繁殖杂种一代种子供生产应用。一般来说,经过较长期的严格选育,可以获得100%不育株的CMS系以实现“三系”配套,所以,辣椒CMS仍然是目前最常用的不育类型。但是,在辣椒选育种实践中,有时也会遇到以下两种情况,一是辣椒CMS的不育度容易受环境条件影响;二是辣椒CMS的恢复基因较多的存在于小果型材料中,而在大果型辣椒尤其是灯笼形甜椒材料中,由于普遍缺乏恢复基因而较难选育获得优良的恢复系。这就使得在利用辣椒CMS时存在一定的局限或者需要更长的选育时间。
GMS则只受细胞核基因控制,且大多属于单基因隐性遗传。与CMS相比,GMS通常具有不育性更为稳定以及不受恢保关系限制而容易选育获得各种类型的恢复(父本)系等优点,而且不存在不育胞质负效应和胞质单一化的潜在风险。然而,迄今为止,通过常规方法利用GMS繁殖辣椒杂种一代种子仍存在的最大缺点是,必须在开花初期逐一拔除GMS两用系作母本的群体内约50%的可育株。这就要求繁殖辣椒杂种一代种子的众多农户具有识别不育株和可育株的能力以及认真负责的态度。但在实际操作过程中,这也是较难保证杂种一代种子纯度的主要原因之一,从而影响了辣椒GMS的大规模应用。
近年来,国内外科学家针对主要农作物育种,先后提出了利用隐性核不育高效繁殖杂种一代种子的“SPT(Seed Production Technology)技术”和“智能不育杂交育种技术”,并在玉米和水稻中得到了证实和应用[2-3]。这为辣椒等蔬菜作物高效利用GMS提供了理论依据。但是,该技术的应用是以克隆得到确切的隐性核不育基因为前提的。迄今,仍未精准定位到调控辣椒隐性核不育的基因。
为解析植物不育系的分子机制,越来越多的生物技术应用到植物选育过程中,Zhang等[4]对棉花进行转录组分析,发现棉花雄性不育的候选调控基因;Tang等[5]通过转录组学和代谢组学对红麻细胞质雄性不育进行系统分析,发现不育系代谢主要涉及关键代谢途径。本研究利用蛋白质组学对辣椒不育系和可育系花芽进行分析,从差异蛋白亚细胞定位、保守结构域、GO和KEGG富集、代谢通路富集、蛋白互作等方面进行分析,以筛选和鉴定辣椒不育系相关的关键蛋白,从分子生物学角度为辣椒的遗传育种提供理论依据。
1 材料与方法
1.1 植物材料
辣椒S 033-A可育系和S 033-B不育系属于细胞核雄性不育系,朝天椒类型,种植在遵义职业技术学院辣椒种植基地,选取长势一致的植株,对S 033-A可育系和S 033-B不育系的花芽进行取样,每个株系3个重复,取样后立即置于-80 ℃液氮中备用。
1.2 蛋白质提取及肽段酶解
两个株系S 033-A可育系和S 033-B不育系采用SDT[4%(w/v)SDS,100 mmol/L Tris/HCl pH 7.6, 0.1 mol/L DTT]裂解法提取蛋白质,然后采用BCA法进行蛋白定量。每个样品取适量蛋白质采用Filter Aided Sample Preparation (FASP)方法进行胰蛋白酶酶解,采用C 18 Cartridge对肽段进行脱盐,肽段冻干后加入40 μL 0.1%甲酸溶液复溶,肽段定量(OD280)。
1.3 串联质谱标签(Tandem Mass Tag,TMT)定量分析
各样品分别取100 μg肽段,按照Thermo公司TMT标记试剂盒说明书进行标记。组别2个,每个组别含有3个重复样本,共计6个样本。
1.4 LC-MS/MS分析及数据分析
每份样品采用纳升流速的HPLC液相系统Easy nLC进行分离。缓冲液A为0.1%甲酸水溶液,缓冲液B为0.1%甲酸乙腈水溶液(乙腈为84%)。色谱柱用95%的A液平衡,样品由自动进样器上样到上样柱(Thermo Scientific Acclaim PepMap 100,100 μm×2 cm,nanoViper C 18),经过分析柱(Thermo scientific EASY column,10 cm,ID 75 μm,3 μm,C 18-A 2)分离,流速为300 nL/min。
样品经色谱分离后用 Q-Exactive 质谱仪进行质谱分析。检测方式为正离子,母离子扫描范围300~1 800 m/z,一级质谱分辨率为70 000 at 200 m/z,AGC(Automatic Gain Control) target为1 e6,Maximum IT为50 ms,动态排除时间(Dynamic exclusion)为60.0 s。多肽和多肽碎片的质量电荷比按照下列方法采集:每次全扫描(full scan)后采集20个碎片图谱(MS 2 scan),MS 2 Activation Type为HCD,Isolation window为2 m/z,二级质谱分辨率 17 500 at 200 m/z,Normalized CollisionEnergy为30 eV,Underfill为0.1%。
1.5 生物信息学分析
蛋白质聚类分析利用R语言包Complexheatmap对样品和蛋白质的表达量两个维度进行分类(距离算法:欧几里得,连接方式:Average linkage),并生成层次聚类热图。CELLO(http://cello.life.nctu.edu.tw/)的方法进行亚细胞定位预测[6]。利用Pfam数据对蛋白结构域进行分析[7],利用InterProScan软件包进行比对[8]。利用Blast 2 GO对目标蛋白质集合进行GO注释[9],利用KAAS软件对目标蛋白质进行KEGG注释,利用ClusterProfiler对GO和KEGG进行富集分析[10]。基于 IntAct (http://www.ebi.ac.uk/intact/main.xhtml)或者 STRING(http://string-db.org/)数据库中的信息查找目标蛋白质之间的直接和间接相互作用关系,并使用 CytoScape v 3.2.1生成相互作用网络并对网络进行分析[11]。
2 结果与分析
2.1 蛋白质鉴定及相对定量
在对两个辣椒品种的蛋白质分析中,共鉴定到二级图谱373 379个,数据库匹配谱图总数为96 379个,肽段总数为42 364条,唯一肽段总数为38 304条,鉴定到蛋白总数为7 667个,可定量蛋白为7 629个。
为展示比较组间表达蛋白质的显著性差异,将比较组中的蛋白质以表达差异倍数(Fold Change, FC)表示,并对其进行差异分析,最终得到504个显著差异蛋白(FC>1.2且p<0.05)。其中在S 033-A中上调351个蛋白(FC>1.2且p<0.05),在S 033-B中上调153个蛋白(FC<0.83且p<0.05)(图1)。
2.2 亚细胞定位及结构域分析
对得到的504个差异表达蛋白进行亚细胞定位及结构域分析。亚细胞定位最多的为细胞质,含有153个差异表达蛋白,细胞核含有145个,叶绿体含有137个,质膜含有95个,线粒体中含有64个,胞外含有57个,液泡中含有9个,溶酶体含有9个,其他含有2个(图2)。
504个差异表达蛋白结构域分析发现,共有421个蛋白具有结构域(图3),结果显示,定位比较多的分别为谷胱甘肽转移酶N(9个),过氧化物酶(8个),尿苷二磷酸葡萄糖醛酸/尿苷二磷酸葡萄糖转移酶(8个),热激蛋白/α晶状体家族(6个),细胞色素P 450(6个),DEAD/DEAH-box解旋酶(6个),RNA解旋酶(6个),P Bet_v_1蛋白家族(6个),PAP原纤蛋白(6个),谷胱甘肽转移酶C(5个),捕光叶绿素 a/b 结合蛋白酶(5个),果胶酯酶(5个),果胶甲酯酶(5个),ABC转运蛋白(4个),半胱氨酸蛋白酶(4个),BURP(4个),组织蛋白酶前肽抑制剂结构域(4个),谷胱甘肽s-转移酶(4个),烯基-(酰基载体蛋白)还原酶(4个),Ras酶(3个)。
2.3 GO和KEGG富集分析
对得到的差异表达蛋白进行GO注释,并对其进行可视化分析,结果(图4)发现,在GO注释中主要分为三大类,分别为生物学过程、分子功能和细胞组成。在生物学过程中,差异表达蛋白主要富集在光合作用(GO:0015979,23)、光合作用光反应(GO:0019684,17)、光合电子传递链(GO:0009767,7)、脱毒(GO:0098754,13)、光合作用光捕获(GO:0009765,7)、有毒物质响应(GO:0009636,13)、光系统Ⅱ组成(GO:0010207,5)和电子传递链(GO:0022900,8);在分子功能过程中,差异表达蛋白主要富集在谷胱甘肽转移酶活性(GO:0004364,7)、色素结合(GO:0031409,4)、poly(U)RNA结合(GO:0008266,2)、葡聚糖内-1,3-β-葡糖苷酶(GO:0042973,3)、转移酶(转移烷基或芳基(甲基除外)的基团)(GO:0016765,10)和氧化还原酶(作用于CH-NH 2组供体)(GO:0016638,4);在细胞组成过程中,差异表达蛋白主要富集在叶绿体类囊体(GO:0009534,30)、质体类囊体(GO:0031976,30)、类囊体(GO:0009579,35)、叶绿体(GO:0009507,7)、质体(GO:0009536,81)和类囊体膜(GO:0042651,24)。
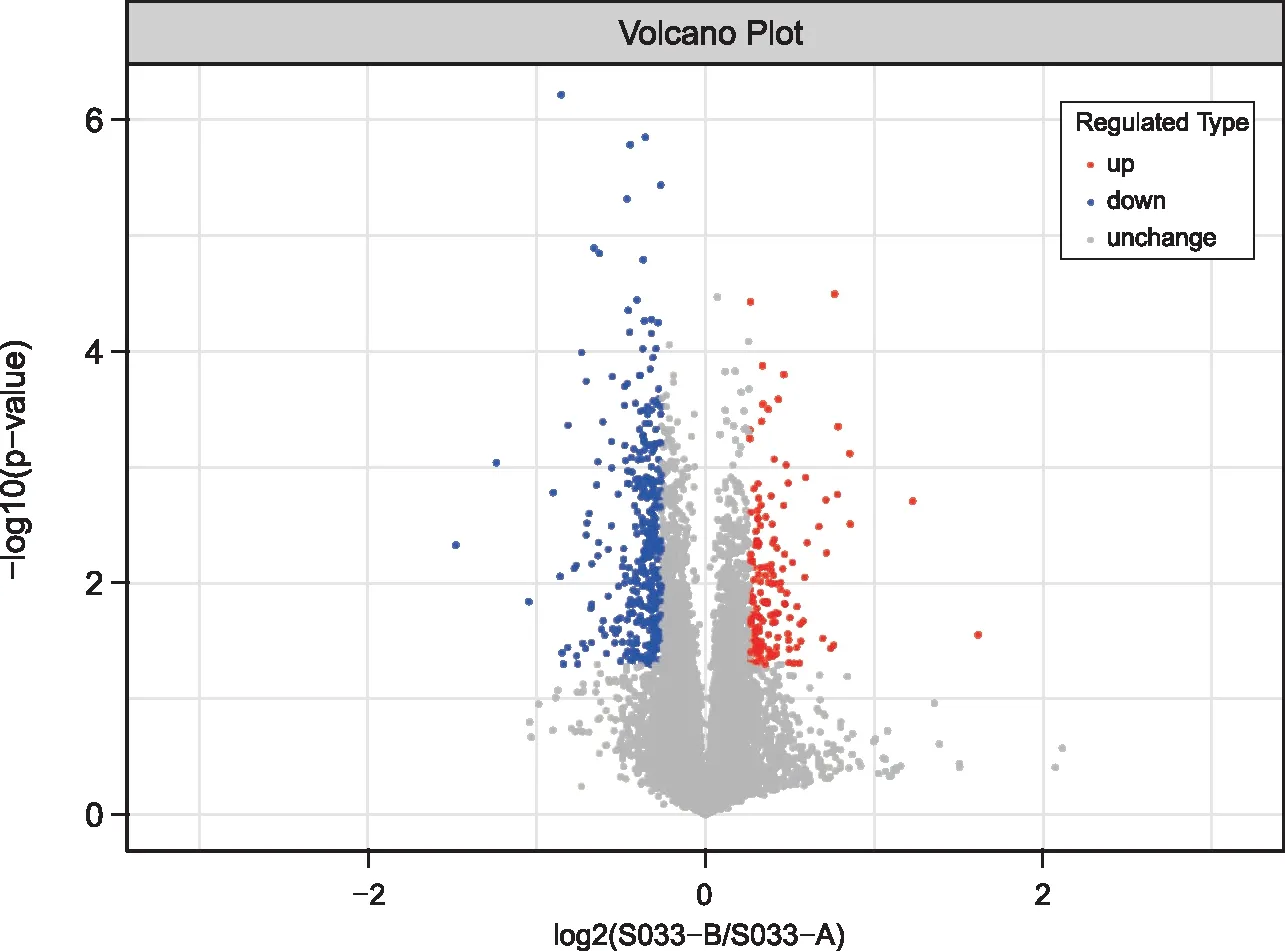
注:红色实心圆点表示上调的差异表达蛋白,蓝色实心圆点表示下调的差异表达蛋白,灰色实心圆点表示无差异表达的蛋白。 图1 S 033-B_VS_S 033-A火山图 Fig.1 S 033-B_VS_S 033-A volcano map
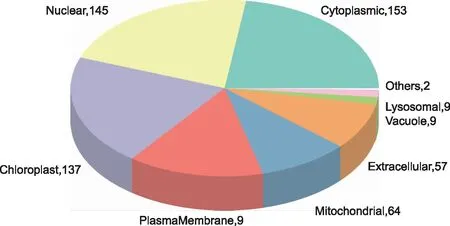
注:不同颜色代表相应的亚细胞定位,数字代表定位到对应亚细胞的差异表达蛋白数目。图2 S 033-B_VS_S 033-A 组差异表达蛋白质亚细胞定位饼图Fig.2 Pie map of subcellular localization of differentially expressed proteins in S 033-B_VS_S 033-A group
对上述差异表达蛋白进行KEGG注释,并对其进行可视化分析,结果(图5)发现,差异表达蛋白主要注释到光合作用生物的碳固定作用(ko 00710,11)、药物代谢-细胞色素P 450(ko 00982,7)、细胞色素P 450对外源性药物的代谢作用(ko 00980,7)、光合作用(ko 00195,9)、单萜生物合成(ko 00902,3)、谷胱甘肽代谢(ko 00480,10)、类黄酮生物合成(ko 00941,4)、双组分系统(ko 02020,5)、苯丙素类生物合成(ko 00940,9)、药物代谢-其他酶(ko 00983,7)、光合作用-天线蛋白(ko 00196,4)和玉米素生物合成(ko 00908,3)。
2.4 蛋白互作网络分析
为研究蛋白之间的相互作用关系,利用STRING数据库进行比对,构建辣椒不育系蛋白互作网络图(图6)。在蛋白互作网络图中,主要分为5个大类别(Degree≥4),其余的可分为8个小类(Degree<4)。对421个已确定结构域的蛋白进一步确定,取已注释到GO和KEGG中的,且存在蛋白互作关系的蛋白,最终发现51个交集(图7)。在S 033-B中上调表达的有11个,在S 033-A中上调表达的有40个。在S 033-A上调的差异表达蛋白中,最为显著且Degree>20的有5个蛋白,分别是Capana12g001382(Degree=44)、Capana01g000893(Degree=40)、Capana05g002020(Degree=31)、Capana02g002193(Degree=29)、Capana10g001330(Degree=26),Capana12g001382基因GO注释到生物学过程如光合作用、光合作用光反应、光合电子传递链、前体代谢物和能量的产生、光系统Ⅰ的光合电子传递、应激反应等,分子功能有催化活性、运输活动、水解酶活性等。细胞组成有叶绿体类囊体、质体类囊体、类囊体、叶绿体、质体、类囊体膜等,参与到KEGG通路光合作用途径;Capana01g000893(Degree=40),其GO注释到细胞代谢过程、氮化合物代谢过程等生物学过程。ATP结合、尿苷激酶活性等分子功能,胞液和叶绿体等细胞组成,参与到光合生物的碳固定过程;Capana05g002020(Degree=31),其GO注释到去磷酸化和碳水化合物代谢过程,催化活性、水解酶活性、果糖1,6-二磷酸1-磷酸酶活性等分子功能。参与到光合生物的碳固定过程;Capana02g002193(Degree=29),其GO注释到光合作用、光系统中的光合电子传递、ATP的合成耦合质子转运等生物学过程,质子转运ATP酶活性(旋转机制)、跨膜转运蛋白活性等分子功能。叶绿体被膜、叶绿体类囊体膜等细胞组成,参与到光合作用和氧化磷酸化过程;Capana10g001330(Degree=26),其GO注释到去磷酸化和碳水化合物代谢过程等生物学过程,催化活性、水解酶活性、果糖1,6-二磷酸1-磷酸酶活性等分子功能,参与到光合作用生物的碳固定、AMPK信号通路、甲烷代谢、磷酸戊糖途径、糖酵解/糖异生、果糖和甘露糖代谢等途径。
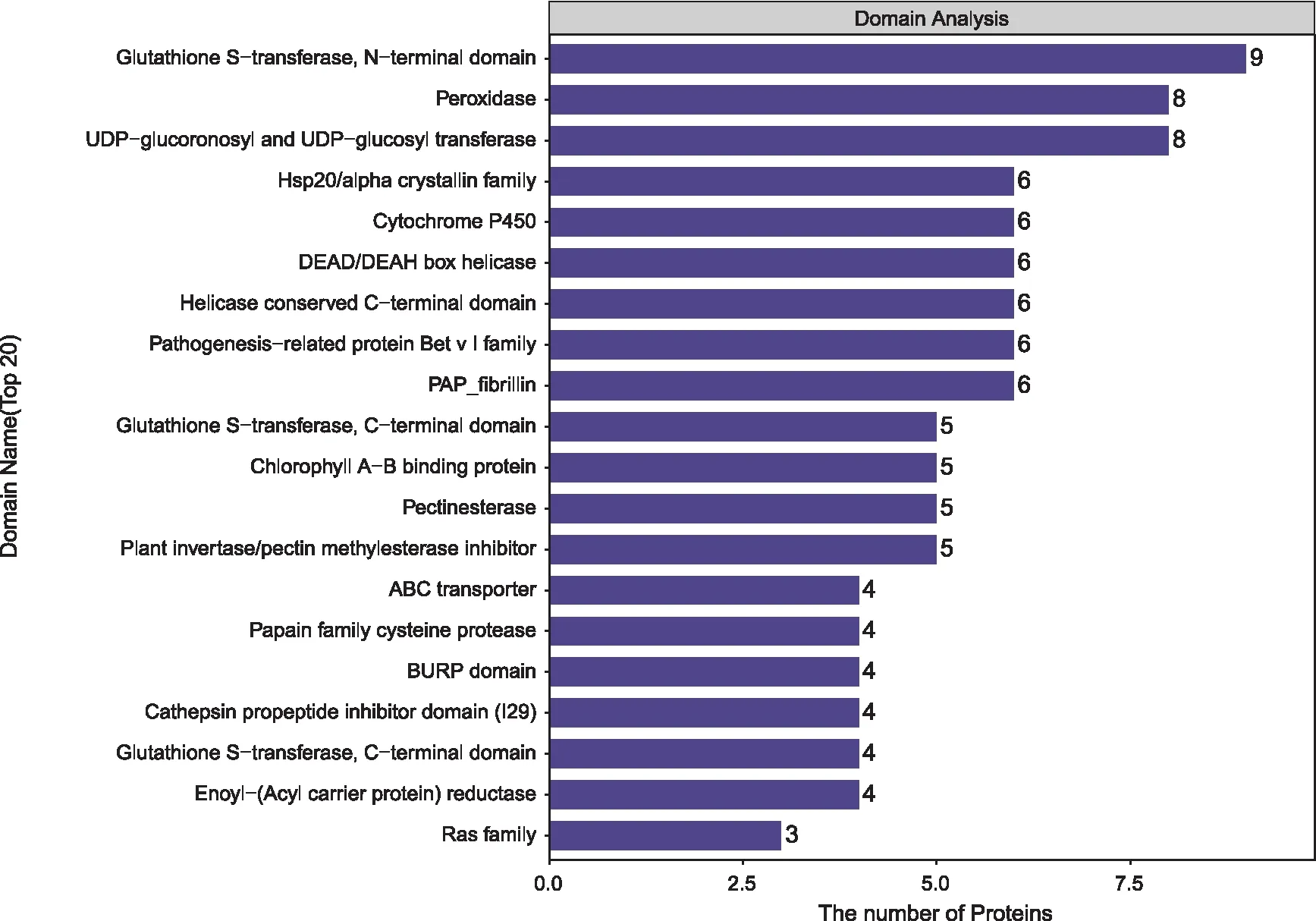
注:横坐标表示差异表达蛋白的数目,纵坐标表示不同的结构域名称。 图3 S 033-B_VS_S 033-A 组差异表达蛋白质结构域分析 Fig.3 Domain analysis of differentially expressed proteins in S 033-B_VS_S 033-A group
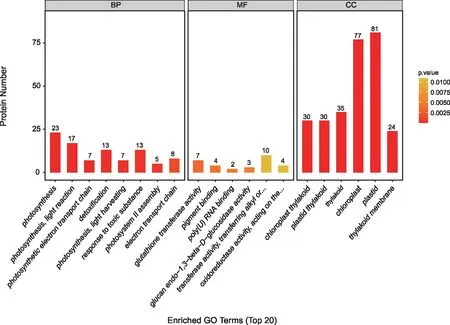
注:横坐标表示不同的GO富集,纵坐标表示差异表达蛋白的数目。BP为生物学过程;MF为分子功能;CC为细胞组成。 图4 S 033-B_VS_S 033-A 组差异表达蛋白GO富集分析 Fig.4 GO enrichment analysis of differentially expressed proteins in S 033-B_VS_S 033-A group
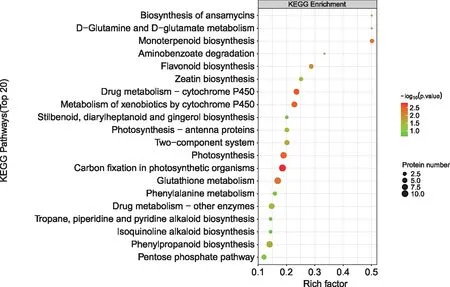
注:横坐标代表富集比例,纵坐标表示差异蛋白统计结果,颜色表示显著性。 图5 S 033-B_VS_S 033-A 组差异表达蛋白KEGG富集分析 Fig.5 KEGG enrichment analysis of differentially expressed proteins in S 033-B_VS_S 033-A group
在S 033-B上调的差异表达蛋白中,最为显著的是前5个蛋白,其中Capana03g001373和Capana03g001371(Degree=13)含有相同的保守结构域,GO注释到细胞代谢过程、肽代谢过程、肽生物合成过程、基因表达等生物学过程,分子功能、结构分子活性、核糖体的结构组成等分子功能和细胞质、细胞组成、细胞、细胞器等细胞组成,参与到KEGG通路核糖体途径,2个蛋白GO和KEGG注释结果一致;Capana10g001612,GO注释到前核糖体大亚基前体的组装、核糖体大亚基组装、细胞代谢途径、基因表达等生物学过程,结构分子活性、核糖体的结构组成等分子功能和胞质部分、细胞质、细胞器、胞内细胞器等细胞组成,参与到KEGG通路核糖体途径;Capana10g002431,GO注释到细胞代谢过程、翻译、肽生物合成过程等生物学过程,结构分子活性、核糖体的结构组成等分子功能和胞质、细胞器、胞浆大核糖体亚基等细胞组成,参与到KEGG通路核糖体途径;Capana01g000098,GO注释到内质网蛋白定位的建立、靶向膜的共翻译蛋白、胞内运输等生物学过程,7 S RNA结合、RNA结合、核酸结合等分子功能和胞质、信号识别粒子等细胞组成,参与到蛋白质输出和聚糖生物合成途径等KEGG通路。
2.5 候选蛋白的确定
两个辣椒品系的蛋白质分析共鉴定到504个显著差异表达蛋白,其中421个含有保守结构域,365个注释到GO数据库,133个注释到KEGG数据库,130个存在蛋白互作关系。在这些差异表达蛋白中,51个蛋白有交集,其中在S 033-B中上调表达的蛋白有11个,其余40个在S 033-A中上调表达。通过GO和KEGG富集分析选取极显著差异(p<0.01)表达的蛋白,同时结合蛋白互作网络分析(Degree>10),最终得到6个蛋白为关键候选基因(Capana01g002398、Capana05g002550、Capana09g001520、Capana05g002020、Capana10g001330和Capana06g001463),且在S 033-B中均呈现负调控趋势(图7)。其中Capana01g002398和Capana05g002550含有相同蛋白保守结构域,其GO富集到光合作用、光合作用光响应、光合作用光收获、前体代谢物和能量的产生、光合作用光系统Ⅰ的光收集、应激反应等生物学过程,分子功能富集到离子结合、金属离子结合、有机环化合物结合等,细胞组成富集到叶绿体类囊体、质体类囊体、类囊体、叶绿体,KEGG富集到光合作用-天线蛋白途径。Capana09g001520蛋白GO富集到生物学过程的光合作用、光合作用光响应、光合作用光收获、前体代谢物和能量的产生;分子功能富集到色素结合、离子结合、金属离子结合等,细胞组成富集到叶绿体类囊体、质体类囊体、类囊体、叶绿体,KEGG富集到光合作用-天线蛋白途径。Capana05g002020和Capana10g001330含有相同蛋白保守结构域,其GO富集到分子功能的果糖1,6-二磷酸1-磷酸酶活性,KEGG富集到光合作用生物的碳固定途径。Capana06g001463蛋白GO富集到生物学过程能量耦合质子输运、ATP的合成耦合质子转运;细胞组成富集到细胞部分、膜部分、膜蛋白复合物等。
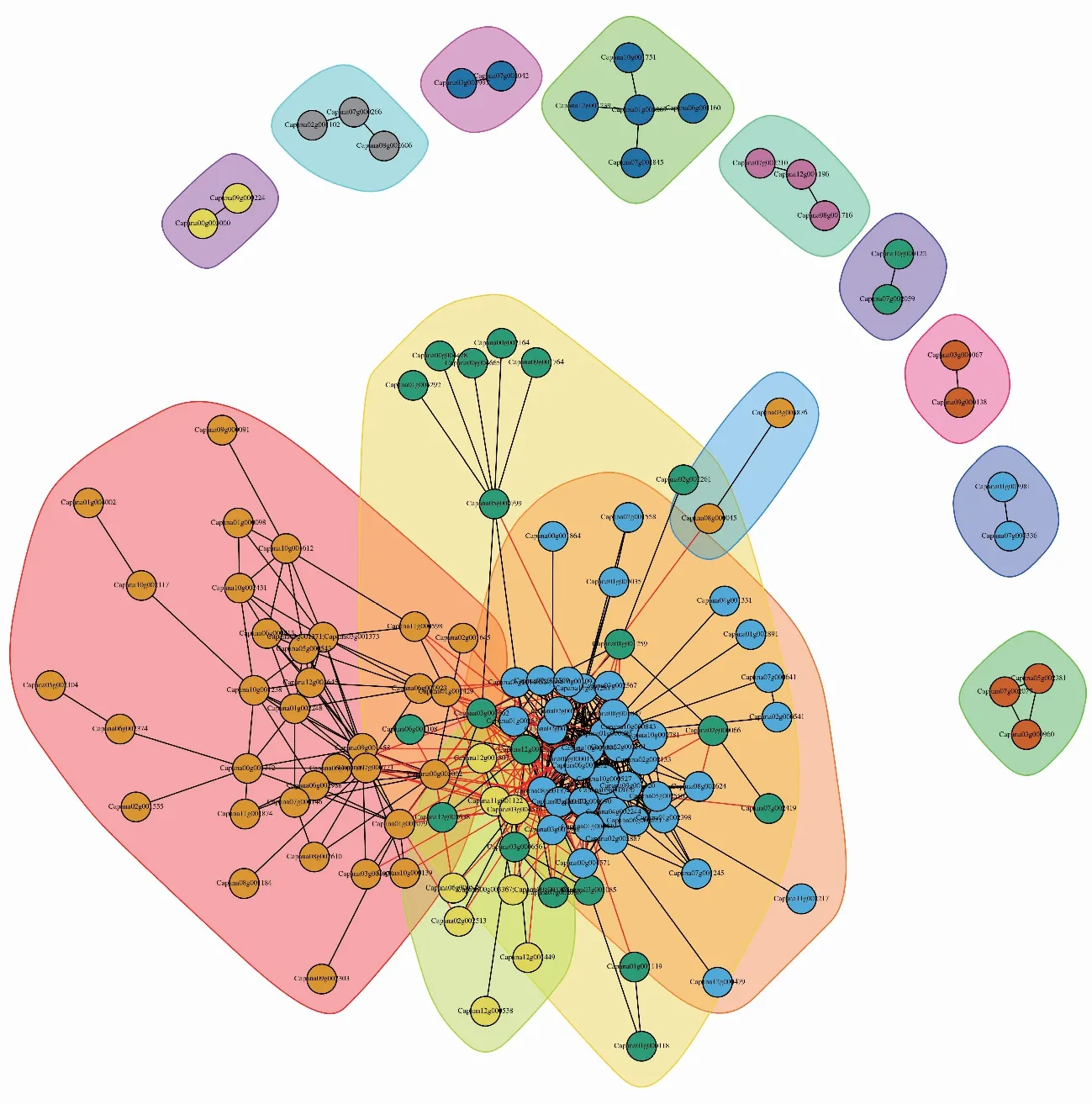
图6 S 033-B_vs_S 033-A 组差异表达蛋白质相互作用网络图 Fig.6 Interaction network diagram of differentially expressed proteins in S 033-B_VS_S 033-A group
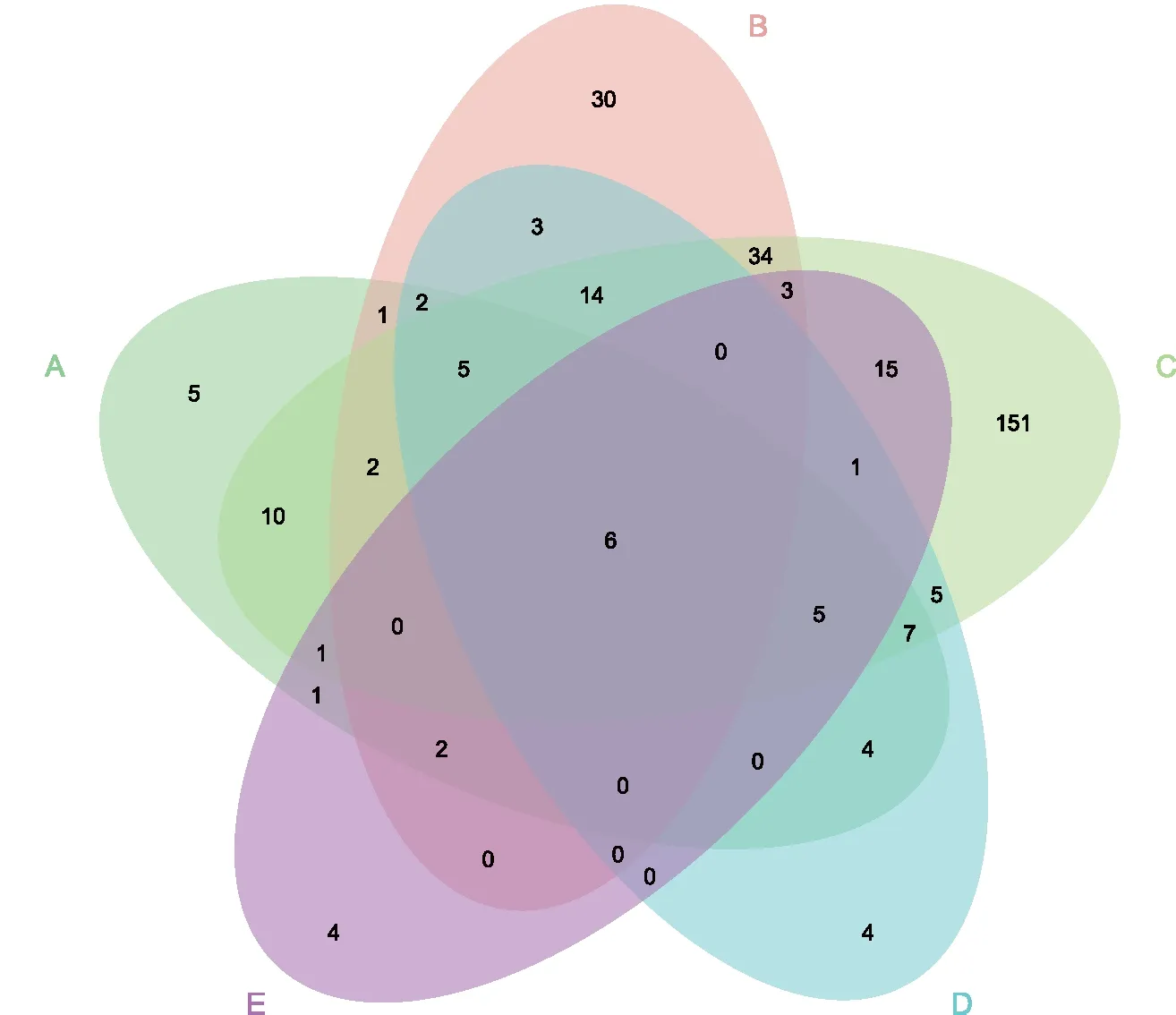
注:A表示差异表达蛋白、保守结构域、GO、KEGG和蛋白互作的交集;B表示显著性保守结构域;C~D表示显著富集GO和KEGG蛋白;E表示蛋白互作中Degree>10。 图7 关键候选蛋白维恩图Fig.7 Venn diagram of key candidate proteins
3 讨 论
杂交育种技术作为一种遗传育种手段,在农业、经济作物等研究方面具有重要价值及意义。本研究对辣椒不育系和保持系中辣椒花芽进行蛋白质组学分析,通过对两个品系蛋白进行鉴定,鉴定出总蛋白数为7 667个,可定量蛋白为7 629个,表明在花芽中,转录翻译为蛋白较多,且有较多蛋白参与开花过程。亚细胞定位发现主要在细胞核、细胞质、叶绿体和线粒体等部位,而细胞核同线粒体之间的相互作用会影响植物的形态特征,包括生长和发育[12]。亚细胞定位普遍在细胞核等部位,由于其内部存在相互作用,产生非功能性花粉,导致辣椒雄性花粉不育成为可能。
在504个差异蛋白中,有421个蛋白在数据库比对发现存在保守结构域,保守结构域主要为谷胱甘肽S-转移酶(GST),过氧化物酶结构域,UDP-葡萄糖苷和UDP-葡萄糖苷转移酶结构域,热激蛋白结构域以及细胞色素结构域等。植物生长过程中,酶具有催化作用和非催化作用,起到保护植物机体以及调节信号转导、调节细胞的氧化还原稳态等作用,推测不育系通过降低酶活性造成辣椒雄性不育。
GO富集分析主要集中在光合作用、光合作用光反应等生物学过程,谷胱甘肽转移酶活性、色素集合等分子功能,叶绿体类囊体、质体类囊体等细胞组成中。Zhou等[13]通过蛋白质组学技术,发现在不育系花芽中,差异基因主要富集到碳水化合物能量代谢、花粉壁合成、GO富集到蛋白质合成与降解、类黄酮生物合成、植物激素信号传导等生物学过程。Li等[14]通过iTRAQ-based蛋白质组学探究大豆雄性不育的分子机制,发现雄性不育的发生可能与能量供应不足、蛋白质合成和降解失衡、细胞程序性死亡有关;对差异表达蛋白分析发现,存在能量代谢、蛋白质合成等过程。诸多植物不育的研究表明,能量代谢、蛋白质合成等可能参与植物不育发育过程。本研究鉴定的6个候选蛋白同样参与到能量代谢、光合作用、能量耦合质子输运等生物学过程。上述研究涉及的差异表达蛋白主要富集在光合作用碳固定、细胞色素P 450、光合作用、单萜生物合成、类黄酮生物合成等途径。通过KEGG富集分析,本研究鉴定的6个候选蛋白同样注释到光合作用和光合作用-天线蛋白,推测该不育系可能为光温敏不育系,对光照较为敏感,因缺乏相应的光合作用和能量代谢过程,导致辣椒雄性不育,无法产生可育花粉。
随着对杂交育种的深入研究,越来越多的基因被克隆和功能验证,具有调控植物不育的功能。赵婷婷等[15]同源克隆辣椒MS1基因,发现NtMS1基因具有控制烟草花粉育性功能。目前已有众多不育相关基因被克隆,陈文涛等[16]通过同源克隆,从红麻中克隆出同红麻雄性不育相关的HcMS1基因;王清华等[17]研究发现,大葱atp6基因在保持系中表达较不育系高1.14倍;王姣等[18]克隆了辣椒胞质雄性不育CaCOX3基因,发现在小孢子成熟期时该基因在胞质雄性不育系中表达明显高于保持系,推测其可能引起能量代谢异常,造成不育。Jeong K等[19]研究发现了辣椒雄性不育基因CaMS1。本研究通过对差异蛋白系统鉴定发现,MS基因并未参与辣椒不育系花芽调控过程,表明S 033-B品系的不育系同CaMS 1调控的不育系属不同类型,其不育系调控分子机制也不同。
综上,本研究对两个辣椒品系(不育系和保持系)的花芽进行了蛋白质组学研究,但并未完全解析辣椒不育相关的关键候选蛋白,仍然存在不足,接下来将结合转录组学、功能基因组学和基因编辑等方法,对辣椒不育系和保持系进行系统深入研究,对候选蛋白进行基因克隆和功能验证,以确定其关键蛋白。
4 结 论
在遵义朝天椒不育系和保持系中,鉴定出7 667个蛋白,其中可定量蛋白为7 629个,差异表达分析的结果显示,保持系S 033-A中351个蛋白上调表达,不育系S 033-B中153个蛋白上调表达。亚细胞定位最多的为细胞质、细胞核以及叶绿体,GO和KEGG富集分析发现,大部分差异表达的蛋白主要富集在光合作用和光合作用碳固定。通过以上分析,最终确定6个蛋白为不育系关键候选蛋白,这些发现为辣椒杂交育种和雄性不育系利用提供了理论支撑。

