pH 值对热处理后菠菜和油菜类囊体膜稳定性的影响
曹家蕊,王 冰,李方巍,张 燕*
(中国农业大学食品科学与营养工程学院,国家果蔬加工工程技术研究中心,北京 100083)
绿色果蔬加工过程中的颜色劣变是影响绿色果蔬原料商品化增值的主要问题,也是食品科学与工程领域研究的重要科学问题[1-2]。绿色是由存在于植物类囊体上的叶绿素蛋白复合体呈现的。加工过程中,类囊体膜破损、叶绿素蛋白复合体降解,形成的游离叶绿素进一步降解,导致了加工产品的颜色劣变和品质下降[3-5]。长久以来一直没有有效的策略控制加工绿色果蔬颜色的劣变。
pH值是加工过程中影响叶绿素降解的主要因素之一,低pH值下叶绿素能够迅速脱镁形成脱镁叶绿素,使果蔬颜色由鲜绿色变成橄榄绿,且随着酸性的增强,破坏性增强;而高pH值下叶绿素则会发生皂化水解反应,生成鲜绿色的稳定化合物[6-7]。因此,部分加工技术和工艺通过调节环境pH值对果蔬进行护绿[8-9],使叶绿素在中性或偏碱性条件下形成皂化物,延迟脱镁叶绿素的形成[10-13]。此方法在加工初期有一定效果,但在贮藏过程中,保护作用逐渐降低[14]。综上所述,这些研究仍然关注于叶绿素的降解。
樊昶昶等[15]采用微量差示扫描量热仪研究了梯度升温下菠菜和油菜类囊体膜的变化,发现热处理改变了类囊体膜上多肽、蛋白质的组成和结构,不利于叶绿素的保持;并且热处理后仍有大部分叶绿素以叶绿素蛋白复合体的形式存在。同时,该研究还证明了油菜类囊体膜的热稳定性优于菠菜类囊体膜。
pH值作为加工过程中影响颜色变化和叶绿素降解的重要因素,其对类囊体膜,尤其是叶绿素蛋白复合体稳定性的影响鲜有研究。基于此,本实验以菠菜和油菜为研究对象,分析不同pH值对热处理后类囊体膜稳定性的影响,包括类囊体膜的色度值、多肽组分、可溶性蛋白含量、类囊体膜吸收光谱以及叶绿素的倒置荧光显像。分析热处理后,pH值对类囊体膜及叶绿素蛋白复合体的影响,为找到叶绿素降解的控制策略提供理论参考。
1 材料与方法
1.1 材料与试剂
菠菜和油菜均购于中国农业大学东校区家属院果蔬市场。
蔗糖、氯化钠、聚乙二醇4000、氢氧化钠、盐酸 国药集团化学试剂有限公司;磷酸缓冲液(pH 7.2~7.4) 北京索莱宝生物科技有限公司;所有溶剂均为分析纯。
1.2 仪器与设备
Color Quest型色差仪 美国HunterLab公司;JY04S-3C型凝胶成像仪 北京君意东方电泳设备有限公司;UV-probe型紫外-可见分光光度计 日本岛津公司;Nikon ECLIPSE Ti型倒置荧光显微镜 北京恒三江仪器销售有限公司。
1.3 方法
1.3.1 类囊体膜的提取
参考芦然[16]、王蓉蓉[17]的方法,将新鲜菠菜洗净后置于4 ℃冷库中进行预冷处理,大约1 h后取预冷叶片进行类囊体膜的提取。每40 g叶片加入200 mL预冷的提取液(0.1 mol/L蔗糖,0.2 mol/L氯化钠,50 mmol/L磷酸缓冲液,2.5%聚乙二醇4000,pH 7.4),家用高速匀浆器匀浆约1 min至无明显绿色碎片,匀浆液经8 层纱布过滤,滤液立即在4 ℃、3 000×g离心5 min,收集沉淀。将沉淀用10 倍体积的预冷清洗液(同提取液,不包含聚乙二醇4000)进行悬浮,4 ℃、3 000×g离心5 min,收集沉淀。将沉淀继续用5 倍体积的预冷清洗液进行悬浮,4 ℃、500×g离心2 min,收集上层悬浮液。将悬浮液在4 ℃、3 000×g离心10 min,收集沉淀。将沉淀用悬浮液(0.31 mol/L蔗糖,50 mmol/L氯化钠,50 mmol/L磷酸缓冲液,pH 6.9)进行悬浮,即可得到类囊体膜制备液,该溶液可贮藏于-20 ℃备用。
1.3.2 类囊体膜的处理
将5 份盛有95 mL类囊体膜制备液的100 mL锥形瓶置于水浴锅中,进行热处理,待膜体系中心温度达到90 ℃时,计时热烫90 s,取出后将其在冰水中迅速冷却。参考蒋将[18]的方法并略作修改,将热烫后的类囊体膜制备液(初始pH 6.9)分别用2 mol/L HCl溶液滴定至pH 3.6、4.6、5.8,或者用2 mol/L NaOH溶液滴定至pH 6.9、7.5,并置于不同pH值(3.6、4.6、5.8、6.9、7.5)、37 ℃的恒温培养箱,分别在处理期0、0.25、0.5、1、2、4、8、24、48 h和72 h,随机抽取样品。
1.3.3 表观色值测定
采用Color Quest型色差仪对待测样品进行分析,选择反射模式进行测定,得到a*(红-绿值)。
1.3.4 类囊体膜多肽组分测定
参考韦司棋[19]的方法略加修改,向60 μL类囊体膜溶液加15 μL 5×蛋白质上样缓冲液(含二硫苏糖醇)涡旋混匀,经高温变性、离心后,取上清液进行点样,再加电极缓冲液,取出胶放在水中10 min,而后放入配制好的染色液中,在摇床上振荡染色约12 h,水洗2~3 次,再加入脱色液脱色约12 h。采用凝胶成像系统进行摄影。
1.3.5 类囊体膜可溶性蛋白含量测定
取100 μL类囊体膜溶液,加入900 μL磷酸盐缓冲液,经振荡混匀、离心后,取上清液,用于可溶性蛋白测定。采用Lowry法蛋白浓度测定试剂盒测定2 种蔬菜的类囊体膜中可溶性蛋白质含量。采用分光光度计法分析。
1.3.6 类囊体膜吸收光谱测定
使用岛津UV-probe紫外可见分光光度计对类囊体膜吸收光谱进行测定。取100 µL类囊体膜溶液,加到2 mL pH 7.5的磷酸盐缓冲液(含0.3 mol/L蔗糖,0.01 mol/L KCl)中,1 200×g离心5 min后取上清液,在室温条件下测定波长400~720 nm的吸收光谱。
1.3.7 倒置荧光显微镜观察
在避光环境中,取5 μL类囊体膜悬浮液,制成玻片。使用荧光光源,选择DAPI滤光块,以蓝光激发叶绿素发出绿色荧光,采集叶绿素荧光图片。
1.4 数据统计及图形分析
应用SPSS statisics 17的方差分析(ANOVA)对实验数据进行显著性分析,P<0.05,差异显著;应用Origin Pro 8.6统计进行数据统计分析并制图;应用Image J对蛋白条带进行灰度分析。
2 结果与分析
2.1 pH值对热处理后类囊体膜表观色值的影响

图1 pH值对类囊体膜的-a*值的影响Fig. 1 Effects of pH on -a* value of thylakoid membrane
如图1所示,放置期间,菠菜和油菜类囊体膜在不同pH值条件下,-a*值均显著降低(P<0.05),pH 3.6、4.6条件下-a*值下降速率较快。-a*值与叶绿素呈色相关,叶绿素大量损失造成-a*显著下降,这与刁恩杰[20]、杨慧[21]等的研究结果一致。37 ℃放置72 h后,与菠菜相比,油菜类囊体膜的-a*值保留率较高,表明油菜类囊体膜能够更好地保持蔬菜色泽。
低pH值会使类囊体膜中的游离叶绿素迅速脱镁,形成黄褐色脱镁叶绿素,影响食品色泽[22]。而低pH值是否会破坏叶绿素蛋白复合体,进而破坏结合态叶绿素,仍需进一步分析不同pH值条件下,类囊体膜多肽组分的变化。
2.2 pH值对热处理后类囊体膜中多肽组分的影响
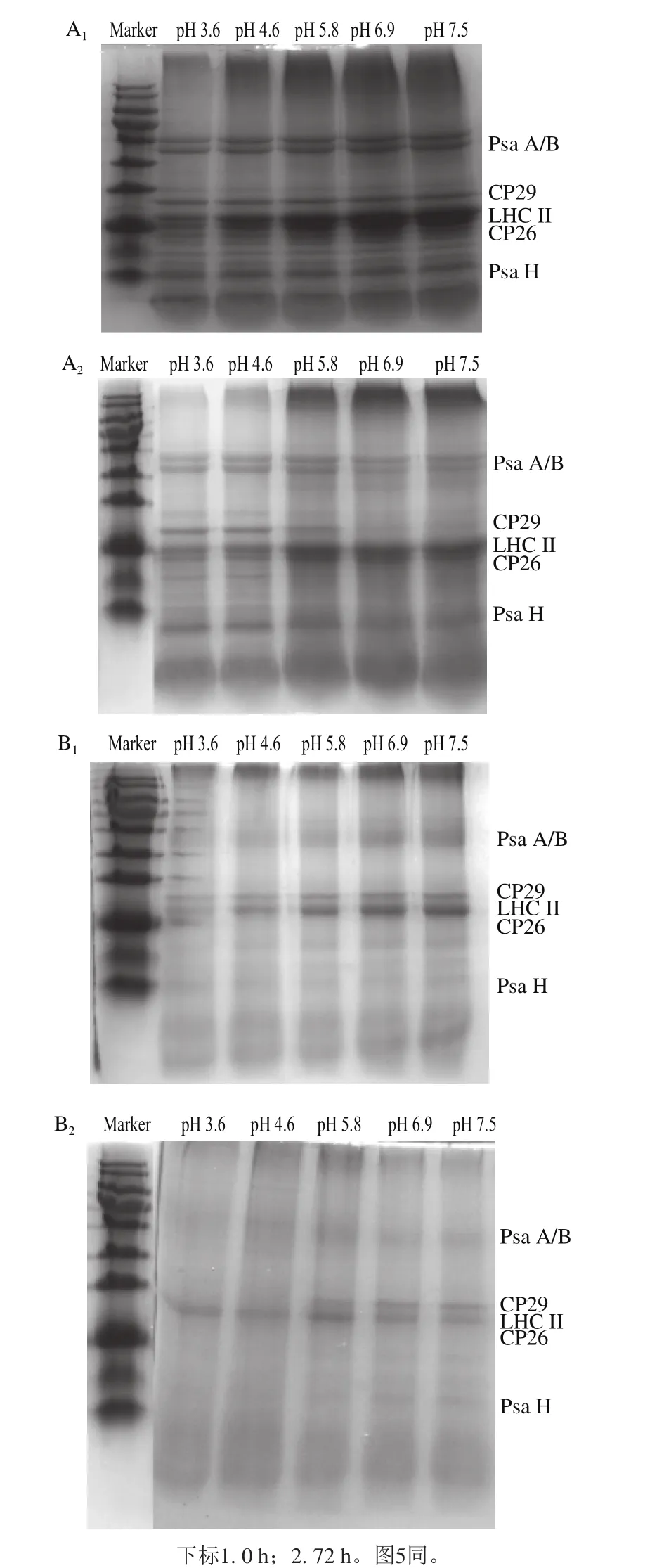
图2 pH值对类囊体膜多肽组分的影响Fig. 2 Effects of pH on soluble polypeptide composition of thylakoid membrane
每个光系统II核心复合体(CP43、CP47和D1、D2)外周,结合了主要捕光复合物LHC II三聚体,以及分子质量分别为29 kDa和26 kDa的次要捕光复合物CP29和CP26,CP29和CP26有助于光系统II蛋白复合体的蛋白质聚合和稳定[23]。由图2可知,第0小时,在pH 3.6、4.6条件下,菠菜和油菜光系统II的主要捕光复合物LHC II三聚体所在条带灰度显著降低,菠菜和油菜类囊体膜光系统I的核心蛋白Psa A/B只是轻微降低。说明相对于光系统I蛋白复合体,光系统II蛋白复合体对低pH值更敏感。随着放置时间的延长,Psa A和Psa B、LHC II以及CP29条带逐渐模糊,表明叶绿素蛋白复合体逐渐被破坏。
菠菜和油菜类囊体膜多肽组成及各组分比例存在较大差异,且菠菜的类囊体膜多肽组分种类较油菜丰富。重要的是,多肽组分及功能的保持对于维持色素蛋白复合物中叶绿素的稳定性、抑制其降解具有积极影响[15],因此低pH值对叶绿素蛋白复合体造成的破坏不利于叶绿素的保持。
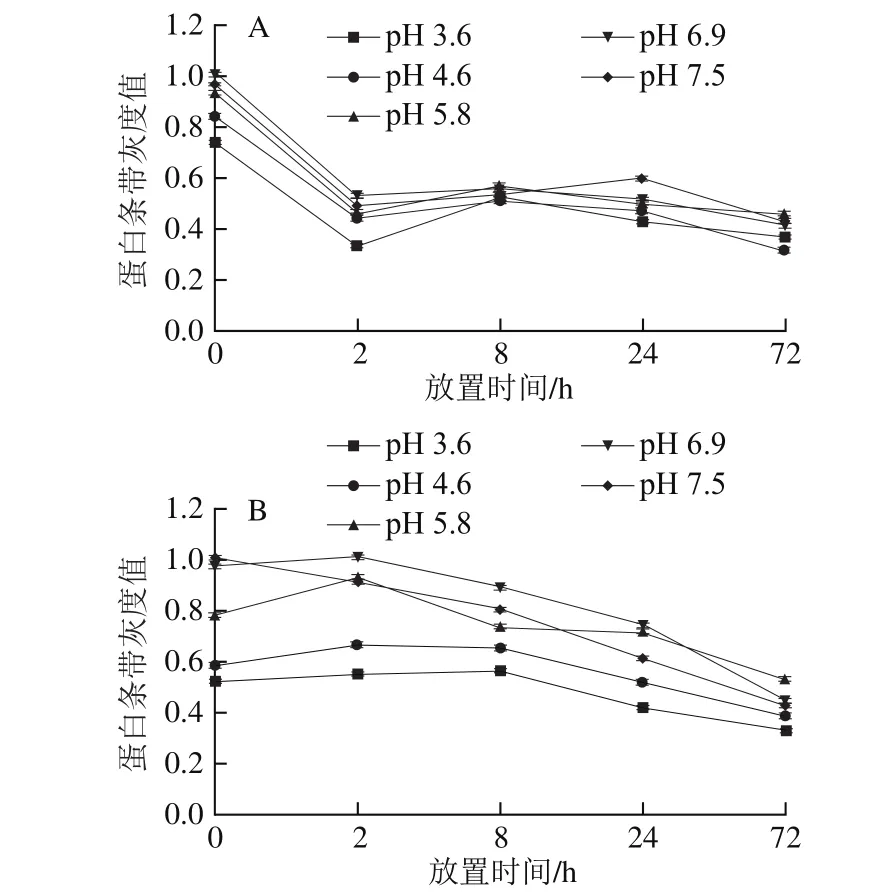
图3 pH值对类囊体膜蛋白条带灰度值的影响Fig. 3 Effects of pH on the gray level of protein bands in thylakoid membrane
如图3所示,分别设第0小时菠菜和油菜类囊体膜pH 6.9下的蛋白条带灰度值为1。在菠菜中,第0小时,低pH值(3.6、4.6)及高pH值(5.8、7.5)对应样品的灰度值分别为0.75~0.8和0.9~1;第72小时,pH 3.6、4.6对应样品的灰度值降至0.3~0.4,pH 5.8、6.9、7.5的蛋白条带灰度值降至0.5左右。而在油菜处理组中,第0小时,pH 3.6、4.6对应样品的灰度值约为0.5~0.6,pH 5.8、7.5的灰度值约为0.7~1;37 ℃放置72 h后,油菜类囊体膜不同pH值条件下样品的灰度值降低至0.4~0.6之间。
菠菜和油菜在较低pH值(3.6、4.6)下类囊体膜多肽组分显著降解,说明酸性环境(pH 3.6、4.6)能迅速破坏类囊体膜中的叶绿素蛋白复合体。由此推论,酸性环境不仅能破坏游离叶绿素,而且会破坏绿色蔬菜的叶绿素蛋白复合体,使大量叶绿素暴露在高浓度H+环境,进而使得叶绿素在H+的作用下,迅速脱镁降解。
2.3 pH值对热处理后类囊体膜可溶性蛋白含量的影响

图4 pH值对类囊体膜放置期间可溶性蛋白含量的影响Fig. 4 Effects of pH on soluble protein content in thylakoid membrane during storage
图4 为37 ℃放置期间,热处理后的菠菜和油菜类囊体膜可溶性蛋白随pH值和时间的变化,各处理组变化趋势基本一致。第0小时,pH 3.6、4.6条件下的菠菜和油菜类囊体膜可溶性蛋白含量显著降低(P<0.05)。可溶性蛋白参与类囊体膜的构建、叶绿素蛋白复合物的组成、类囊体膜结构和理化特性的保持以及色素的稳定。因此较高的可溶性蛋白含量能够维持类囊体膜的功能活性,进而维持较高的光反应活性[24-25]。pH值能够影响酸性氨基酸和碱性氨基酸的解离状态,影响次级键的稳定[26],由此推测,pH值较低时,可溶性蛋白空间结构遭到破坏,从而降低蛋白溶解度。不同pH值条件下类囊体膜可溶性蛋白的变化进一步表明低pH值在一定程度上降低了叶绿素蛋白复合物的稳定性,促使叶绿素降解。第72小时,菠菜类囊体膜可溶性蛋白含量显著上升(P<0.05),而放置期间,油菜可溶性蛋白含量变化不显著(P>0.05)。菠菜和油菜可溶性蛋白含量变化的不同,可能是由其植物学生理结构的差异导致的。叶绿素蛋白复合体结构不同,菠菜和油菜类囊体膜光系统I和光系统II的组成比例也可能存在较大差异,因此其对pH值的响应不同[27]。
2.4 pH值对热处理后类囊体膜吸收光谱的影响
图5为热烫后类囊体膜光吸收特性随pH值的变化。吸收峰强度的高低代表类囊体膜捕光能力大小,热处理后菠菜和油菜类囊体膜的吸收峰分别在441 nm和675 nm左右,这两个吸收峰主要对应于叶绿素a的吸收峰,而热处理后菠菜和油菜叶绿素b和类胡萝卜素对应的474 nm左右的吸收峰消失。

图5 pH值对类囊体膜吸收光谱特性的影响Fig. 5 Effects of pH on spectral absorption characteristics of thylakoid membrane
如图5所示,放置期间,不同pH值下类囊体膜各吸收峰强度均呈现下降趋势。在菠菜处理组中,在第0小时,pH 3.6、4.6条件下类囊体膜吸收峰强度下降显著,尤其在pH 3.6时,特征吸收峰消失;37 ℃放置72 h后,不同pH值下样品的特征吸收峰基本消失。在第0小时,油菜类囊体膜在pH 3.6、4.6条件下,样品蓝区的吸收峰变化明显;37 ℃放置72 h后,油菜类囊体膜在pH 3.6、4.6、5.8的特征吸收峰消失。
类囊体膜上的叶绿素以结合态的形式与膜上特殊的蛋白质相结合,当部分叶绿素从类囊体膜中游离出来,即由结合态叶绿素变成游离态叶绿素时,共轭双键被破坏,类囊体膜吸收光谱会由长波向短波方向移动,即发生蓝移[28-29]。由此推测,菠菜和油菜类囊体膜特征吸收峰的消失是由低pH值破坏类囊体结构造成的,进而破坏游离叶绿素,从而影响类囊体膜体系中叶绿素吸收光能的能力。同时,低pH值(3.6、4.6)对菠菜类囊体膜的破坏程度高于油菜类囊体膜,进一步说明菠菜类囊体膜对pH值的敏感性高于油菜类囊体膜。有研究表明,低pH值(5.5)会导致类囊体膜中光系统I和光系统II之间能量的重新分配[30]。本实验中油菜吸收峰的变化可能也与能量重新分配有关,但仍需进一步研究。
2.5 类囊体膜的荧光倒置显微镜成像

图6 不同pH值处理后类囊体膜倒置荧光显微镜图Fig. 6 IFM images of thylakoid membrane after pH offset processing
图6 为荧光倒置显微镜下呈现的类囊体膜叶绿素荧光分布,随pH值降低,类囊体膜叶绿素荧光分布由松散变聚集,荧光区域逐渐不规则化,且低pH值(3.6、4.6)条件下类囊体膜更易产生分层现象。由此证实,低pH值可改变类囊体膜的结构稳定性。当pH值由5.5降低到4.0时,类囊体会发生皱缩[31],这一结果与本实验结论较为一致。还可观察到,相同条件下,菠菜类囊体膜的荧光密度与油菜相比更高,叶绿素荧光亮斑更大,荧光强度更大,这与菠菜的基粒片层、叶绿素蛋白复合体及叶绿素含量均比油菜多有关。37 ℃处理72 h后,低pH值(3.6、4.6)的菠菜类囊体膜叶绿素荧光基本消失,而油菜对应组叶绿素荧光依然存在。因此,与油菜类囊体膜相比,菠菜类囊体膜对低pH值的敏感性更高。
3 结 论
与高pH值(5.8、6.9、7.5)相比,低pH值(3.6、4.6)条件下菠菜和油菜类囊体膜溶液-a*值显著降低,叶绿素蛋白复合体的多肽组分明显降解,可溶性蛋白含量显著降低,荧光分布发生聚集。由此说明,低pH值(3.6、4.6)能够破坏类囊体膜及叶绿素蛋白复合体的结构、功能稳定性,使更多叶绿素游离出来,从而加速叶绿素降解;相同pH值条件下,菠菜类囊体膜稳定性低于油菜类囊体膜;相对于光系统I叶绿素蛋白复合体,光系统II叶绿素蛋白复合体对低pH值更敏感。该研究对于加工过程中叶绿素的降解控制具有重要的理论意义。

