重组藻胆蛋白与高等植物类囊体膜之间能量传递的研究❋
尚孟慧,臧晓南,林娇娇,李 瑞,毕 莹,徐晓婷
(中国海洋大学海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003)
光合真核生物叶绿体中的类囊体膜是光合作用部位,其中含有一些色素-蛋白质复合物作为其结构的组成部分,如PSI和PSII。类囊体膜中的色素可分为三大类:叶绿素、类胡萝卜素和藻胆蛋白。在这三类中,叶绿素和类胡萝卜素存在于高等植物中,而藻胆蛋白仅存在于某些藻类中,例如蓝藻和红藻。高等植物类囊体膜上叶绿素,可以吸收在430~450 nm和640~660 nm的两段范围内的可见光,不能利用450~650 nm范围内的可见光[2]。而藻胆蛋白能够捕捉高等植物无法捕捉的540~650 nm区域内的可见光[2]。藻胆蛋白根据结构组分、藻胆色素的类别以及其吸收光能的特点,分成以下种类:藻红蛋白(PE,最大吸收光范围540~570 nm),藻蓝蛋白(PC,最大吸收光范围610~620 nm),藻红蓝蛋白(PEC,最大吸收光范围:560~600 nm),别藻蓝蛋白(APC,最大吸收光范围650~ 655 nm)。藻胆蛋白的吸收光谱恰好与叶绿素互补,使得藻类植物的光吸收范围遍布在几乎整个可见光区域。藻胆蛋白在藻胆体中的组合排列使得光合作用中进行能量传递的效率几乎接近100%[3]。
通常认为光能传递的一般途径为:藻红蛋白→藻蓝蛋白→别藻蓝蛋白→叶绿素a。已有研究证明高等植物类囊体膜与藻类藻胆体之间能够实现光能传递,仵小南[4]等通过实验证明了藻胆蛋白与菠菜类囊体混合孵育后,可以将吸收的光能传递给菠菜的光系统I。若与青菜类囊体混合孵育,藻红蛋白或藻蓝蛋白只有通过别藻蓝蛋白才能将吸收的光能传递给光系统Ⅱ,这与已有的各组分之间在进行光合作用时的能量传递规律是相同的。早在1992年Su等[5]就提出了藻胆体棒状复合物中的藻蓝蛋白吸收的光能可直接传递给光系统I中的叶绿素a。容寿榆等[6]通过测定藻胆体与菠菜光系统 Ⅱ 的混合溶液的光谱以及溶液的放氧活性,得到的结果表明它们可以进行能量传递。因此,天然藻胆蛋白可以与高等植物类囊体进行光能传递。若重组藻胆蛋白也能与类囊体进行光能传递,将为构建新型光合系统提供依据。
因此本文运用了基因工程方法重组表达藻红蛋白和藻蓝蛋白,与高等植物的类囊体膜混合孵育,验证重组藻胆蛋白是否可以实现与高等植物类囊体膜之间的光能传递,为研究藻胆蛋白与高等植物类囊体膜之间的光能传递规律提供新的元件,并为藻胆蛋白在构建新型光合系统中的应用提供实验依据。
1 材料与方法
1.1 实验材料与试剂
采用实验室前期构建的重组菌株E.coliHPBAEFUST和E.coliEBA-AB。重组菌株E.coliHPBAEFUST中的表达载体为pET24a-hox1(314)-pcyA(314)和pACYCDuet-ucpcBA-cpcEF-cpcU-cpcS-cpcT,包含的基因有节旋藻(Arthrospiraplatensis)的血红素加氧酶基因hox1和铁氧还蛋白氧化还原酶基因pcyA(用于合成藻蓝胆素),以及藻蓝蛋白α、β亚基基因(用于表达脱辅基藻蓝蛋白)以及色基裂合酶cpcEF、cpcU、cpcS和cpcT基因(用于催化脱辅基藻蓝蛋白与藻蓝胆素的结合)。重组菌株E.coliEBA-AB中表达载体为 pACYCDuet-peB-peA和pET24a-hox1-pebA-pebB,包含的基因有藻红蛋白 α 亚基和 β 亚基基因(用于表达脱辅基藻红蛋白),血红素加氧酶基因hox1以及铁氧还蛋白依赖性色素还原酶基因pebA和pebB(用于合成藻红胆素)。大肠杆菌(E.coliBL21)为空表达菌株。
1.2 重组藻蓝蛋白、藻红蛋白的诱导表达
菌种活化:将重组表达菌株E.coliHPBAEFUST、E.coliEBA-AB和空表达菌株E.coliBL21,37 ℃过夜培养,重组菌株添加抗生素硫酸卡那霉素和氯霉素。
扩大培养:按1∶100的比例转接,37 ℃扩大培养菌株至OD600≈0.6。
诱导表达:加入诱导剂IPTG(工作浓度是0.1 mmol/L),重组表达菌株E.coliHPBAEFUST于恒温培养箱中37 ℃、200 r/min振荡培养2 h,重组表达菌株E.coliEBA-AB为30 ℃、200 r/min振荡培养6 h。诱导完成后进行重组藻蓝蛋白、藻红蛋白的提取。空表达菌株E.coliBL21的细胞破碎液作为阴性对照。
1.3 菠菜类囊体、韭菜类囊体的提取
参照陈小全[7]、吴平[8]、张秀君[9]、高歧[10]等方法,将新鲜叶片洗净擦干,称取剪碎后的叶片60 g用液氮进行研磨,向研磨后的叶片粉末中加适量 4 ℃预冷的提取缓冲液进行提取。
1.4 吸收光谱检测
将提取的重组藻红蛋白、重组藻蓝蛋白稀释至相同浓度后分别与用0.01 mol/L 的PBS溶液重悬的菠菜类囊体膜溶液混合避光孵育,用Nanodrop 2000分别进行全波长吸收光谱扫描。以空表达菌株E.coliBL21的细胞破碎液和菠菜类囊体的混合溶液作为对照。以不同的时间(0、5、10、15、20、25和30 min)进行混合孵育,观察吸收光谱峰面积图,确定最适孵育时间;0~10 μL内以每1 μL作为梯度增加样本中重组藻胆蛋白的浓度,观察吸收光谱的变化,确定藻胆蛋白浓度与吸收光谱的关系。并将纯化的重组藻红蛋白和重组藻蓝蛋白分别按照1∶1、1∶2、2∶1的浓度比,加入到类囊体膜重悬溶液中,混合均匀,按照最佳混合孵育时间进行孵育,然后分别进行全吸收光谱扫描,确定重组藻红蛋白与藻蓝蛋白比例与光能吸收的关系。
1.5 荧光光谱检测
将1.4所述的重组藻红蛋白、藻蓝蛋白与类囊体膜混合孵育后,使用HITACHIFI-4600型荧光光谱仪进行荧光发射光谱检测,用430、420和580 nm(分别为叶绿素a、藻红蛋白、藻蓝蛋白的特征荧光峰值处的激发波长)激发波长对样品进行荧光激发。荧光发射光谱扫描速度1 200 nm/min,狭缝宽度5.0 nm。
2 结果
2.1 重组藻胆蛋白和类囊体的提取
重组表达后的藻红蛋白、藻蓝蛋白、BL21蛋白用Nanodrop 2000测得的蛋白质浓度分别为:重组藻红蛋白88.27 mg/mL,重组藻蓝蛋白92.23 mg/mL,空表达菌株E.coliBL21蛋白浓度为71.15 mg/mL,用PBS将三种蛋白溶液稀释至相同浓度50 mg/mL。
提取的类囊体溶液浓度分别为:菠菜:0.98 mg/L,韭菜:2.09 mg/L。
2.2 重组藻胆蛋白与类囊体膜混合孵育吸收光谱检测结果
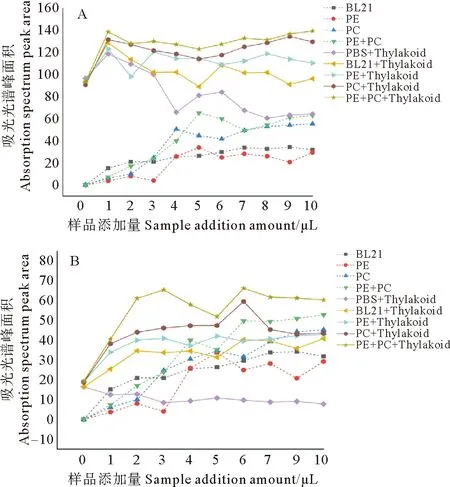
2.2.1 时间梯度对吸收光谱的影响 以孵育时间为横坐标,以吸收光谱峰面积为纵坐标,得到图1。从图中可以看出,随孵育时间的增加,混合溶液的吸光光谱峰面积呈先增加后略下降的趋势。
根据图1A,藻红蛋白和藻蓝蛋白的混合溶液与菠菜类囊体溶液混合后,孵育至15 min吸收峰面积达最大值;而重组藻红蛋白、重组藻蓝蛋白分别与菠菜类囊体的混合溶液在孵育到10 min时吸收峰面积达最大值。因为藻胆蛋白与类囊体膜结合才能进行光能传递,混合孵育10~15 min可能有利于藻胆蛋白与类囊体膜比较好的结合,从而有利于能量的吸收和传递,故将15 min作为检测吸收光谱时藻红和藻蓝蛋白混合溶液与类囊体的最适孵育时间,将10 min作为检测吸收光谱时重组藻红蛋白、重组藻蓝蛋白分别与类囊体混合孵育的最适时间。
同样,在韭菜类囊体溶液与藻红、藻蓝蛋白混合的结果中,由图 1B得出,10 min可以作为检测吸收光谱时重组藻蓝蛋白以及重组藻红和藻蓝蛋白混合溶液与韭菜类囊体混合的最适孵育时间,20 min可以作为检测吸收光谱时重组藻红蛋白与韭菜类囊体混合孵育的最适时间。

(PE: 藻红蛋白Phycoerythrin; PC: 藻蓝蛋白Phycocyanin. A: 菠菜类囊体与重组藻胆蛋白混合孵育;B: 韭菜类囊体与重组藻胆蛋白混合孵育。A: Thylakoid of Spinacia oleracea; B: Thylakoid of Allium tuberosum.)
2.2.2 浓度梯度对吸收光谱的影响 以重组藻胆蛋白的添加量作为横坐标,以吸收光谱峰面积作为纵坐标,重组藻胆蛋白浓度的增加对光能吸收的影响变化如图2所示。
从图2中可以看出,与添加藻胆蛋白的组相比,添加PBS的菠菜类囊体溶液、韭菜类囊体溶液的吸收光谱峰面积值最低,而且随着PBS溶液的加入,吸收光谱峰面积值进一步降低。当加入藻胆蛋白后,混合溶液的吸收光谱峰面积总体呈上升趋势,而且高于对应浓度下藻胆蛋白与类囊体溶液吸收光谱值的加和,差异显著(A:P<0.01,B:P<0.05)。这说明重组藻胆蛋白可以提高菠菜类囊体、韭菜类囊体的吸收光谱峰面积,这种提高并不只是二者光谱的简单叠加,而是可能来自藻胆蛋白与类囊体膜的相互作用,重组藻胆蛋白的加入可以增强菠菜类囊体、韭菜类囊体的光吸收。
分别与菠菜类囊体、韭菜类囊体混合孵育的体系之间的相互比较可以看出重组藻红和藻蓝蛋白的混合溶液的吸收光谱峰面积处于最高的水平,这说明重组藻红蛋白和藻蓝蛋白的混合溶液对于增强菠菜类囊体、韭菜类囊体的光吸收的作用是最明显的。
(PE: 藻红蛋白Phycoerythrin; PC: 藻蓝蛋白Phycocyanin; Thylakoid: 类囊体. A: 菠菜类囊体与重组藻胆蛋白混合孵育;B: 韭菜类囊体与重组藻胆蛋白混合孵育。A: Thylakoid of Spinacia oleracea; B: Thylakoid of Allium tuberosum.)
2.2.3 藻红蛋白与藻蓝蛋白浓度比例对吸收光谱的影响 吸收光谱检测结果如图3所示。以550、620和663 nm(分别为藻红蛋白、藻蓝蛋白、叶绿素a的特征吸收峰值处的波长)作为横坐标,以对应的吸光度作为纵坐标,得到图3A、图3C。图A、C表明重组藻胆蛋白的加入可能与类囊体膜有相互作用从而使各吸收峰处的光吸收值得到提高。藻红∶藻蓝为1∶2时对吸光度的影响略大,差异不显著(P>0.05)。

(PE: 藻红蛋白Phycoerythrin; PC: 藻蓝蛋白Phycocyanin. A、C: 特征吸收峰的吸光度值;B、D: 为吸光光谱峰面积;A、B: 菠菜类囊体与重组藻胆蛋白混合孵育;C、D: 韭菜类囊体与重组藻胆蛋白混合孵育。A/C: Absorbance value of the characteristic absorption peak; B/D: Absorbance peak area; A/B: Thylakoid of Spinacia oleracea; Fig. C/D: Thylakoid of Allium tuberosum.)
以藻红和藻蓝蛋白的浓度比例作为横坐标,以吸收光谱峰面积作为纵坐标得到图3B、D。从图3B、D可以看出在提高菠菜、韭菜类囊体光吸收方面当藻红∶藻蓝为1∶2时对于提高类囊体的光吸收作用最显著(P<0.05)。
2.3 重组藻胆蛋白与类囊体膜混合孵育的荧光光谱检测
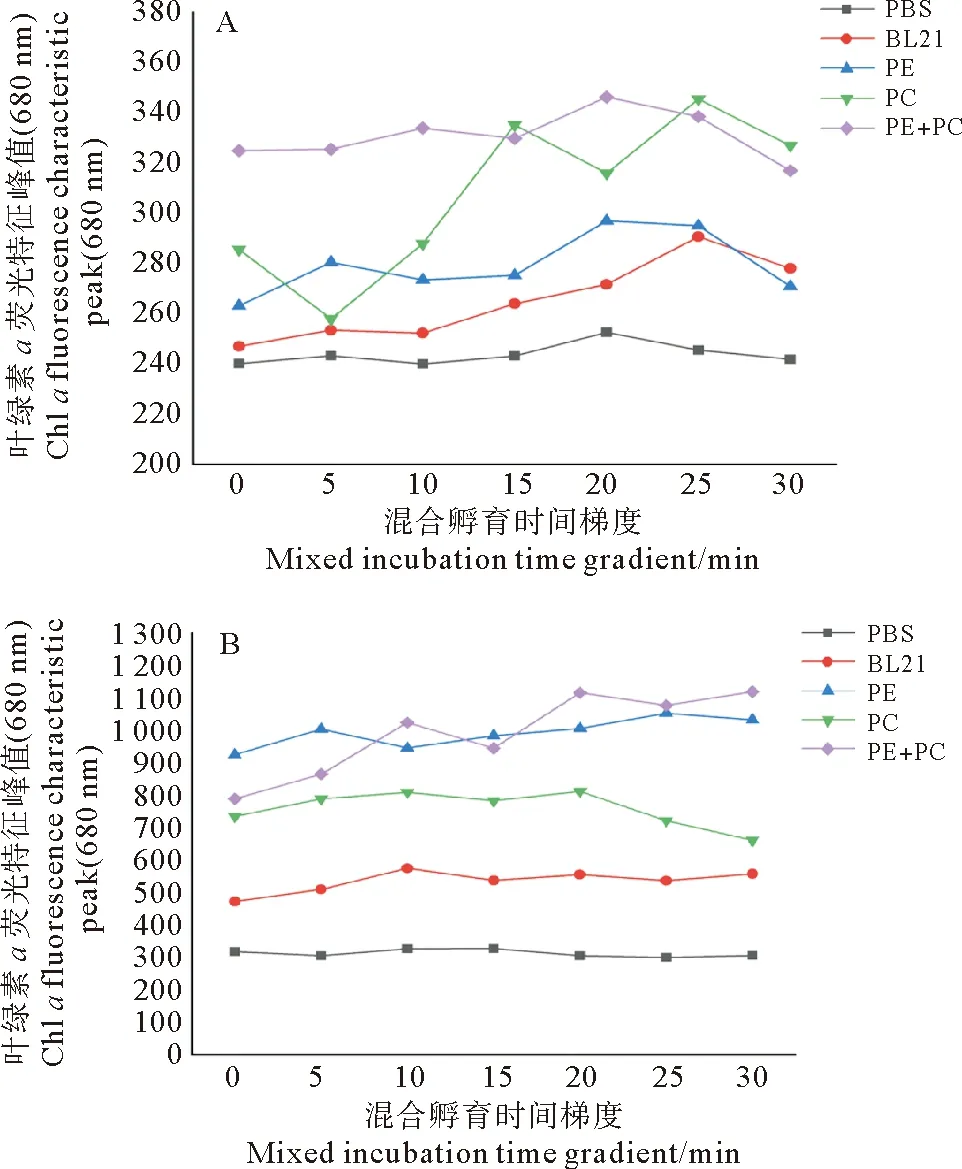
2.3.1 时间梯度对荧光光谱的影响 以混合孵育时间为横坐标,以叶绿素a特征荧光发射峰680 nm处的峰值为纵坐标,荧光检测结果如图4所示,随孵育时间的增加藻胆蛋白传递给菠菜类囊体的光能增加。
菠菜类囊体同重组藻红和藻蓝蛋白的混合溶液、重组藻红蛋白溶液在孵育20 min后荧光值有所下降,而重组藻蓝蛋白在孵育15 min后荧光值有所下降(见图4A)。所以将20 min作为重组藻红和藻蓝蛋白混合溶液、重组藻红蛋白溶液与菠菜类囊体混合后进行荧光检测的最适孵育时间,将15 min作为重组藻蓝蛋白与菠菜类囊体混合溶液进行荧光检测的最适孵育时间。
重组藻蓝蛋白溶液、重组藻红蛋白、重组藻红和藻蓝蛋白混合溶液与韭菜类囊体混合后,荧光值随孵育一定时间的增加而增加,在孵育至20 min后荧光值有所下降,而重组藻红蛋白在孵育25 min后荧光值有所下降(见图4B),所以将20 min作为重组藻蓝蛋白溶液、重组藻红和藻蓝蛋白混合溶液与韭菜类囊体混合后进行荧光检测的最适孵育时间,将25 min作为重组藻红蛋白与韭菜类囊体混合溶液进行荧光检测的最适孵育时间。
(PE: 藻红蛋白Phycoerythrin; PC: 藻蓝蛋白Phycocyanin. 激发波长为430 nm 。A: 菠菜类囊体与重组藻胆蛋白混合孵育;B: 韭菜类囊体与重组藻胆蛋白混合孵育。Fluorescence emission at 430 nm. A: Thylakoid of Spinacia oleracea; B: Thylakoid of Allium tuberosum.)
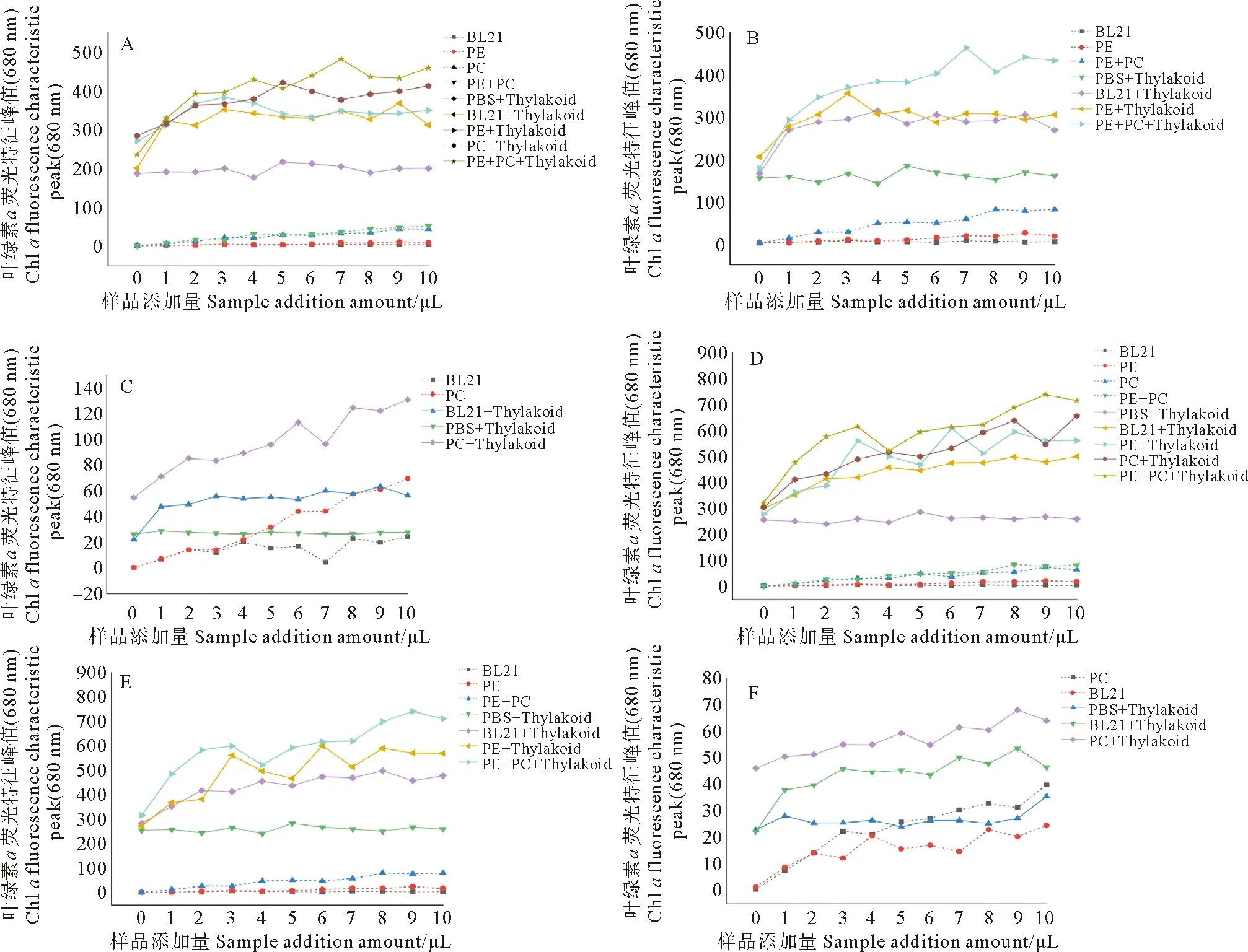
2.3.2 浓度梯度对荧光光谱的影响 以藻胆蛋白添加量为横坐标,以叶绿素a荧光特征发射峰680 nm下的荧光峰值为纵坐标,重组藻胆蛋白对类囊体荧光强度的影响变化如图5所示。
图5A、D为在叶绿素a的特征荧光激发波长430 nm的激发下,得到的叶绿素a特征荧光发射峰680 nm处的荧光强度。从图中可以看出类囊体溶液中添加PBS对其荧光峰值没有显著的影响;添加空白大肠杆菌E.coliBL21的细胞破碎液对荧光峰值也有的提高作用,但不如藻胆蛋白显著;当加入重组藻胆蛋白时,其叶绿素a的荧光特征峰峰值呈上升趋势,表明荧光峰值的提高是重组藻胆蛋白的加入引起的。其中添加重组藻蓝蛋白组的荧光峰值显著高于相同浓度的藻蓝蛋白的荧光峰值与类囊体荧光峰值的加和(图5A:P<0.05, 图5D:P<0.01),说明重组藻蓝蛋白受激发后发射的荧光可以进一步激发类囊体膜上的叶绿素a,从而使荧光值进一步提高。但是添加重组藻红蛋白组,荧光峰值与相同浓度的藻红蛋白的荧光峰值和类囊体荧光峰值的加和差异不显著(P>0.05),表明加入藻红蛋白后荧光峰值的提高可能是荧光峰值的叠加,而不是光能传递引起的。另外通过对与菠菜类囊体混合孵育的不同重组藻胆蛋白的曲线的对比,可以发现重组藻红和藻蓝蛋白的混合溶液对荧光峰值的提高作用最强(P<0.01),差异极显著,表明在重组藻红和藻蓝蛋白同时存在时,会有光能的逐级激发和传递,从而使得荧光峰显著提升。
图5B、E为在重组藻红蛋白的荧光特征峰的激发波长420 nm的激发下,得到的在叶绿素a特征荧光峰680 nm处的荧光强度。从图中可以观察到,随着重组藻红和藻蓝蛋白混合溶液的加入,类囊体溶液的叶绿素a荧光特征峰值处的荧光强度在不断升高;与藻红和藻蓝蛋白混合溶液的荧光强度与类囊体荧光强度加和相比,有显著提升(P<0.05),但是若只添加藻红蛋白到类囊体的混合溶液的荧光发射峰值,与相同浓度下藻红蛋白的荧光峰值和类囊体荧光峰值的加和基本相当,差异不显著(P>0.05)。说明420 nm的光可以激发藻红蛋白,藻红蛋白的荧光发射光能进一步激发藻蓝蛋白,藻蓝蛋白受激发后的光能可以再激发叶绿素a,从而使得荧光峰显著提升;但是若体系中缺乏藻蓝蛋白,受激发的藻红蛋白发射的荧光并不能传递给叶绿素a,而只是与叶绿素a的荧光发射峰值叠加。因此表明单独的藻红蛋白并不能将光能传递给类囊体膜上的叶绿素a,而体系中添加藻蓝蛋白后才可以。
(PE: 藻红蛋白Phycoerythrin; PC: 藻蓝蛋白Phycocyanin; Thylakoid: 类囊体. A、B、C: 菠菜类囊体;D、E、F: 韭菜类囊体;A、D: 激发波长430 nm; B、E: 激发波长420 nm; C、F: 激发波长580 nm. A/B/C: Thylakoid of Spinacia oleracea; D/E/F: Thylakoid of Allium tuberosum A/D: Fluorescence emission at 430 nm; B/E: Fluorescence emission at 420 nm; C/F: Fluorescence emission at 580 nm.)
图5C、F为在藻蓝蛋白的荧光特征峰的激发波长580 nm的激发下,得到的在叶绿素a特征荧光峰处的荧光强度。从图中可以看出与叶绿素a混合孵育的重组藻蓝蛋白溶液测得的荧光强度远大于未与类囊体混合孵育的藻蓝蛋白,而且显著高于相同浓度的藻蓝蛋白的荧光峰值与类囊体荧光峰值的加和(C∶P<0.01, F∶P<0.05),这说明重组藻蓝蛋白受到580 nm光激发后,除了自身在680 nm发射一定的荧光,引起荧光值提升外,重组藻蓝蛋白也可以将光能传递给类囊体膜,从而引起叶绿素a荧光强度的显著提升。
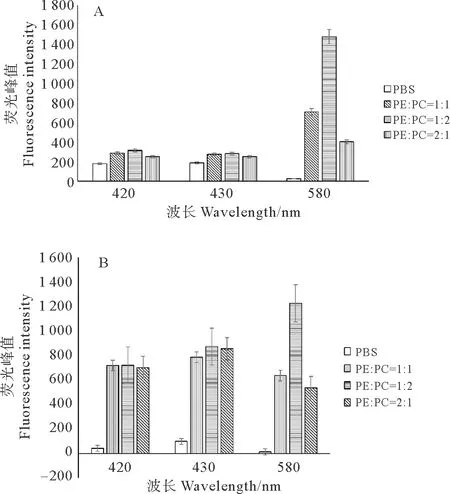
2.3.3 藻红蛋白与藻蓝蛋白浓度比例对荧光光谱的影响 以420、580、430 nm(分别为重组藻红蛋白、重组藻蓝蛋白、叶绿素a的特征荧光峰值处的激发波长)作为横坐标,以对应的荧光特征发射峰680 nm处的荧光强度作为纵坐标,荧光检测结果如图6所示。从图可以看出不管是菠菜类囊体还是韭菜类囊体,都表现出在藻蓝蛋白特征激发波长580 nm激发条件下,藻红∶藻蓝为1∶2时对于荧光强度的提升最大,差异极显著(P<0.01)。但在藻红蛋白和叶绿素a的特征激发波长下(分别为420和430 nm),藻红∶藻蓝为1∶2时对于荧光强度的提升较大,但是差异并不显著。
3 讨论
在蓝藻和红藻中,藻胆体与类囊体膜相连,将捕获的光能以接近100%的效率传递到类囊体进行光合作用。藻胆体能够捕捉高等植物无法捕捉的540~650 nm区域内的可见光,若利用藻胆蛋白来拓宽高等植物的吸收光谱,将有可能捕获更多的光能促进植物的光合作用。为此藻胆蛋白与高等植物类囊体膜间能否有效进行光能传递成为这一设想得以实现的前提。
人们依据藻胆体内部及其与自身类囊体膜之间的能量传递机制,探索了天然藻胆蛋白或藻胆体与高等植物类囊体膜之间的能量传递情况。容寿榆等[6]通过测定藻胆体与菠菜光系统Ⅱ的混合溶液的光谱以及溶液的放氧活性,得到的结果表明它们可以进行能量传递。李文军等[11]的研究结果证实,与天然别藻蓝蛋白三聚体相比较,基因重组别藻蓝蛋白三聚体有正确的能量传递功能。为了验证重组藻胆蛋白是否也具有与类囊体膜光能传递的作用,本文纯化了具有光学活性的重组藻红蛋白和重组藻蓝蛋白,分别与高等植物菠菜和韭菜类囊体混合孵育,研究他们的光能传递规律,为在高等植物中建立新型的光合系统提供理论基础。
(PE: 藻红蛋白Phycoerythrin; PC: 藻蓝蛋白Phycocyanin. A: 菠菜类囊体;B: 韭菜类囊体。A: Thylakoid of Spinacia oleracea; B: Thylakoid of Allium tuberosum.)
本文将重组藻红蛋白、重组藻蓝蛋白分别与菠菜、韭菜类囊体溶液进行混合孵育。设计了时间梯度,确定了本研究的最适孵育时间,然后检测混合溶液的吸收光谱和荧光光谱。通过对结果的分析可以发现,在加入重组藻胆蛋白后,类囊体溶液的特征荧光峰值和吸收光谱峰面积都有所提高,而且随着重组藻胆蛋白浓度的增加峰值随之升高,这与仵小南等[4]通过实验证明藻胆蛋白与菠菜类囊体混育后,可以将吸收的光能传递给菠菜的光系统I的结果一致。其中对于吸收光谱,与菠菜类囊体(或韭菜类囊体)膜溶液混合体系的吸收光谱峰面积显著高于对应浓度下藻胆蛋白与类囊体溶液吸收光谱值的加和(P<0.01)。说明重组藻胆蛋白与天然藻胆蛋白一样可以提高植物类囊体的光吸收能力。这种提高并不只是二者光谱的简单叠加,而且可能来自藻胆蛋白与类囊体膜的相互作用。在对荧光光谱的检测结果中,我们发现在420、430、580 nm的光激发下,重组藻蓝蛋白都能将光能传递给类囊体中的叶绿素a,使得叶绿素a的荧光发射峰值显著提升。重组藻红蛋白与天然藻红蛋白一样,不能与菠菜或韭菜的类囊体膜发生光能传递,但是当体系中添加重组藻蓝蛋白的时候就可以,而且当藻红蛋白和藻蓝蛋白的比例是1∶2时,光能传递效率最高。
由于天然藻红蛋白的结构为α、β和γ三个亚基以单聚体或多聚体的形式存在,而在本研究中,重组菌株只含有藻红蛋白的α和β亚基,不能形成多聚体,另外藻红蛋白的重组菌株不含有色基裂合酶,不能催化脱辅基藻红蛋白和藻红胆素结合形成正确构象,这些原因可能造成了重组藻红蛋白与天然藻红蛋白荧光发射的差异[12]。
农作物生产是人类生存的基础,农作物栽培中由于密集种植、叶片遮挡带来的光能不足直接影响其生长率的提高,因此提高光能吸收率,加快农作物生长率成为我们要研究的首要问题。本文选用了一种单子叶植物、一种双子叶植物,其中菠菜属于被子植物门、双子叶植物纲。韭菜属于种子植物门、被子植物亚门、单子叶植物纲。通过对结果的分析可以发现菠菜类囊体溶液和韭菜类囊体溶液与重组藻胆蛋白混合孵育后的检测结果有细微的不同,但大致上的结果都是相同的,都可以接收到重组藻胆蛋白传递的光能,并被提高了光吸收能力,表明重组藻胆蛋白可以与高等植物类囊体膜进行能量传递,这为构建新型的光合系统,提高高等植物的光吸收范围,进而提高产量提供了可能。

