高铁酸钾氧化降解氧氟沙星的机理
李亚男,冯 卓,王嘉琪,郭 凯,张国凯
高铁酸钾氧化降解氧氟沙星的机理
李亚男1*,冯 卓1,王嘉琪1,郭 凯1,张国凯2
(1.太原理工大学环境科学与工程学院,山西 晋中 030600;2.中海国亚环保工程有限公司,山西 太原 030012)
以喹诺酮类抗生素氧氟沙星(OFL)为目标物质,研究高铁酸钾(Fe(VI))对OFL的去除及氧化机理.采用高效液相色谱仪(HPLC)、液相色谱-质谱联用仪(UPLC-QTOF-MS)等方法,考察Fe(VI)投加量、pH值、温度和共存物质等因素对OFL降解效果的影响,分析反应动力学,计算过程中Fe(VI)的贡献率,识别Fe(VI)氧化OFL的产物并推测主要反应路径.结果表明:当Fe(VI)与OFL的物质的量比为40:1、pH值为8、温度为25°C时,反应30min后OFL的降解率达到92.38%,前5min快速反应阶段,OFL的降解符合伪二级反应动力学.反应过程的活化能为28.17kJ/mol.反应中Fe(VI) 及中间高价态铁的贡献率为70.34%,且腐殖酸会显著抑制该反应.通过对氧化产物进行分析提出了Fe(VI)氧化OFL的3条主要路径.OFL经脱羧、去甲基、脱羰、羟基化等反应,实现其分子上喹诺酮取代基、哌嗪基环及恶嗪基环的开环.
高铁酸钾;氧氟沙星;影响因素;共存物质;中间产物;降解路径
氧氟沙星(OFL)是一种第二代氟喹诺酮类抗生素(FQs),具有抗菌谱广、易于吸收的特点,是人类和动物传染病治疗中应用最广泛的抗生素之一[1],也是自然水体和废水中最常见的抗生素[2].OFL在地表水和废水中检测到的浓度在ng/L至mg/L之间[3-4],在地下水和饮用水中也能检测到一定浓度[1,5].自然水体中残留的OFL不仅会污染环境,也会导致水环境中细菌的耐药性不断增加,对人类健康和生态系统产生不利影响[6].因此,需寻求高效去除水中OFL的方法,为OFL在水体中的污染控制提供理论与技术支持.
研究表明,高级氧化或化学氧化法对含药物废水的处理效果较好.如Fenton试剂、高锰酸盐、过硫酸盐和臭氧等氧化剂因其高反应性而具有独特的氧化去除药物污染物的能力[7-10].高铁酸盐(Fe(VI))作为一种绿色氧化剂,在酸性条件下的氧化还原电位为2.20V,高于大部分常见的氧化剂,在碱性条件下的氧化还原电位为0.72V,在较大的pH值范围内都具有较强的氧化性能[11],因此Fe(VI)可以在处理药物污染物时起到良好的效果[12-13],并且Fe(VI)在使用后的还原产物为具有絮凝作用的Fe(III),也可对目标物的去除起到一定作用[14].
Fe(VI)可氧化降解水中部分FQs,如Fe(VI)能去除水体中微量浓度的环丙沙星、恩诺沙星和诺氟沙星,去除率达到85%以上[15-17]. Fe(VI)与FQs的反应主要是Fe(VI)通过亲电反应对喹诺酮环及含氮环进行攻击,随后发生脱羧、去甲基、脱羰、羟基化反应最终实现对FQs的氧化降解[15,18]. OFL由于含有恶嗪取代基,且哌嗪取代基的结构不同,分子结构更为复杂.但是,有关Fe(VI)氧化OFL的影响因素及反应机理的研究尚未报道.
基于此,开展高铁酸钾去除水中OFL的效能及机理研究,考察Fe(VI)投加量、pH值、温度和共存物质等因素对OFL去除效果的影响,分析反应过程中的产物,推测降解路径,明晰Fe(VI)氧化OFL的反应机制,完善Fe(VI)氧化氟喹诺酮类有机物理论,以期为含痕量抗生素废水的处理提供参考.
1 材料和方法
1.1 试剂与仪器
OFL(分析纯,纯度>98%)、高铁酸钾(分析纯,纯度³95%)、叔丁醇(分析纯,纯度³99.0%),均购自上海麦克林生化科技有限公司;乙腈(HPLC级),购自赛默飞世尔科技有限公司;腐殖酸(黄腐殖酸FA³90%),购自阿拉丁试剂有限公司;甲酸、盐酸羟胺、磷酸氢二钠、磷酸二氢钠、硼酸、硼砂、氯化钠、碳酸氢钠、硝酸钠、硫酸钠、硫酸铜、硫酸镁、硫酸钙及无水硫酸钠均为分析纯,购自太原津昌华科贸有限公司.实验中所有溶液均由超纯水配置.
恒温磁力加热搅拌器; G711A型高效液相色谱仪HPLC ,美国安捷伦科技有限公司;pHS-3C型pH计,上海雷磁仪器厂; 1290型超高效液相色谱仪UPLC,美国安捷伦科技有限公司;6550型高分辨质谱仪QTOF,美国安捷伦科技有限公司.
1.2 实验方法
OFL储备液:称取100mg OFL置于250mL烧杯中,加入超纯水后置于超声波清洗机中在100kHz超声频率下超声15min至完全溶解,移至1L容量瓶中定容,配置得到100mg/L的标准储备液,低温避光保存,使用时稀释至所需浓度.
Fe(VI)储备液:取0.1096g K2FeO4溶于硼砂-硼酸缓冲溶液(pH=8)中,继续用缓冲溶液定容至20mL,得到K2FeO4储备液,现配现用.
Fe(VI)氧化OFL实验:取5mL储备液,用缓冲溶液定容至100mL,得到5mg/L反应液,移至200mL烧杯,将一定量的Fe(VI)储备液加入反应液中,在一定温度下搅拌并开始计时,反应过程中在不同时间点取样3mL上清液移至预先加入过量盐酸羟胺终止剂的试管中,用0.22μm有机相滤膜过滤后,测定OFL浓度.
羟基自由基HO·的掩蔽实验:在进行Fe(VI)氧化OFL实验前在反应液中加入过量的叔丁醇进行HO·掩蔽,过程中测定OFL浓度.
共存物质影响实验:在Fe(VI)氧化OFL实验中加入一定浓度的常见阴、阳离子(Cl-、NO3-、SO42-、HCO3-、Mg2+、Ca2+和Cu2+)、腐殖酸进行实验,检测其对Fe(VI)氧化降解OFL的影响情况.
UPLC-QTOF-MS样品预处理:实验过程中取样并终止反应后,加入氯化钠至饱和,再加入15mL甲醇,震荡20min后将混合液移至分液漏斗中静置分层,收集有机层.进行2次萃取操作后向所得有机相中加入过量无水硫酸钠吸干水分,使用旋转蒸发器将所得样品浓缩至2mL,进行产物检测.
1.3 分析方法
1.3.1 动力学分析 OFL的降解速率采用伪二级反应动力学描述,如式(1)所示:
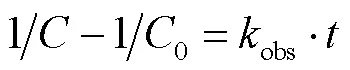
式中:为任意时刻OFL剩余浓度,mg/L;0为OFL初始浓度,mg/L;obs为OFL的降解反应速率常数,L/(mg·min);为反应时间,min.
1.3.2 活化能计算 Fe(VI)氧化OFL的活化能根据阿伦尼乌斯公式进行计算,如式(2)所示:

式中:为温度,K;a为表观活化能,J/mol;为表观指前因子,单位与obs一致,为摩尔气体常数,8.314J/(mol·K).
1.3.3 测试方法 OFL浓度测定:利用HPLC进行测定,色谱柱为InfinityLab Poroshell 120,流动相为乙腈:甲酸水(体积分数0.1%)=20:80(),流量0.8mL/min,进样量为50μL,检测波长为288nm.
LC-QTOF-MS检测:OFL氧化产物测定通过超高效液相色谱-串联高分辨质谱仪(UPLC-QTOF- MS)进行.色谱柱为waters BEH C18(2.1mm× 50mm×1.7μm),流动相由A(0.1%甲酸水)和B(乙腈)组成.梯度洗脱程序见表1.流速0.3mL/min,进样量5μL,在ESI+模式下进行质谱扫描,扫描范围为20~ 500/,脱溶剂气体流速12L/min,脱溶剂温度350°C.

表1 梯度洗脱程序
所有实验数据均经过3次平行实验测定得到,数据分析及曲线图、柱状图绘制均采用OriginPro 8.0软件,降解路径推测图使用Kingdraw绘制.
2 结果与讨论
2.1 Fe(VI)降解OFL的影响因素
2.1.1 Fe(VI)投加量对OFL去除效果的影响 由图1a可知,Fe(VI)氧化OFL的反应主要发生在前5min且OFL的降解效果明显,随着反应的进行,OFL的去除率趋于平缓.当(K2FeO4):(OFL)为10:1,20:1,30:1,40:1,50:1时,30min内OFL的去除率分别为30.76%,53.10%,74.18%,92.38%,94.98%.可见,OFL的去除率随着Fe(VI)投加量的增大而显著提高.随着Fe(VI)投加量的增大,Fe(VI)与OFL分子发生反应的概率相应增加,因此OFL的去除率逐渐增大.当Fe(VI)的投加量从40:1增加至50:1时,OFL的去除率只增加了2.60%,这可能是因为过量的Fe(VI)在水中的自分解反应加剧[19],导致其在反应液中的有效浓度低于理论浓度.结合最终去除效果及经济成本因素,本实验选用的投加量为(K2FeO4):(OFL)=40:1.该投加量与Fe(VI)氧化氯霉素的最佳投加量相同[20].
不同Fe(VI)投加量下的反应动力学参数见表2,结合图1b可以看出,在前5min快速反应阶段,1/- 1/0与存在显著的线性关系,说明OFL的降解速率符合伪二级动力学模型,而Fe(VI)氧化许多有机物时的反应均符合二级动力学模型[21].

0=5mg/L、pH=8、温度25°C

表2 不同Fe(VI)投加量下的动力学参数
2.1.2 pH值对OFL去除效果的影响 由图2a可见,反应30min内,pH值从5上升至7时,OFL的最大去除率从45.36%降低至39.02%,在pH=8时去除率达到最大值,为92.38%,pH值上升至9时,去除率却降低至68.98%,可见pH=8时Fe(VI)对OFL的氧化效果最佳.
不同pH值下的反应动力学参数见表3,结合图2b可知,pH值为5时反应速率常数略大于pH值为6和7时,这是因为Fe(VI)在酸性环境下具有较高的质子化程度,大部分以HFeO4-和H2FeO4的形式存在,氧化还原电位较高,因此Fe(VI)能更快地与目标物发生反应[22].但酸性环境在促进反应快速发生的同时也会削弱Fe(VI)自身的稳定性,促使Fe(VI)自分解反应的进行[23],导致部分Fe(VI)在与OFL发生反应前就被氧化为Fe(III)和O2,而O2在溶液中的氧化能力不足以降解OFL,因此OFL的去除率变低.

0=5mg/L、(K2FeO4):(OFL)=40:1、温度25°C
而在碱性条件下,Fe(VI)的自分解反应变慢,实际参与氧化OFL的有效浓度大.且在该环境下,溶液pH值大于OFL的酸解离常数(pa2=7.90~8.22),OFL分子上的羧基官能团会发生去质子化反应,使OFL分子大部分带负电[24-25].而Fe(VI)氧化反应具有选择性[26],与含富电子基团的物质有较高的反应速率[27].因此,在碱性条件下,Fe(VI)更易与OFL分子发生化学反应,且可弥补该条件下Fe(VI)氧化能力弱的缺点,最终提高整体去除率.相反,在酸性条件下,溶液pH值小于OFL的酸解离常数(pa1=5.70~6.05),OFL分子上哌嗪基环上的氨基官能团带一个正电荷,使OFL分子大部分带正电,不利于其与Fe(VI)发生反应[24-25].

表3 不同pH值下的反应动力学参数

0=5mg/L、(K2FeO4):(OFL)=40:1、pH=8
可见,pH值对OFL去除的影响要综合考虑Fe(VI)的氧化能力、稳定性及OFL的存在形态等,酸性环境可以提高Fe(VI)的氧化能力,但OFL分子大部分带正电,而碱性环境可以维持Fe(VI)的有效浓度,且OFL分子大部分带负电. Zhou等[15]在研究Fe(VI)氧化环丙沙星时也发现在pH值为8,9时目标物质的去除率均能达到90%以上.鉴于Fe(VI)自身的稳定性及其发生氧化反应的选择性,反应的最佳pH值为8.
2.1.3 温度对OFL去除效果的影响 由图3a可知,当反应温度从15°C,升高至45°C,时,OFL的去除率逐渐增加,但增加的幅度都不大,降解率分别为90.36%,92.38%,93.16%和94.08%.
不同温度下的反应动力学参数见表4,结合图3b可知,温度的升高加快了整体反应速率,反应速率常数obs从0.205L/(mg·min)升至0.571L/(mg·min).这可能是因为升温时分子运动速率增大,Fe(VI)与OFL分子的有效碰撞频率增加.但升温的同时也会降低Fe(VI)自身的稳定性,使得参与氧化OFL的Fe(VI)的有效浓度降低,因此温度升高没有显著提升OFL的去除率.
对不同温度下的obs与温度进行拟合,发现obs与的关系符合阿伦尼乌斯公式,ln(obs)与1/具有良好的线性关系(2=0.95409),反应活化能a=28.17kJ/ mol,说明反应极易发生,且反应速率较快.
其设计思路为分别将多种模式的中频结构都提前设计好,采用模式选择的方式来完成各种通信模式的切换,实现兼容多种通信模式信号功能。并行多模数字中频结构的实现比较容易,只需要将各种单模的中频模块类比复制设计即可,通过模式选择模块实现各种模式的选择切换。但是该方案会牺牲很多硬件资源,对于资源有限的FPGA而言并不是一种性价比高的设计。

表4 不同温度下的反应动力学参数
2.2 HO·掩蔽实验
Fe(VI)氧化降解有机物主要有2种途径:Fe(VI)直接氧化和反应过程中生成的新自由基HO·间接氧化[28](式3和式4).


因此,基于上述最佳反应条件,在反应体系中加入过量HO·掩蔽剂叔丁醇,考察Fe(VI)直接氧化和HO·间接氧化在Fe(VI)氧化OFL中的贡献率.
由图4可知,反应液中加入叔丁醇后OFL的去除率由92.38%降低至70.34%,这是因为溶液中的叔丁醇会中断Fe(VI)的自由基链反应,并消耗Fe(VI)生成的HO·[29],但Fe(VI) 及中间高价态铁仍然发挥着重要的氧化作用.通过对比两组实验中OFL的最终去除率可知,Fe(VI)及中间高价态铁对OFL去除的贡献率为70.34%,HO·及其它活性物质的贡献率为22.04%.Fe(VI)及中间高价态铁对OFL去除的贡献率较高,进一步证明了稳定性较高的Fe(VI)易与带负电的OFL发生氧化反应.
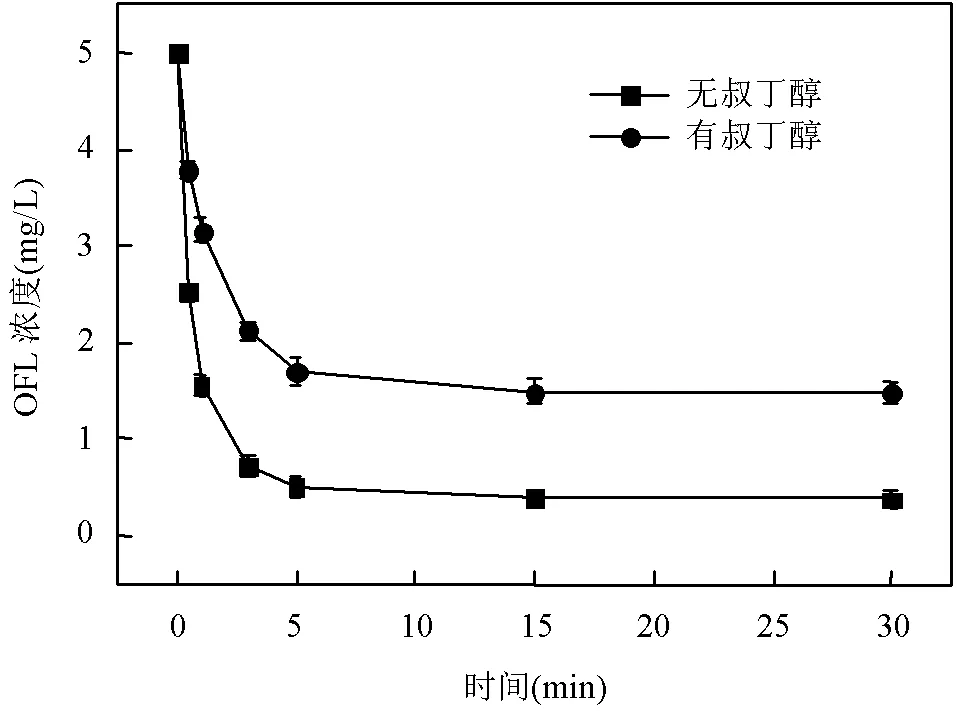
图4 叔丁醇对Fe(VI)氧化降解OFL的影响
2.3 共存物质对OFL降解的影响
2.3.1 共存离子对OFL去除效果的影响 在OFL初始浓度为5mg/L,pH=8,温度为25°C,高铁酸钾投加量为(K2FeO4):(OFL)=40:1的条件下,考察自然水体及废水中较为常见的阴离子(Cl-、NO3-、SO42-和HCO3-)、阳离子(Mg2+、Ca2+和Cu2+)对OFL降解效果的影响.所有离子浓度均为5mmol/L,反应时间为30min.实验结果如图5所示.

图5 共存离子对OFL降解率的影响
可见,4种阴离子对OFL的去除效果影响较小.当反应液中不含共存离子时,OFL去除率为92.38%,在Cl-、NO3-、SO42-和HCO3-存在的情况下OFL的去除率分别降低了1.21%,2.30%,3.02%和4.50%,其中HCO3-对OFL去除效果的影响较为明显.一方面,HCO3-可能会与Fe(OH)3发生络合,削弱Fe(OH)3的吸附能力[30]从而导致OFL的去除率降低.另一方面,HCO3-会与HO·发生反应,消耗溶液中的自由基[31],导致OFL的去除率降低.但HCO3–对溶液pH值的影响仍在硼酸-硼砂缓冲溶液的缓冲范围内,对Fe(VI)氧化效果的影响仍然较小,这也与已报道的研究结果一致[18,32-33].
相对地,3种阳离子对OFL的去除效果影响较大.当二价碱金属离子Mg2+和Ca2+存在时,OFL的去除效果受到了明显的抑制,去除率分别降低13.22%和15.53%,Ca2+的抑制效果略大于Mg2+,这是因为溶液中的Mg2+和Ca2+加剧了Fe(VI)的自分解反应[34],导致OFL的去除率降低.而反应液中存在过渡金属离子Cu2+时,OFL的去除率降低11.36%,这可能是因为过渡金属离子倾向于与有机分子形成络合物,而Fe(VI)与金属络合物的反应较为缓慢,对Fe(VI)与目标物之间的反应产生负面影响[18].
2.3.2 腐殖酸对OFL去除效果的影响 在OFL初始浓度为5mg/L,pH=8,温度为25°C,高铁酸钾投加量为(K2FeO4):(OFL)=40:1的条件下,当反应液中HA浓度分别为0,1,5,10mg/L时,OFL的去除率逐渐降低,分别为92.38%、89.08%、79.76%、72.12%.Feng等[18]研究显示,随着HA浓度增加,Fe(VI)对氟甲喹的氧化效果呈非线性下降趋势,当HA浓度为15mg/L时,氟甲喹去除率下降了40%.Yang等[35]在使用Fe(VI)氧化四溴双酚A和双酚A时,添加20mg/L的HA后,四溴双酚A和双酚A降解率分别从70%下降到33.2%和28.4%.这可能是因为腐殖酸的一些不饱和基团如羟基、酚羟基会与OFL形成竞争[36],干扰Fe(VI)氧化降解OFL,从而降低OFL的去除率.
2.4 Fe(VI)降解OFL的产物分析和路径推测
将实验样品进行预处理后,进行UPLC-QTOF- MS产物测定.通过分析质谱图,得到总计15种OFL降解的中间产物(表5),并推测Fe(VI)氧化OFL的反应路径(图6).
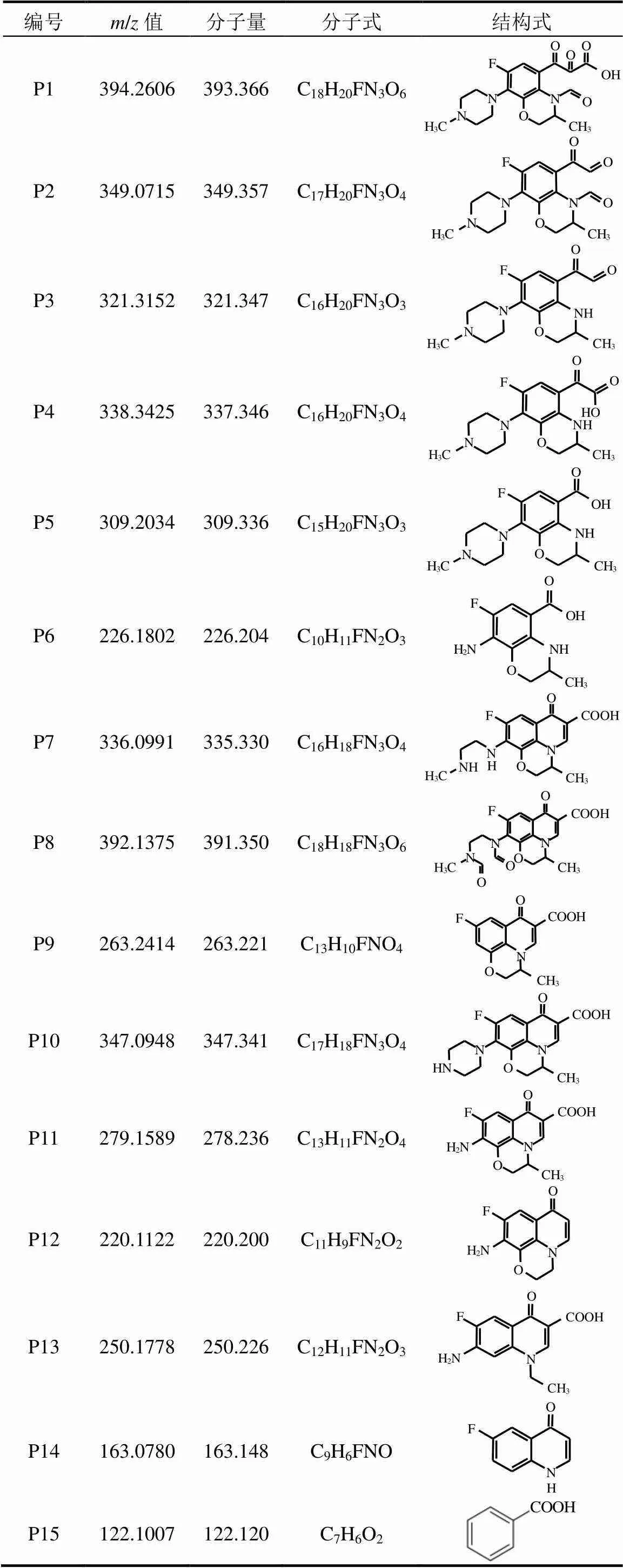
表5 OFL的降解中间产物
在路径I中,由于喹诺酮取代基环上烯烃双键为富电子基团,所以Fe(VI)会优先与喹诺酮取代基上的烯烃双键发生1,3-偶极环加成反应,使得喹诺酮取代基上吡啶环开环生成P1[18],随后发生脱羰反应生成P2,继而生成P3,P3羟基化后(P4)进一步生成P5,最终母苯环上与哌嗪取代基环连接的C-N键被Fe(VI)攻击断裂后生成P6[37].
在路径II与路径III中,Fe(VI)会以不同的方式破坏哌嗪基环.路径II中OFL的哌嗪基环失去2个碳原子后形成P7,随后形成P8,在Fe(VI)氧化环丙沙星的过程中也有类似反应发生[15]. 哌嗪基环与喹诺酮取代基相连的C-N键被攻击断裂后生成P9.而路径III中,OFL经去甲基反应生成P10后,因哌嗪基环侧链氧化减少至1个氨基后形成P11[38].P11可发生去甲基反应生成P12.另一方面,P11上的恶嗪基环可能被破坏形成P13[39],通过脱氨、脱羧基和吡啶基上C-N键的断裂形成P14,最终通过吡啶环开环、脱氟反应后得到P15[40].
综上所述,Fe(VI)在氧化OFL时主要通过脱羧、去甲基、脱羰、羟基化等反应实现喹诺酮取代基、哌嗪基环及恶嗪基环的开环,从而达到氧化降解OFL的目的.

图6 Fe(VI)氧化OFL的途径
3 结论
3.1 Fe(VI)氧化OFL的最佳条件为:温度为25℃、(K2FeO4):(OFL)=40:1、pH值为8时,反应30min后,OFL的去除率可达92.38%.反应前5min为快速反应阶段,OFL的降解符合伪二级反应动力学模型,反应速率常数obs=0.361L/(mg·min).
3.2 Fe(VI)氧化OFL时,Fe(VI) 及中间高价态铁起到主要作用,对OFL去除的贡献率为70.34%,反应过程中生成的HO·及其他活性物质的贡献率为22.04%.
3.3 Cl-、NO3-、SO42-和HCO3-对降解效果的影响较小,Mg2+、Ca2+和Cu2+对降解效果有小幅抑制作用,腐殖酸对OFL的降解起到显著的抑制作用.
3.4 OFL被Fe(VI)氧化时可能存在3种降解路径,主要通过脱羧、去甲基、脱羰、羟基化等反应实现OFL分子上喹诺酮取代基、哌嗪基环及恶嗪基环的开环.
[1] Ding G,Chen G,Liu Y,et al. Occurrence and risk assessment of fluoroquinolone antibiotics in reclaimed water and receiving groundwater with different replenishment pathways [J]. Science of the Total Environment,2020,738:139802.
[2] Zhang R,Zhang R,Zou S. Occurrence,distribution and ecological risks of fluoroquinolone antibiotics in the Dongjiang River and the Beijiang River,Pearl River Delta,South China [J]. Bulletin of Environmental Contamination & Toxicology,2017,99(1):46-53.
[3] Anjali R,Shanthakumar S. Insights on the current status of occurrence and removal of antibiotics in wastewater by advanced oxidation processes [J]. Journal of Environmental Management,2019,246(15):51-62.
[4] Danner M C,Robertson A,Behrends V,et al. Antibiotic pollution in surface fresh waters: Occurrence and effects [J]. Science of the Total Environment,2019,664C(10):793-804.
[5] Song Z,Zhang X,Ngo H H,et al. Occurrence,fate and health risk assessment of 10common antibiotics in two drinking water plants with different treatment processes [J]. Science of the Total Environment,2019,674(15):316-326.
[6] Smz A,Mj B,Nan X B,et al. Antibiotics and antibiotic resistant genes (ARGs) in groundwater: A global review on dissemination,sources,interactions,environmental and human health risks [J]. Water Research,2020,187:116455.
[7] Krembs F J,Siegrist R L,Crimi M L,et al. ISCO for groundwater remediation: Analysis of field applications and performance [J]. Ground Water Monitoring & Remediation,2010,30(4):42-53.
[8] Dulova N,Kattel E,Trapido M. Degradation of naproxen by ferrous ion-activated hydrogen peroxide,persulfate and combined hydrogen peroxide/persulfate processes: The effect of citric acid addition [J]. Chemical Engineering Journal,2016,318:254-263.
[9] Fu L,Wu C,Zhou Y,et al. Ozonation reactivity characteristics of dissolved organic matter in secondary petrochemical wastewater by single ozone,ozone/H2O2,and ozone/catalyst [J]. Chemosphere,2019,233:34-43.
[10] Matzek L W,Carter K E. Sustained persulfate activation using solid iron: Kinetics and application to ciprofloxacin degradation [J]. Chemical Engineering Journal,2017,307:650-660.
[11] 王小娜.高铁酸钾氧化降解卡马西平的实验研究 [D]. 大连:大连理工大学,2021.
Wang X N. Experimental study on oxidative degradation of carbamazepine by potassium ferrate [D]. Da Lian: Dalian University of Technology,2021.
[12] Przemysław D,Agata D,Katarzyna S,et al. Analytical and ecotoxicological studies on degradation of fluoxetine and fluvoxamine by potassium ferrate [J]. Environmental Technology,2019,40(25):3265-3275.
[13] Tam N T M,Liu Y,Bashir H,et al. Efficient removal of diclofenac from aqueous solution by potassium ferrate-activated porous graphitic biochar: Ambient condition influences and adsorption mechanism [J]. International Journal of Environmental Research and Public Health,2019,17(1):291-291.
[14] Guan W,Xie Z,Zhang J,et al. Preparation and aromatic hydrocarbon removal performance of potassium ferrate [J]. Journal of Spectroscopy,2014,2014(171484).
[15] Zhou Z,Jiang J Q. Reaction kinetics and oxidation products formation in the degradation of ciprofloxacin and ibuprofen by ferrate(VI) [J]. Chemosphere,2015,119:95-100.
[16] Lee Y,Zimmermann S G,Kieu A T,et al. Ferrate (Fe(VI)) application for municipal wastewater treatment: A novel process for simultaneous micropollutant oxidation and phosphate removal [J]. Environmental Science & Technology,2009,43(10):3831-3838.
[17] 陈凯波.高铁酸盐对养殖废水中典型抗生素的去除 [D]. 杭州:浙江工业大学,2017.
Chen K B. The removal of the tyoical antibiotics from aquaculture wasterwater by potassium ferrate(VI) [D]. Hangzhou: Zhejiang University of Technology,2017.
[18] Feng M,Wang X,Chen J,et al. Degradation of fluoroquinolone antibiotics by ferrate(VI): Effects of water constituents and oxidized products [J]. Water Research,2016,103(15):48-57.
[19] Wagner W F,Gump J R,Hart E N. Factors affecting stability of aqueous potassium ferrate(VI) solutions [J]. Analytical Chemistry,1952,24(9):1497-1498.
[20] Zhang Z,Li X,Zhang C,et al. Combining ferrate(VI) with thiosulfate to oxidize chloramphenicol: Influencing factors and degradation mechanism [J]. Journal of Environmental Chemical Engineering,2021,9(1):104625.
[21] Sharma V K. Ferrate(VI) and ferrate(V) oxidation of organic compounds: Kinetics and mechanism - ScienceDirect [J]. Coordination Chemistry Reviews,2013,257(2):495-510.
[22] Sharma V K. Potassium ferrate(VI): An environmentally friendly oxidant [J]. Advances in Environmental Research,2002,6(2):143-156.
[23] Xu G R,Zhang Y P,Li G B. Degradation of azo dye active brilliant red X-3B by composite ferrate solution [J]. Journal of Hazardous Materials,2009,161(2/3):1299-1305.
[24] Davydov N,Zairov R,Mustafina A,et al. Determination of fluoroquinolone antibiotics through the fluorescent response of Eu(III) based nanoparticles fabricated by layer-by-layer technique [J]. Analytica Chimica Acta,2013,784:65-71.
[25] Pinacho D G,Sánchez-Baeza F,Marco M P. Molecular modeling assisted hapten design to produce broad selectivity antibodies for fluoroquinolone antibiotics [J]. Analytical Chemistry,2012,84(10): 4527-4534.
[26] Monfort O,Usman M,Soutrel I,et al. Ferrate(VI) based chemical oxidation for the remediation of aged PCB contaminated soil: Comparison with conventional oxidants and study of limiting factors [J]. Chemical Engineering Journal,2018,355:109-117.
[27] Yang B,Ying G G,Zhao J L,et al. Removal of selected endocrine disrupting chemicals (EDCs) and pharmaceuticals and personal care products (PPCPs) during ferrate(VI) treatment of secondary wastewater effluents [J]. Water Research,2012,46(7):2194-2204.
[28] Zhang P,Zhang G,Dong J,et al. Bisphenol A oxidative removal by ferrate (Fe(VI)) under a weak acidic condition [J]. Separation & Purification Technology,2012,84:46-51.
[29] Sharma V K,Zboril R,Varma R S. Ferrates: Greener oxidants with multimodal action in water treatment technologies [J]. Accounts of Chemical Research,2015,48(2):182-191.
[30] Suarez D,Suarez D. In situ infrared speciation of adsorbed carbonate on aluminum and iron oxides [J]. Clays & Clay Minerals,1997,45(6):814-825.
[31] Wang J L,Wang S Z. Effect of inorganic anions on the performance of advanced oxidation processes for degradation of organic contaminants [J]. Chemical Engineering Journal,2021,411:128392.
[32] Liu H,Pan X,Chen J,et al. Kinetics and mechanism of the oxidative degradation of parathion by Ferrate(VI) [J]. Chemical Engineering Journal,2019,365:142-152.
[33] Zheng Q,Wu N,Qu R,et al. Kinetics and reaction pathways for the transformation of 4- tert -butylphenol by ferrate(VI) [J]. Journal of Hazardous Materials,2021,401:123405.
[34] Ma L,Lam W,Lo P K,et al. Ca2+-induced oxygen generation by FeO42-at pH 9-10 [J]. Angewandte Chemie International Edition,2016,55(9):3012-3016.
[35] Yang B,Ying G G,Chen Z F,et al. Ferrate(VI) oxidation of tetrabromobisphenol A in comparison with bisphenol A [J]. Water Research,2014,62(1):211-219.
[36] Miao X S,Yang J J,Metcalfe C D. Carbamazepine and its metabolites in wastewater and in biosolids in a municipal wastewater treatment plant [J]. Environmental Science & Technology,2005,39(19):7469-7475.
[37] Sharma S,Umar A,Mehta S K,et al. Solar light driven photocatalytic degradation of levofloxacin using TiO2/carbon-dot nanocomposites [J]. New Journal of Chemistry,2018,42(9):7445-7456.
[38] Hapeshi E,Fotiou I,Fatta-Kassinos D. Sonophotocatalytic treatment of ofloxacin in secondary treated effluent and elucidation of its transformation products [J]. Chemical Engineering Journal,2013,224(1):96-105.
[39] Prabavathi S L,Saravanakumar K,Park C M,et al. Photocatalytic degradation of levofloxacin by a novel Sm6WO12/g-C3N4heterojunction: Performance,mechanism and degradation pathways [J]. Separation and Purification Technology,2021,257:117985.
[40] Jin Q Y,Ji D Y,Chen Y H,et al. Kinetics and pathway of levofloxacin degradation by ferrate(VI) and reaction mechanism of catalytic degradation by copper sulfide [J]. Separation and Purification Technology,2022,282:120104.
Oxidation and degradation mechanisms of ofloxacin by potassium ferrate.
LI Ya-nan1*,FENG Zhuo1,WANG Jia-qi1,GUO Kai1,ZHANG Guo-kai2
(1.Department of Environmental Science and Engineering,Taiyuan University of Technology,Jinzhong 030600,China;2.Chinasea Group Co. Ltd.,Taiyuan 030012,China).,2022,42(8):3696~3703
The oxidation and degradation mechanisms of quinolone antibiotic ofloxacin (OFL) by potassium ferrate (Fe (VI)) were studied.High performance liquid chromatography(HPLC),liquid chromatograph mass spectrometer(UPLC-QTOF-MS) and other methods were used to investigate the effects of Fe (VI) dosage,pH,temperature and coexisting substances on OFL removal,analyze the reaction kinetics,calculate the contribution rate of Fe(VI) in the process of OFL oxidation,identify the products of Fe(VI) and predict the main reaction pathways.The results show that the degradation efficiency of OFL reached 92.38% after 30 minutes of oxidation,with the molar ratio of Fe (VI) to OFL of 40:1,pH of 8 and temperature of 25°C. In the first 5 minutes’ rapid reaction stage,OFL degradation conformed to pseudo second-order reaction kinetics,and the activation energy was 28.17kJ/mol. The contribution of Fe (VI) and the high-valent intermediate iron species to OFL removal was 70.34%,and humic acid significantly inhibited the reaction. Three main oxidation pathways for OFL degradation by Fe (VI) were proposed based on the analysis of reaction products,and the ring cleavages of quinolone,piperazine and oxazine rings were mainly achieved through decarboxylation,demethylation,decarbonylation and hydroxylation.
potassium ferrate;ofloxacin;influencing factors;coexisting substances;intermediate products;degradation pathway
X703
A
1000-6923(2022)08-3696-08
2022-01-01
山西省应用基础研究计划项目(20210302123121);自然资源部生态地球化学重点实验室开放基金(ZSDHJJ201804)
* 责任作者,副教授,liyanan@tyut.edu.cn
李亚男(1983-),女,山西吕梁人,副教授,主要从事污废水处理技术研究.发表论文30余篇.

