心功能的MRI分析
程流泉,张恒,李梦露
1.解放军总医院第六医学中心放射诊断科,北京 100048;2.解放军总医院第二医学中心放射诊断科,北京 100089;*通信作者 程流泉 13910209982@139.com
心脏磁共振(cardiac magnetic resonance,CMR)是目前临床无创评估心功能的“金标准”,也是评估心肌组织特征的标准方法[1]。心脏的结构、功能和形态学参数、组织学参数的量化在心脏疾病的诊断和临床管理中发挥越来越重要的作用[2]。CMR的临床应用以心脏电影成像和钆对比剂延迟增强序列为基础,前者准确显示心脏的结构与运动功能,后者显示心肌的组织特征[1]。两者联合为心脏疾病提供准确的功能变化评估,为不同病因导致的心功能变化提供诊断依据,使得CMR在心血管疾病诊疗中越来越受到重视和推广。
近年,CMR心功能分析随着计算机图像后处理能力的进步而不断提高,具有不同病理生理意义的指标不断被发现,诊断效能也不尽相同。本文拟从维度分解的角度,综述从四维、三维、二维和一维4个方面,对CMR测量的心功能指标进行归类分析和阐释。
1 四维的血流动力学分析
4D-flow是最近几年研究心脏大血管疾病的前沿技术,四维指按照时序连续排列的三维信息空间,即空间三维+时间维[3]。该技术基于心电触发三维采集的相位对比速度编码梯度回波序列,通过在X、Y、Z 3个方向施加速度编码梯度获得每个体素的速度矢量,将RR周期内的分段连续采集的三维速度矢量连续电影播放,形成按照空间-时间分布变化的流速编码线图。4D-flow通过速度向量图、流线图和路径图表达血流的直觉和定性特征。流线图上速度大小用颜色或(和)矢量长度表示,瞬时血流方向是流线的切线方向;路径图显示一团血流在时间序列的路径[4]。4Dflow构建的这种直观的多维度、多方向的血流图,首先用于评价瓣膜病和先天性心脏病[5-6];在心室的初步应用表明,左心室内的血流可以划分为直流、回流和滞留等,心腔扩张和心功能降低明显伴有滞留和回流成分以及直流成分的分散等特点[7]。
4D-flow技术获得的是关于流体容积的速度矢量三维数据组,通过速度矢量这个元数据可以定量计算血流量、管壁剪切力应力和压力梯度等定量参数,其中血流动能(kinetic energy,KE)是特色参数之一,KE(=1/2mV2,m为血流质量,V为血流速度)综合反映速度和流量的双重要素,可以直接衡量心肌的做功和流体的能量转换和消散(湍流能量)。心脏血流动力学变化是心肌做功的结果,心脏的形态学变化会导致血流动力学改变,血流动力学改变也会重塑心脏形态[8]。4D-flow技术是综合反映心室血流动力学及其病理生理过程的全新工具,将为心功能研究提供新的途径和方法。然而,基于4D-flow测量的血流动力学指标尚需要大规模的临床应用验证,部分研究已经观察到KE的变化与心功能参数相关的敏感性,包括左心室充盈和舒张功能[9];亦有研究发现左心室、左心房及右心室的KE和涡流与年龄和性别等因素相关[10-11]。作者的经验也表明左心室内的KE变化解释不能离开心率、血压、体重指数等前后负荷以及左、右心室耦合等因素的影响,因此有关4D-flow的临床应用有待多中心纵向应用验证。目前4D-flow技术的难度还比较大,需要综合平衡心率和呼吸伪影、信噪比、时间和空间分辨率、采样效率等因素,获得一组时间分辨率约40 ms、空间分辨率为3 mm的心脏4D-flow数据需时不少于15 min。采样时间长、影响因素多、数据校正和后处理也需要强大的计算机能力,需要整合深度学习等人工智能技术,这些均有专业公司在配合设备厂商进行图像后处理分析和呈现,而对数据的测量和解释需要良好的心脏病理生理和流体动力学知识背景支撑。
2 三维的心脏泵功能分析
心脏的三维泵功能分析是经典的全心功能指标,CMR测量的左心室射血分数(left ventricular ejection fraction,LVEF)是心功能的“金标准”。基于分段K空间采集的平衡稳态自由进动电影成像序列是目前获取电影系列的标准技术,具有良好的心肌-血池对比度,可以实现在心动周期内的任一时间对心脏结构的个体化测量。在CMR测量的三维泵功能指标中,临床常用的经典心功能指标是左心室和右心室舒张末期容积(end-diastolic volume,EDV)、收缩末期容积(end-systolic volume,ESV)和心肌质量,其他指标包括每搏输出量、射血分数、心排血量/心脏指数等均是在此基础数据上衍生计算获得的,也是目前心脏疾病诊断和治疗评价的关键指标[1,12]。上述指标均基于CMR对心脏运动精确量化评价,具有个体化优势和良好的可重复性,在临床上得到广泛的认可,更多地应用于心血管疾病的临床诊断和治疗评价。
基于平衡稳态自由进动电影序列的心功能分析也属于四维信息,在容积-时间曲线上,纵坐标反映三维容积的变化,并且可以从容积-时间曲线及其时间导数(dV/dt)推导出新的功能参数;dV/dt曲线代表心室血流速度,其中收缩期最小值代表射血峰值(PER),舒张期最大值代表早期峰值充盈率(PFRE)和心房收缩峰值充盈率(PFRA)。PFRE/PFRA和归一化为舒张末期容积的充盈率(PFRE/EDV,PFRA/EDV)具有表征舒张期心室功能和分类舒张功能不全的潜力,而无需额外的测量[13-14]。然而,目前的临床应用中仅截取ESV和EDV的数据以及部分衍生值。根据新的通用心力衰竭分类标准,LVEF并不能充分反映心功能的变化,其中以射血分数保留型心力衰竭为代表,因为LVEF并未融入心脏的前后负荷等影响因素,不反映射血功能和舒张功能的特征,也未纳入右心的功能参数,因而并不能充分解释心力衰竭的症状和体征[15]。此外,作者认为由平衡稳态自由进动电影序列测量的是左心室容积-时间曲线(图1),这个曲线因个体的EDV/ESV以及心动周期不同而缺乏可比性,需要进行标准化处理形成LVEF-时间曲线,才使得不同个体之间具有可比性,并在此基础上进行数据挖掘(图2)。

图1 左心室容积-时间曲线。横轴为标准化的时间轴(RR/25),纵轴为左心室容积,不同疾病个体之间的EDV和ESV差别较大,缺乏标准化;如果RR周期不标准化,则曲线的长短也不一致,缺乏标准化和可比性
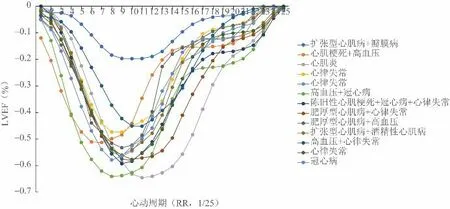
图2 LVEF-时间曲线。横轴为标准化的时间轴(RR/25),纵轴为LVEF,为了保持曲线形态倒V轮廓取负值,此曲线轮廓与图3的整体环向应变曲线十分相似。除峰值(即最大射血分数)外,不同疾病的达峰时间、半高全宽、舒张中期以及收缩和舒张斜率均是可以挖掘的数据
在过去几年中,CMR因其对右心室测量的准确性已成为评估右心室结构和功能的“金标准”,尤其是评估右心室体积、质量和射血分数[16]。在心脏泵功能分析中,右心室泵功能的精确测量一直滞后于左心室。临床工作中,右心室的泵功能变化非常重要但容易被忽略,新的通用心力衰竭分期中,体循环充血导致的心力衰竭直接涉及右心室的泵功能评价缺乏数据支持,心力衰竭发生及发展中左、右心室耦合因素并未被充分考虑[15]。既往研究表明,右心室在各种心脏疾病中具有关键作用[17]。作者认为,目前临床对累及右心室的疾病和右心室功能关注度较高,但是缺乏标准化、可重复性好的评价手段,与CMR的普及程度和CMR测量的右心室心功能参数缺乏标准有关。CMR的多模态成像技术可以全面评估右心室形态和功能,对于了解心脏疾病的病理生理机制和病因至关重要。
3 二维的心肌形态分析
心肌和心腔的二维形态参数有助于判断心脏结构异常并评估心脏疾病进展。二维的形态分析指能够描述心脏静态数据的几何参数,包括心房和心室长径和横径、左心室心肌收缩末期和舒张末期厚度、心内膜位移等结构参数,以及由此计算衍生获得的左心室球形系数、心肌增厚率、左心室缩短系数等。这些指标的参考值可以直接引用超声心动图测量的数据,因为在二维测量上两者具有同样的切面和直观性,但前提条件是扫描层面一致,即CMR成像扫描标准化[1]。如果CMR的长轴扫描层面不能严格定义为二尖瓣环中点和心尖的连线,则在二腔心、三腔心和四腔心层面测量的左心室径线数据存在差异,而超声心动图测量的准确性和可重复性低,部分原因也来自这种操作者间的差异。实际测量心脏径线时,短轴位上测量的心肌厚度和长轴位测量同一节段的心肌厚度应该一致,由此可以反向证明扫描层面是否标准化和具有可重复性。
基于美国心脏协会的左心室心肌17节段划分是心肌二维测量数据的解剖基础[18]。CMR短轴的测量扫描标准易执行、准确性高、可重复性好,且与左心室17节段直接对应。基于短轴分段的牛眼图可以直观地显示厚度、心肌位移、增厚率等静态参数。正常情况下,室间隔和左心室游离壁厚度、位移和增厚率有差别,因此超声心动图测量一般选择心底水平的室间隔前段和侧下壁(分别对应美国心脏协会的第2、5段)作为心肌厚度参数,但是当出现心肌疾病时,仅用这2个参数不足以表达心肌形态的变化,使用CMR的多层面重建牛眼图才能表达心肌厚度变化的全部信息。
二维分析指标测量形态不规则的右心室存在困难。由于右心室形态存在很大的个体差异,且缺乏明确的解剖标记,导致测量右心室长轴和短轴径线均缺乏可操作性,右心室心肌厚度也不足以做出准确的可重复性测量[1,17]。基于左心扫描的短轴层面和四腔心层面是判断右心室形态的关键层面,右心室长轴位和右心室流出道位置因为受右心室心尖位置差异获得的图像缺乏稳定性和可重复性[19]。右心室的功能分析可能更多地依赖三维信息和一维信息。
左、右心房的大小与多种心脏疾病预后相关[20-21]。心房心腔径线测量与心室径线测量同样需要准确的成像层面和解剖标记,以及适用于CMR的正常参考值。在CMR图像上,右心房的测量主要是四腔心层面,另外一个推荐补充层面是右心房的长轴位,即上腔静脉、下腔静脉与右心房交汇处的中点与三尖瓣环中点的连线,这是右心房具有稳定解剖标记的层面,但缺乏该层面的CMR正常参考值。左心房的主要测量平面是四腔心层面和长轴位层面,可以测量左心房前后径、上下径和左右径,即在左心室标准的长轴层面测量左心房径线,这是目前CMR测量左心房的推荐方法[22]。作者认为这种方法缺乏左心房恒定的解剖标记,实际工作中可重复性较左心室低,对左心房形态变化敏感度不高。
4 一维的心肌节段功能分析
一维指将心肌节段简化为运动质点,测量计算质点的位移、速度和加速度以及圆周运动的角速度、扭矩等运动指标,其中应变与应变率是CMR研究心肌运动的主要研究参数[1]。在CMR图像上,基于特征追踪技术的心肌应变分析将复杂的心肌扭转运动分解为纵向、径向和环向3个方向。心肌应变曲线表现为心动周期内随着时间变化而变化,其主要分析指标为峰值和达峰时间(time to peak,TTP)。应变区别于心肌收缩增厚率、位移等二维参数,能够表达心肌任何位置的形变能力,反映不同走行方向的心肌纤维形变能力,为探索不同类型心肌病的发生及发展机制提供有效信息。
从应变的概念理论上讲,此类一维指标反映节段性的心肌运动特征,因此其适用范围应该是心肌节段性功能,而不是全心功能指标。本课题组研究表明[23-24],尽管在正常人群的统计数据表现出一定的分布特征,但是同一个体内左心室不同节段的应变峰值大小不等,不同个体内相同节段之间的应变峰值也各不相同,即节段性应变参数的一致性较差,变异系数较大。存在缺血性心肌病、肥厚型心肌病等节段性心肌病变时,难以作为节段心肌功能参考值。而基于各节段的应变平均值计算获得整体纵向应变、整体环向应变和整体径向应变的一致性相对较好,被诸多研究认为是早期反映心肌运动功能损伤的指标,可以认为在弥漫的心肌病变时能非特异性地反映心肌功能下降[25-26]。亦有研究通过追踪标准CMR图像中的解剖位点(心尖、三尖瓣、二尖瓣)获得可重复、快速、类似于左心室/右心室整体纵向应变的诊断和预后能力[27-28]。例如,正常情况下心尖位置保持不变,由此计算的房室沟的纵向应变与整体纵向应变非常相似。本课题组研究认为,心肌应变的峰值的病理生理意义主要在于评价节段性心肌病变在治疗前后的自身对照,而整体纵向应变、整体环向应变和整体径向应变等反映的整体心肌功能变化,可能并不超出LVEF曲线反映的信息(图3)。另外,在解释应变参数的变化时,同样需要考虑心率、血压、前后负荷、心肌质量等因素的影响[29]。
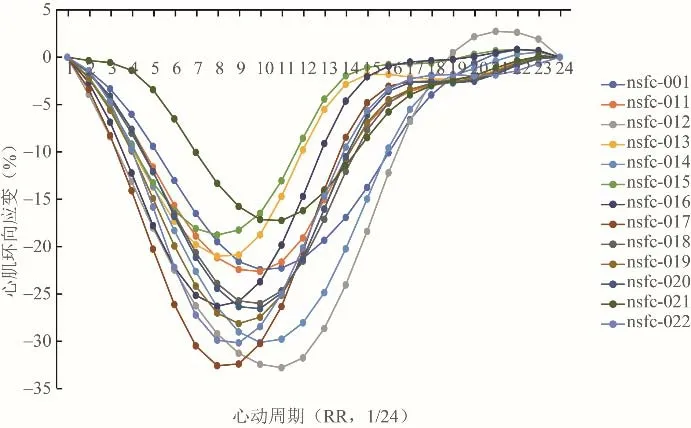
图3 左心室整体纵向应变曲线。横轴为标准化的时间轴(RR/24),纵轴为应变值,不同正常个体之间的峰值和达峰时间有差别,这也是应变缺乏个体之间比较的主要原因
以心肌应变为代表的一维功能参数曲线的另一个关键指标是TTP,其反映心肌各节段运动的同步性,作者对正常人群的研究数据表明,不同心肌节段应变的峰值可以不一致,但TTP基本一致,TTP的一致性使得曲线具有良好的形态学可比性[23-24]。部分研究采用的CURE指标能够综合判断峰值和TTP的特征,由此评价心肌运动的同步性,是具有临床价值的指标,值得深入挖掘[30-31]。
一维运动指标的另一个优势是不以形态学特征为前提,使得应变指标可以应用在一些不规则的解剖结构,如右心室壁和心房壁的应变研究。右心应变在诊断亚临床心肌损害及评估预后中具有重要的潜在价值[32]。心房应变评估舒张功能具有可行性,且在诊断和分级舒张功能障碍以及预测房颤及充血性心力衰竭中具有一定的价值[33]。
5 扫描的标准化与测量误差分析
准确、可重复的心功能分析的前提是CMR扫描的标准化,有关CMR扫描层面的标准化见诸很多教材。在此基础上,作者推荐的经验是顺应心脏的功能解剖进行扫描,其中关键是将4个瓣环的中点和心尖作为解剖标记进行定位,其优势体现在四腔心层面的恒定性,由此形成二腔心、三腔心和四腔心均衡地将左心室心肌环划分为6个节段并与美国心脏协会的划分标准对应。其他位置可以通过这些相对恒定的解剖标志进行定位,如右心室流出道与流出道层面、右心房长轴位等,这些标准化的解剖功能层面也可以为超声检查所借鉴,从而减少操作者和设备时间的差异。
采集过程中的另一个误差来自医患之间的配合。目前的CMR数据采集基于多次反复屏气完成,采集期间,屏气位置的恒定性、患者的心律变化均会直接导致图像伪影,或导致错层分析,从而形成偶然误差。
心功能的测量误差来源除扫描标准化外,测量操作也是导致误差的关键原因。在全心功能测量中,心底房室沟平移导致短轴位纳入测量层面的差别可导致LVEF出现3%~5%的误差;现在多数心功能分析关键均能够通过长轴位协同,准确界定房室沟的位置,减少这种测量误差;这种由于心肌纵向运动导致的测量误差还体现在心肌应变和增厚率的测量,由于采集层面相对固定而非追随心肌组织运动,因此测量的舒张末期和收缩末期心肌厚度并非严格意义上的同一心肌,这些测量过程的系统误差,也许可以通过图像采集或后处理得到校正。心尖区乳头肌在收缩末期和舒张末期的分布差别也会导致心内膜勾画和心血池容积计算的偏差,因此心尖水平的左心室壁厚度测量数据的归一性不如左心室中部和心底水平。在解释心肌功能数据时,需要考虑到这些误差的干扰。
6 心功能的人工智能化分析
经典的MRI心功能处理有赖于心肌-心血池轮廓的准确标记和勾画,这是一个繁杂而技巧性很强的工作。近年,基于深度学习的人工智能技术几乎可以替代人工勾画,获得良好的准确性和可重复性,尤其是对于右心室这样复杂构型的勾画,大大减轻了技术人员的工作量[34]。
人工智能在心功能的分析还体现在对数据采集的优化,如4D-flow的采集和分析中大量应用到人工智能技术,由此减少数据采集的冗长时间,提高了检查效率和分析效率,并保证质量控制;而融合了人工智能技术的快速采集技术,有可能在单次屏气过程中就完成一个覆盖全心的电影序列扫描,可以大幅度减少多次屏气导致的错层误差;也可能使完全自由呼吸采集后进行图像重建后处理达到运动校正的目的[35]。而在图像后处理过程中,采用人工智能技术进行分析校正和质量控制,可以减少分析的误差。而基于人工智能技术的大数据处理,可以将不同的运动参数以可视化方式表达,使得复杂的心功能和心肌功能分析更加简便、直观,从而形成分类诊断标准。
心功能分析是CMR检查和诊断的重要环节,心功能自身变化比较复杂,精确的心功能分析仍然有待于图像后处理能力的优化和数据挖掘,准确理解不同心功能指标的病理生理意义和诊断效能是心脏影像医师合理解释CMR的心功能变化的前提。

