应变技术定量评价肥胖小鼠左心室心肌收缩功能与早期炎症的关系
高娜,马鑫,燕茹,万富鑫,马学平,王琴*
1.宁夏医科大学,宁夏 银川 750004;2.宁夏医科大学总医院心脏中心功能检查部,宁夏 银川 750004;3.宁夏医科大学总医院心内科,宁夏 银川 750004;*通信作者 王琴 13995290877@163.com
肥胖是罹患心血管疾病的重大危险因素,肥胖患者在冠状动脉粥样硬化之前即已经出现心脏结构和功能改变[1]。肥胖会导致机体出现系统性、低水平慢性炎症[2-3],肥胖相关异常代谢产物会激活NOD样受体热蛋白结构域相关蛋白-3(NLRP3)炎症小体,上调炎症因子的表达,促进炎症因子半胱氨酸蛋白酶-1(Caspase-1)的产生[4],引起炎症反应,致使心肌缺血、心肌细胞坏死、心室重塑、心肌纤维化形成及心肌收缩功能减低,最终导致肥胖心肌损伤[5-6]。因此,深入研究NLRP3炎症小体、Caspase-1炎症因子激活机制,抑制其炎症信号传导,是预防肥胖早期心肌损伤的有效措施[7]。
超声生物显微镜(ultrasound biomicroscopy,UBM)活体成像技术在转化医学中广泛应用,主要应用于心脏成像、血管成像、肿瘤成像及分子成像,其应变技术是近年检测心肌功能的新技术[8],可无创、活体检测左心室形态、血流动力学以及心肌的应变,为定量评价肥胖受损心肌收缩功能提供了新方法。本实验通过UBM与病理相结合,进一步验证应变技术对肥胖小鼠心肌收缩功能监测的有效性,以及肥胖所致心肌损伤改变与NLRP3炎症小体、Caspase-1炎症因子的关系。
1 材料与方法
1.1 实验动物 选取6周龄、体重为20~25 g的C57BL/6J雄性小鼠50只[宁夏医科大学实验动物中心,实验动物生产许可证号:SCXK(宁)2020-0001],按照随机数字表法分为肥胖组30只和对照组20只;肥胖组给予高脂饲料(16%脂质,0.25%胆固醇),对照组饲料成分为5%脂质,不添加胆固醇;所有小鼠自由饮水摄食。于SPF级屏障内饲养12周后,选取体重和Lee's指数体长×1 000][9]符合纳入标准(肥胖组小鼠体重和Lee's指数>对照组¯x+1.5s)的肥胖组小鼠24只、对照组20只进行后续实验。实验方案获得宁夏医科大学实验动物伦理委员会批准(动物伦理批号:IACUC-NYLAC-2020-067)。
1.2 主要试剂及仪器 天狼星红染色试剂盒(南京森贝伽生物科技有限公司,BP-DL030-50ML)、NLRP3抗体(Abmart,T55651S)、Caspase-1(Abmart,T55429S)、山羊抗兔IgG/FITC标记(中杉金桥,ZF-0311)、荧光封片剂DAPI(中杉金桥,ZLI-9557)、UBM(Vevo2100,富士VisualSonics)、冷冻切片机(瑞沃德,FS800)、光学显微镜(日本Olympus BX43)。
1.3 检测方法
1.3.1 UBM检测 使用10%水合氯醛麻醉小鼠后,胸部脱毛备皮,连接心电图,采用VisualSonics Vevo 2100 Imaging System UBM获取小鼠心脏相关数据。于左心室长轴切面获取室间隔舒张末期厚度(interventricular septal end-diastolic thickness,IVS-D)、室间隔收缩末期厚度(interventricular septal endsystolic thickness,IVS-S)、左心室后壁舒张末期厚度(left ventricular posterior wall end-diastolic thickness,LVPW-D)、左心室后壁收缩末期厚度(left ventricular posterior wall end-systolic thickness,LVPW-S);于左心室短轴切面获取左心室舒张末期内径(left ventricular end-diastolic diameter,LVID-D)、左心室收缩末期内径(left ventricular end-systolic diameter,LVID-S)、左心室射血分数(left ventricular ejection fraction,LVEF)、左心室短轴缩短率(left ventricular fractional shortening,LVFS)。采用应变技术定量分析软件(Vevo StrainTMElastography Imaging Mode 3.1.1)获取左心室心肌应变参数,纵向应变参数于左心室长轴切面测量,径向和圆周应变参数于乳头肌水平左心室短轴切面测量,描记心肌运动范围,得出各切面心肌的整体应变曲线。
1.3.2 HE染色 制作冰冻切片,采用HE染色观察细胞核与细胞质的变化,其中细胞核呈蓝色,细胞质呈红色。
1.3.3 天狼星红染色 采用天狼星红染色试剂盒检测心肌细胞组织纤维化水平,其中胶原纤维呈红色,细胞核呈蓝色。
1.3.4 小麦胚芽凝集素+异硫氰酸荧光素检测 采用小麦胚芽凝集素(wheat germ agglutini,WGA)+异硫氰酸荧光素(fluorescein isothiocyanate,FITC)绿色免疫荧光反应检测NLRP3、Caspase-1炎症因子表达情况,其中心肌细胞呈红色,细胞核呈蓝色,炎症因子呈绿色;使用正常山羊血清封闭,加入一抗(1∶100)、二抗(1∶100)、WGA染液(1∶100)避光孵育,DAPI封片,拍照。
1.4 统计学方法 应用SPSS 26.0软件,正态分布的计量资料以±s表示,两组间比较采用独立样本t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 常规超声参数比较 与对照组相比,肥胖组小鼠LVEF及LVFS水平显著降低,LVID-S、IVS-D、IVSS、LVPW-D及LVPW-S显著增大,差异均有统计学意义(P均<0.001),两组LVID-D差异无统计学意义(P>0.05),见表1。
表1 两组小鼠UBM常规参数比较(±s)

表1 两组小鼠UBM常规参数比较(±s)
注:LVEF:左心室射血分数;LVFS:左心室短轴缩短率;LVID-D:左心室舒张末期内径;LVID-S:左心室收缩末期内径;IVS-D:室间隔舒张末期厚度;IVS-S:室间隔收缩末期厚度;LVPW-D:左心室后壁舒张末期厚度;LVPW-S:左心室后壁收缩末期厚度
参数对照组(n=20)肥胖组(n=24)t值P值LVEF(%) 75.04±2.81 63.63±2.03 14.82 0.000 0.000 LVID-D(mm) 3.22±0.28 3.31±0.37 0.80 0.428 LVFS(%)43.17±2.63 33.71±1.50 14.04 0.000 IVS-D(mm) 0.78±0.09 1.01±0.06 9.33 0.000 LVID-S(mm)1.84±0.20 2.20±0.24 5.07 0.000 LVPW-D(mm) 0.78±0.09 0.93±0.14 3.97 0.000 IVS-S(mm)1.10±0.11 1.40±0.10 9.51 LVPW-S(mm)1.09±0.07 1.21±0.11 4.18 0.000
2.2 应变参数比较 与对照组相比,肥胖组小鼠纵向应变、径向应变及圆周应变值均减低,差异有统计学意义(P均<0.05),见表2。
表2 两组小鼠UBM应变参数比较(±s)
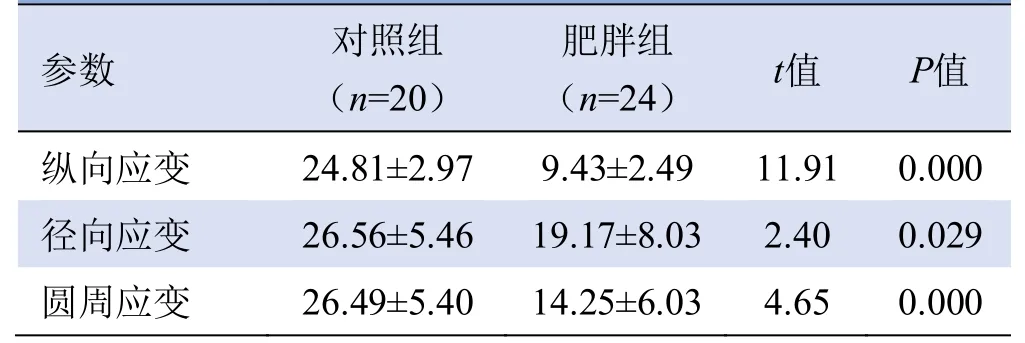
表2 两组小鼠UBM应变参数比较(±s)
参数对照组(n=20)肥胖组(n=24)t值P值纵向应变 24.81±2.97 9.43±2.49 11.91 0.000 0.029圆周应变 26.49±5.40 14.25±6.03 4.65 0.000径向应变26.56±5.46 19.17±8.03 2.40
2.3 病理结果 与对照组相比,肥胖组小鼠室间隔与左心室后壁明显增厚,心室腔内径明显变小,呈向心性肥厚(图1)。
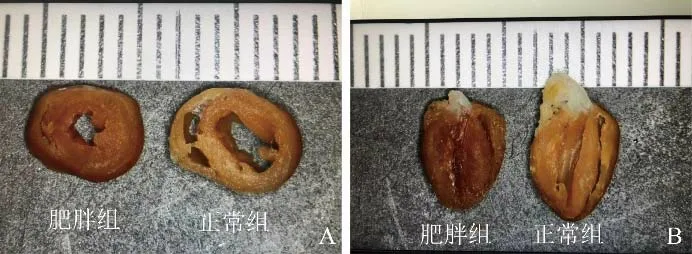
图1 肥胖组和对照组小鼠左心室病理大体图片。A.大体横切;B.大体纵切
2.4 HE染色 对照组小鼠心肌细胞排列整齐,边界清晰,胞核大小一致,胞质染色均匀;肥胖组小鼠心肌细胞肥大,边界模糊,排列紊乱且形态不规则,细胞核大小不均一(图2)。

图2 肥胖组和对照组小鼠HE染色结果。A、C:肥胖组;B、D:对照组;A、B:HE染色,×12.5;C、D:HE染色,×100
2.5 WGA染色 与对照组相比,肥胖组小鼠心肌细胞明显变大(图3)。

图3 肥胖组和对照组小鼠WGA染色结果(×400)。A、D分别为肥胖组与对照组WGA染色:B、E分别为肥胖组与对照组DAPI染色;C、F分别为肥胖组与对照组Merge;WGA可以特异地结合在心肌细胞膜上,心肌细胞为红色,细胞核为蓝色,与对照组相比,肥胖组心肌细胞明显增大
2.6 天狼星红染色 对照组小鼠心肌胶原纤维分布正常,排列整齐;肥胖组小鼠心肌胶原纤维分布明显增多,排列紊乱(图4)。

图4 肥胖组和对照组小鼠天狼星红染色结果(×100)。A.肥胖组;B.对照组;心肌胶原纤维染色呈红色,与对照组相比,肥胖组小鼠心肌胶原纤维增多,排列紊乱,提示发生心肌纤维化
2.7 WGA+FITC 与对照组相比,肥胖组小鼠心脏组织中NLRP3、Caspase-1均呈高表达(图5、6)。

图5 肥胖组和对照组小鼠Caspase-1表达免疫荧光结果(×100)。A~D:肥胖组;E~H:对照组;A、E:Caspase-1染色;B、F:WGA染色;C、G:DAPI染色;D、H:Merge;心肌细胞为红色,细胞核为蓝色,Caspase-1免疫荧光为绿色,与对照组相比,心脏组织中Caspase-1明显呈高表达

图6 肥胖组和对照组小鼠NLRP3表达免疫荧光结果(×100)。A~D:肥胖组;E~H:对照组;A、E:NLRP3染色;B、F:WGA染色;C、G:DAPI染色;D、H:Merge;心肌细胞为红色,细胞核为蓝色,NLRP3免疫荧光为绿色,与对照组相比,心脏组织中NLRP3明显呈高表达
3 讨论
C57BL/6小鼠基因组数据完整,是目前实验性研究常用的近交系小黑鼠,主要应用于糖尿病、肥胖症、炎症和自身免疫性疾病研究,常作为肥胖模型复制的首选用鼠[10]。随着超声新技术的发展,新型UBM可对小鼠心脏的形态、血流动力学、心功能进行实时、动态评估,为临床试验性研究提供精确的检测结果。心肌应变是指心肌组织相对于其原始形状的变形程度,体现局部心肌的收缩功能[11]。应变技术是UBM中检测心肌功能的新技术,用于确定和跟踪心脏边界,不受心脏整体运动和角度的影响,可追踪分析心肌的各层运动,全面、定量评估心肌的收缩功能[12]。因此,本研究采用Vevo 2100 Imaging System UBM中自带的最新应变技术对高脂诱导的肥胖小鼠心肌收缩功能进行评估。
UBM检测结果显示,LVID-S、IVS-D、IVS-S、LVPW-D及LVPW-S均显著增大,提示左心室形态学已经发生改变,而病理结果显示肥胖小鼠室间隔与左心室后壁明显增厚,心肌细胞明显肥大,形态不规则,心肌纤维化形成,进一步佐证了左心室结构发生重塑改变。心室重塑描述了分子、细胞和间质结构的变化,通常在各种心肌损伤或超负荷后演变,特征是心腔几何形态的改变、心肌细胞质量增加、肌节重排、心肌细胞肥大、炎症信号传导[13]和免疫细胞激活等[14];心室壁肥厚所致心室重塑可分为向心性重塑改变和离心性重塑改变。本研究中两组LVID-D无显著差异,表示左心室向心性重塑改变,是心脏适应肥胖所致慢性容量超负荷所致,便于维持心脏正常血供,van den Berge等[15]认为肥胖主要引起向心性重塑,本研究与其相符。此外,本研究发现肥胖小鼠左心室心肌收缩功能明显下降,应变值减低,提示已经发生心肌损伤改变,其中纵向应变与圆周应变结果较径向应变结果更具有统计学意义,可能因为径向应变值所体现的心外膜下层纤维受损程度较轻。He等[16]认为心外膜下层心肌纤维是最后受灌注影响的,与本研究结果相符。
本研究免疫荧光反应显示肥胖小鼠体内NLRP3炎症小体、Caspase-1炎症因子表达水平明显升高,与Liu等[17]的研究结果一致。肥胖是引起心血管疾病的重大危险因素,会导致全身系统性慢性炎症反应,有研究[18]指出NLRP3炎症小体在心血管疾病发病机制中的重要性;Caspase-1是炎症小体相关的Caspase家族成员,在哺乳动物体内无活性,主要以酶原的形式存在于细胞质中,经NLRP3激活后作用于下游炎症相关分子[4];IL-1β是IL-1超家族的一员,是NLRP3、Caspase-1炎症小体的效应分子[19],其生物活性受炎症小体调节,而肥胖导致异常代谢产物堆积,激活炎症信号通路,其中NF-κB是调控炎症信号通路的关键,可促进NLRP3形成炎症小体,导致炎症因子表达上调,促进炎症因子pro-Caspase-1被激活成为Caspase-1,最终导致IL-1β的成熟与分泌,引起炎症反应发生[20],最终导致肥胖心肌损伤。
本研究的局限性:本实验验证NLRP3炎症小体及Caspase-1炎症因子,仅采用免疫荧光观察其表达强弱,未使用蛋白质印迹法检测其在组织中的表达情况,且未对其下游炎症因子IL-1β进行验证,存在一定的局限性。
总之,UBM及其应变技术可为肥胖小鼠心肌收缩功能检测提供实时、无创、定量检测,验证了NLRP3炎症小体和Caspase-1炎症因子与肥胖心肌细胞早期炎症有关。
利益冲突 所有作者均声明不存在利益冲突

