Sirt2抑制剂对大鼠出血性脑损伤的改善作用及其对血脑屏障通透性的影响
吴亚芳,亢崇仰,陈悦华,陆兆丰
创伤引起的出血性脑损伤在临床上较为常见,具有较高发病率、致死率,较多存活病人可遗留不同程度后遗症,严重影响生活质量[1]。出血性脑损伤的发生与脑血管病变密切相关,且发病后易出现较多并发症,其中血脑屏障通透性增加较严重[2]。现代医学治疗出血性脑损伤多以药物止血、降颅压、血肿清除术为主,但仍无法直接解决大量神经元坏死引发的神经功能缺损[3]。沉默信息调节因子2(silent-mating information regulater 2,Sirt2)是一种NAD+依赖的蛋白去乙酰化酶类,在细胞周期控制、细胞分化、DNA修复等多重生物学调节过程中发挥重要作用[4]。研究发现,Sirt2抑制剂具有神经保护作用,可减轻神经功能受损[5-6],但其对出血性脑损伤大鼠神经功能改善及血脑屏障通透性影响方面的研究较少,作用机制不明确。基于此,本研究开展动物实验,着重分析Sirt2抑制剂对出血性脑损伤大鼠的改善作用及对血脑屏障通透性的影响,并探讨其机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 选取45只健康SD雄性大鼠,8周龄,体质量260~280 g,购自北京科兴生物制品有限公司,许可证号SYXK(京)2019-0053。实验前适应性喂养7 d,环境温度(22±2)℃,相对湿度45%~60%,光照周期12 h/12 h,自由获得饮水、饲料。本研究经动物伦理委员会批准,动物处置符合“3R”原则。
1.1.2 药物、试剂和仪器 Sirt2抑制剂AK-7(美国Gene Operation公司),戊巴比妥钠(美国Sigma公司),伊文思蓝染料(美国Amerso公司),白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)试剂盒(湖北武汉塞维尔公司),苏木精-伊红(hematoxylin-eosin staining,HE)试剂盒(美国Genmed公司),蛋白质印迹法检测试剂盒(美国KPL公司),二喹啉甲酸法(BCA)蛋白试剂盒(湖北武汉富鑫远科技有限公司),兔抗大鼠Sirt2、核转录因子-κB p65(nuclear factor-κB,NF-κB p65)、磷酸化NF-κB p65(phosphorylate-NF-κB p65,p-NF-κB p65)一抗及山羊抗兔IgG二抗(美国Santa Cruz公司)。HN550型冷冻切片机(德国Microtome Cryostat),XB51-32H01型病理图像分析系统(日本奥林巴斯株式会社),XSZ-H-9507285显微镜(重庆光学仪器厂),DG5031酶联免疫酶标仪(华东电子医疗公司)。
1.2 实验方法
1.2.1 模型制备及分组 从45只大鼠中随机取15只作为假手术组,另30只建立出血性脑损伤模型[7]:大鼠以2%戊巴比妥钠50 mg/kg(0.25 mL/100 g)腹腔注射麻醉,仰卧位固定在手术台上。顶毛剃除,75%乙醇消毒。于头皮正中作1 cm切口,骨膜剪开,前囟暴露。钻孔点为前囟前0.2 mm、中线旁开2 mm处,用1 mL注射器沿钻孔口缓慢进针至尾状核。以0.28 μL含0.5 U/μL的Ⅶ型胶原酶及6.25 U/μL肝素的生理盐水缓慢注射,注射时间3 min,留针10 min后缓慢拔针,后骨蜡填充钻孔,生理盐水冲洗干净,缝合皮肤。大鼠清醒后,采用神经功能缺陷评分(Neurological Severity Scores,NSS)评估神经功能损伤情况[8],神经功能无异常,计0分;提尾时左前肢明显屈曲,计1分;大鼠行走时不自主向左侧转圈,计2分;大鼠行走时不自主向左侧倾斜,计3分;大鼠意识减退,无自发行走,计4分。以NSS评分1~3分为建模成功。30只大鼠建模成功24只,成功率为80%。24只大鼠随机分为模型组与Sirt2抑制剂组,每组12只。假手术组术中仅注射等量生理盐水,其余操作步骤同模型组、Sirt2抑制剂组,术后NSS评分0分入选,15只大鼠均纳入研究。
1.2.2 干预方法 建模成功后立即给药,Sirt2抑制剂组以25 mg/kg体质量Sirt2抑制剂AK-7(用生理盐水稀释至0.25 mL)腹腔注射,假手术组、模型组以等体积生理盐水腹腔注射,均给药1次。
1.2.3 取材、处理 各组给药后24 h,采用NSS评分法评估神经功能损伤。完成评估后,以2%戊巴比妥钠50 mg/kg(0.25 mL/100 g)腹腔注射麻醉,断头处死。各组分别选择4只大鼠,取脑组织,分为3份,2份置于液氮保存,用于炎性因子、蛋白表达检测;1份置于4%多聚甲醛固定,用于HE染色。各组剩余大鼠中随机选择4只,剥取完整脑组织,置于干净滤纸,表面渗液、血迹去除,称重,记为湿重;置于60 ℃烘箱烘烤48 h,取出称重,记为干重。以干湿法测定脑组织湿重/干重(wet/dry weight ratio,W/D)值。各组剩余大鼠取4只行血脑屏障通透性检测。
1.2.4 炎性因子IL-6、TNF-α水平检测 采用ELISA法检测炎性因子IL-6、TNF-α水平。取液氮保存脑组织,生理盐水冲洗,冰浴下制备10%组织匀浆。4 ℃、12 000 r/min离心,离心半径8 cm,10 min,取上清液。严格按照IL-6、TNF-α试剂盒说明书步骤操作:相应反应孔内加不同程度标准品100 μL、标本100 μL,37 ℃,温育,2 h。甩干板内液体,洗涤4次。各孔加100 μL一抗工作液,混匀,37 ℃,温育,1 h。甩干板内液体,洗涤4次。各孔加100 μL酶标工作液,混匀,37 ℃,温育,30 min。甩干板内液体,洗涤4次。各孔加100 μL底物工作液,混匀,37 ℃,温育,15 min。各孔加100 μL终止液,反应10 min。20 min内观察酶标仪450 nm波长处吸光度值。将标准品浓度作为横坐标,吸光度值作为纵坐标,绘制标准曲线,根据标本吸光度值获得浓度值。
1.2.5 脑组织病理形态学检测 采用HE染色法检测脑组织病理形态。取4%多聚甲醛固定脑组织,生理盐水冲洗,磷酸缓冲盐溶液(PBS)浸泡12 h。脱水,石蜡包埋,切片,厚度4 μm,烤干。二甲苯透明,梯度乙醇脱蜡,水洗。苏木精染色5 min,1%盐酸乙醇分化,流水冲洗,共30 min。伊红染色,流水冲洗,梯度乙醇脱蜡。二甲苯透明,中性树胶封片。显微镜下观察大鼠脑组织病理形态学。
1.2.6 血脑屏障通透性检测 采用伊文思蓝灌注染色法检测血脑屏障通透性。各组所选大鼠以2%溶于生理盐水的伊文思蓝染料4 mL/kg静脉注射,静待2 h,观察大鼠四肢末梢、结膜、齿龈、尾部呈蓝色后,以2%戊巴比妥钠50 mg/kg(0.25 mL/100 g)腹腔注射麻醉。自大鼠左心室插入灌注针,止血钳固定。右心耳剪破,以250 mL生理盐水缓慢自左心室灌注,清除脑血管内残留血液,以右心耳流出清亮液体为止。大鼠断头处死,快速将出血侧脑半球组织取出,脑表面以生理盐水冲洗,避免杂质、血迹影响吸光度值。出血侧脑半球组织称重,置入1 mL/100 mg甲酰胺,37 ℃,48 h。低温离心,观察酶标仪620 nm波长处吸光度值。通过倍比稀释法绘制标准曲线,将所得吸光度值转换为伊文思蓝染料含量,进行血脑屏障通透性评估。
1.2.7 脑组织Sirt2、NF-κB p65、p-NF-κB p65蛋白相对表达量检测 采用蛋白质印迹法检测脑组织Sirt2、NF-κB p65、p-NF-κB p65蛋白相对表达量。取液氮保存脑组织,PBS冲洗2次。加RIPA裂解液,冰上裂解30 min。4 ℃,12 000 r/min离心,离心半径10 cm,8 min,取上清液。BCA试剂盒行蛋白定量,加2×上样缓冲液。沸水浴10 min,变性。10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳,分离蛋白,转至聚偏二氟乙烯(PVDF)膜,加5%脱脂奶粉封闭1 h。加兔抗大鼠Sirt2、NF-κB p65、p-NF-κB p65(1∶1 000)一抗,4 ℃摇床孵育,过夜。TBST洗膜4次,每次10 min。加二抗(1∶2 500),室温孵育,共2 h。TBST洗膜4次,每次10 min。加化学发光法(ECL)检测试剂,成像仪曝光成像。经目的蛋白条带灰度值/β-actin条带灰度值比值计算目的蛋白表达水平。
2 结 果
2.1 3组大鼠NSS评分比较 与模型组比较,Sirt2抑制剂组NSS评分降低(P<0.05)。详见表1。
表1 3组大鼠NSS评分比较(±s) 单位:分
2.2 3组大鼠IL-6、TNF-α水平比较 与假手术组比较,模型组、Sirt2抑制剂组IL-6、TNF-α水平升高(P<0.05);与模型组比较,Sirt2抑制剂组IL-6、TNF-α水平降低(P<0.05)。详见表2。
表2 3组大鼠IL-6、TNF-α水平比较(±s) 单位:pg/mL
2.3 3组大鼠脑组织W/D值比较 与假手术组比较,模型组、Sirt2抑制剂组脑组织W/D值升高(P<0.05);与模型组比较,Sirt2抑制剂组脑组织W/D值降低(P<0.05)。详见表3。
表3 各组脑组织W/D值比较(±s)
2.4 3组大鼠脑组织形态比较 HE染色显示,假手术组脑组织结构无异常,神经细胞有序排列,染色较均匀,无炎性细胞浸润。模型组脑组织结构紊乱,出现局部出血、水肿,损伤脑组织区伴大量炎性细胞浸润。与模型组比较,Sirt2抑制剂组脑组织结构紊乱、局部出血、水肿、炎性细胞浸润等现象明显改善。详见图1。
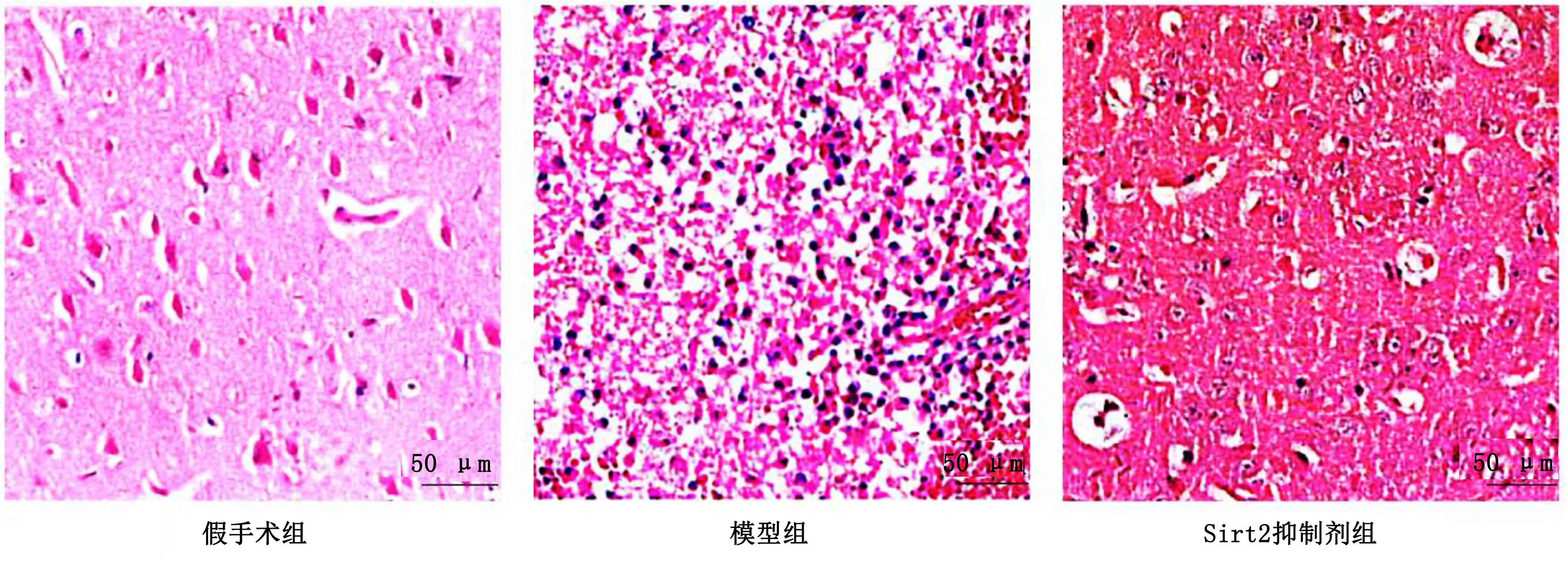
图1 各组大鼠脑组织病理形态学变化比较(HE,×400)
2.5 3组大鼠血脑屏障通透性比较 与假手术组比较,模型组、Sirt2抑制剂组大脑皮层、基底节区伊文思蓝含量升高(P<0.05);与模型组比较,Sirt2抑制剂组大脑皮层、基底节区伊文思蓝含量降低(P<0.05)。详见表4。

表4 3组大鼠血脑屏障通透性比较(±s) 单位:μg/g
2.6 3组大鼠Sirt2、NF-κB p65、p-NF-κB p65蛋白相对表达量比较 与假手术组比较,模型组、Sirt2抑制剂组Sirt2、p-NF-κB p65蛋白相对表达量升高(P<0.05);与模型组比较,Sirt2抑制剂组Sirt2、p-NF-κB p65蛋白相对表达量降低(P<0.05)。详见图2、表5。
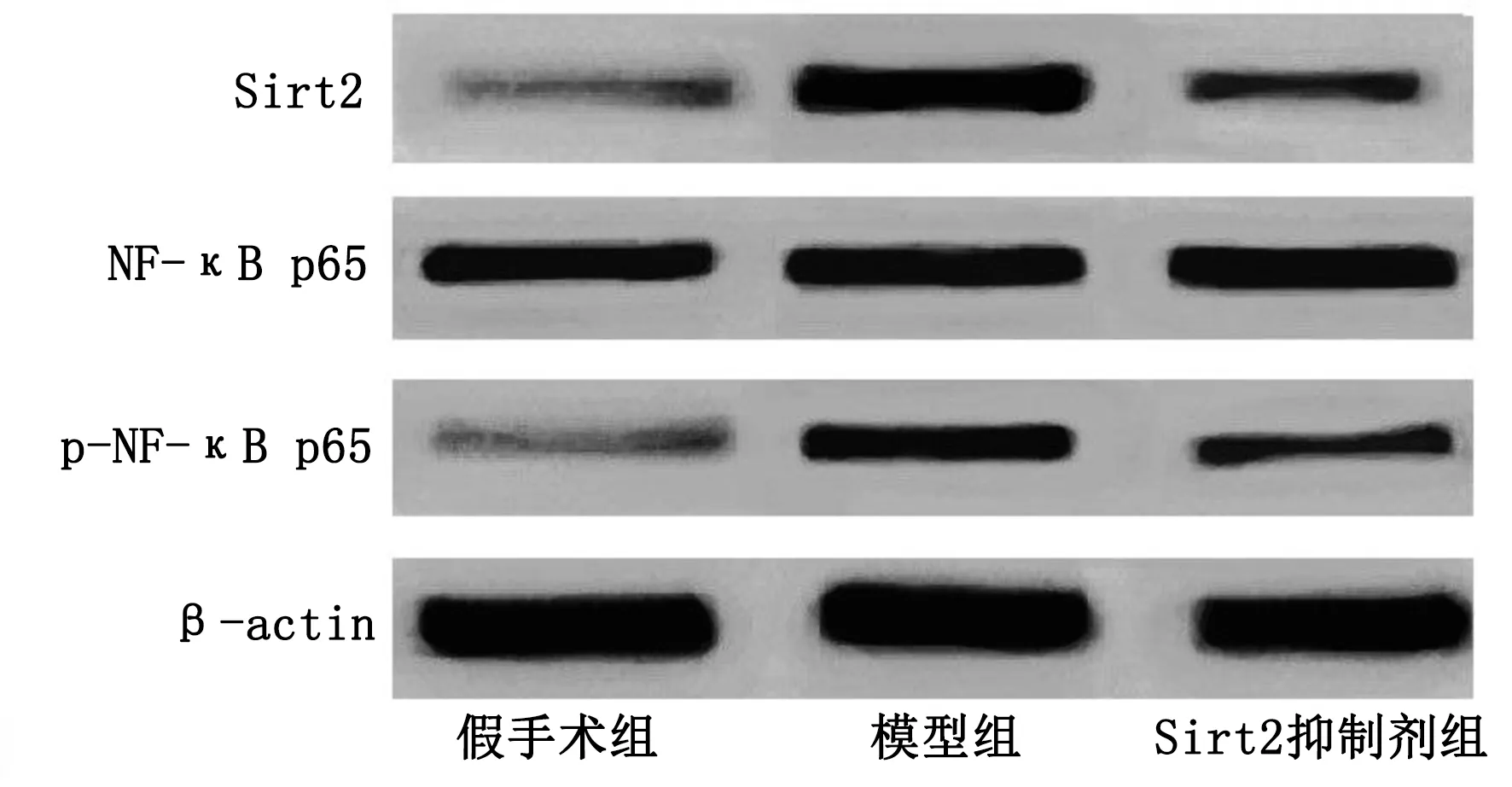
图2 3组大鼠Sirt2、NF-κB p65、p-NF-κB p65蛋白表达条带图
表5 3组大鼠Sirt2、NF-κB p65、p-NF-κB p65蛋白相对表达量比较(±s)
3 讨 论
脑出血是一种常见的急危重症,其发生、发展是一个多层次、多因素的复杂过程,而脑出血后继发性脑损伤是导致病人残疾、死亡的主要原因[9]。目前认为出血性脑损伤发生机制复杂,包括细胞毒性物质释放、炎症反应、血脑屏障破坏等[10]。脑出血后,血脑屏障被破坏,发病3 h至14 d内,血肿周围水肿持续增加,这是脑出血后致残、致死的重要病理基础[11]。另外,脑出血后继发的炎症反应在血脑屏障紊乱中也具有重要作用。因此,临床上尽早诊治出血性脑损伤病人,寻求新的治疗靶点,减轻神经功能损伤,控制血脑屏障破坏,已成为研究热点之一。
Sirtuins属于蛋白去乙酰化酶类,可调控代谢、细胞分裂、老化等细胞和生物过程,而Sirt2为Sirtuins家族成员之一,主要定位于细胞质[12]。在神经系统方面,虽有研究发现Sirt2敲除可引发髓鞘形成减慢[13],但目前仍不知激活Sirt2在促进损伤神经髓鞘再生中是否有作用。另外,也有报道显示,在神经退行性疾病中,Sirt2抑制剂通过对固醇合成进行抑制从而发挥神经保护作用[14]。可见,Sirt2抑制剂对神经损伤的功能目前研究少且存在争议,可能是脑损伤后潜在的治疗靶点。本研究发现,应用Sirt2抑制剂治疗后,大鼠NSS评分、W/D值及IL-6、TNF-α水平降低,大脑皮层、基底节区伊文思蓝含量减少;进一步分析脑组织病理形态学,发现Sirt2抑制剂组脑组织结构紊乱、局部出血、水肿、炎性细胞浸润等现象明显改善,提示Sirt2抑制剂可改善出血性脑损伤大鼠神经功能,减轻炎症反应、脑水肿,降低血脑屏障通透性,控制脑组织损伤。
NF-κB是一种含多向转录调节作用的核蛋白因子,可参与炎症、氧化应激、细胞凋亡等病理过程。相关报道显示,Sirt2可参与NF-κB信号通路,且在细胞凋亡、炎症反应、多种糖脂代谢等方面发挥重要作用[15]。有学者提出,Sirt2在应激条件下,可通过对NF-κB去乙酰化,调节细胞应激所致损伤[16]。还有学者发现,Sirt2/NF-κB信号通路可参与免疫、炎症介导的神经损伤,机制可能是Sirt2能对NF-κB活性进行抑制,阻碍依赖NF-κB激活转录的炎性细胞因子释放,以减轻炎症反应[17]。这些研究均提示Sirt2/NF-κB信号通路可能在出血性脑损伤中有一定作用。本研究发现,应用Sirt2抑制剂后,大鼠Sirt2、p-NF-κB p65蛋白相对表达量均降低,提示Sirt2抑制剂能对Sirt2/NF-κB信号通路进行抑制,这可能是Sirt2抑制剂发挥改善大鼠出血性脑损伤、降低血脑屏障通透性的重要作用机制之一。
综上所述,Sirt2抑制剂可改善出血性脑损伤大鼠神经功能,减轻炎症反应、脑水肿,降低血脑屏障通透性,作用机制可能与抑制Sirt2/NF-κB信号通路有关。本研究存在一定不足之处,如研究局限于大鼠,并未实际应用到临床,且Sirt2抑制剂对大鼠出血性脑损伤改善作用及对血脑屏障通透性影响途径较多,本研究并未就其他作用机制进行分析,今后仍需进一步深入研究。

