清热消癥方对糖尿病肾病大鼠肾损伤的保护作用研究
王玉洁 ,王健 ,周静威
糖尿病肾病(diabetic kidney disease,DKD)是糖尿病常见的微血管并发症,也是导致慢性肾病及终末期肾脏病(end stage renal disease,ESRD)的主要病因,30%~40%的糖尿病患者会发展为DKD[1-2]。研究表明,细胞衰老和凋亡是DKD发病和进展的重要机制[3-4]。研究发现DKD患者肾小管上皮细胞衰老相关蛋白p16的表达变化与其肾组织损伤程度及肾功能均存在显著关系[5]。动物实验发现,DKD大鼠肾组织中凋亡相关蛋白Caspase-3 mRNA水平显著增加[6]。多项研究证实,中医药可以通过抑制肾脏细胞衰老和凋亡,改善DKD肾损伤[7-13]。因此,运用中医药抑制肾脏细胞衰老和凋亡,可能成为延缓DKD进展的新策略。
清热消癥方是北京中医药大学东直门医院肾病专家王耀献教授多年来治疗DKD的经验方,他认为“热邪”是DKD发病的主要病因,“伏热致癥”是DKD的核心病机,尤其在DKD中期,热伏肾络,结为癥瘕,故立清热消癥法[14],以清解内积热邪,消散肾络癥瘕。前期临床研究发现清热消癥法在降低DKD中期患者的中医证候评分和尿蛋白排泄量方面具有较好的临床效果[15]。课题组体内实验表明清热消癥方可以调控肠源性脂多糖(lipopolysaccharide,LPS)介导的下游炎症通路,降低炎性因子toll样受体4(toll-like receptor 4,TLR4)和核因子κB(nuclear factor kappa-B,NF-κB)的表达以及肠源性LPS水平,调节DKD小鼠的肠道菌群,降低DKD小鼠蛋白尿,抑制DKD肾损伤,发挥肾保护作用[16]。中药的化学成分多样,靶点繁多,因此本研究旨在通过动物体内实验进一步明确清热消癥法是否可以通过抑制肾脏细胞衰老和凋亡,改善DKD肾损伤,延缓DKD进展。
1 材料与方法
1.1 实验动物 2019年7—11月选用SPF级健康雄性SD大鼠30只,8周龄,体质量(180±20)g,购自维通利华(北京)实验动物技术有限公司〔SCXK(京)2012-0001〕。将大鼠饲养于北京中医药大学东直门医院屏障环境动物实验室〔SCXK(京)2015-0001〕,室温22~25 ℃,湿度45%~60%,光照条件为明/暗交替循环12 h,大鼠自由饮水和饮食,适应性喂养3 d。本实验由北京中医药大学东直门医院动物实验伦理委员会批准(编号:19-41)。
1.2 实验试剂与仪器 链脲佐菌素(streptozotocin,STZ)(货号:s0130),购自美国Sigma公司;柠檬酸缓冲液(货号:C1013)、Masson染液(货号:G1346)和糖原(PAS)染色液试剂盒(货号:G1281)购自索莱宝公司;苏木素-伊红(H-E)染液(货号:D006-1-2)购自南京建成生物工程研究所;尿微量白蛋白试剂盒(货号:ab235642)、p16抗体(货号:ab51243)购自美国Abcam公司;Caspase-3抗体(货号:19677-1-AP)购自Proteintech公司;一步法原位末端脱氧核苷酸转移酶标记技术(TUNEL)细胞凋亡检测试剂盒(货号:C1088)、蛋白酶K(货号:ST532)购自上海碧云天生物科技有限公司;山羊血清(ZLI-9056)、内源性过氧化物酶阻断剂、反应增强液、增强酶标山羊抗兔/鼠IgG聚合物(PV-9001/PV-9002)、荧光封片剂(含DAPI)(ZLI-9557)、中性快干胶封片剂(ZLI-9516)购自北京中杉金桥生物技术有限公司。AU480全自动生化仪(日本奥林巴斯)全自动组织处理系统(美国美天旎公司),RM2135病理切片机,烤片机(德国Leica公司),BX60型显微镜(日本Olympus公司)。
1.3 中药制备 清热消癥方药物组成:黄芪30 g、黄蜀葵花30 g、熟大黄3 g、黄芩10 g、水蛭5 g、土鳖虫10 g,购自北京中医药大学东直门医院中药库,中药煎煮后水浴浓缩为1 g/ml,4 ℃冷藏备用,水煎煮和浓缩程序按照《中国药典》2010版规定执行。采用体表面积系数换算大鼠灌胃给药剂量,以成年人70 kg,大鼠200 g,换算系数6.3计算[17],中药浓度为7.92 g·kg-1·d-1。
1.4 实验方法
1.4.1 DKD大鼠模型建立 30只大鼠适应性喂养3 d后,随机分为假手术组(NC组,n=10)和模型组(n=20)。在NC组大鼠右肾体表解剖位置,做长约1 cm的横行切口并缝合。模型组大鼠予右侧肾切除,1周后观察伤口愈合后,腹腔注射STZ造模。55 mg STZ溶解于柠檬酸缓冲液中,配置成1%的STZ溶液。根据参考文献[18-19]的方法,将模型组20只大鼠禁食不禁水12 h后,单次腹腔注射STZ(55 mg/kg)构建DKD模型。NC组大鼠注射等体积柠檬酸缓冲液。3 d后测定模型组大鼠尾静脉血糖,留取DKD模型大鼠24 h尿液,若随机血糖>16.7 mmol/L,24 h尿蛋白定量>30 mg/L,则表明DKD模型建立成功。
1.4.2 分组及给药 将模型组大鼠随机分为DKD亚组和清热消癥方亚组(QRXZF亚组),每组10只。NC组和DKD亚组大鼠灌服等量(1 ml/100 g)0.9%氯化钠溶液,1次/d。QRXZF亚组大鼠以7.92 g/kg的剂量进行中药灌胃,1次/d。干预期为16周。
两组产妇在进行剖宫产的时候,均采用腰硬联合麻醉的方式,选择美容切口,将产妇的皮肤全层进行横向切开,长度控制在10 cm~12 cm之间,在切口郑重的位置将脂肪层切开,深度为2 cm,在触及筋膜层之后,对两侧进行撕拉分离,将产妇的筋膜充分的暴露出来,然后将筋膜进行横向切开,分离产妇耻骨连接处的肌腱,避开产妇的脂肪,将膀胱推开,对产妇的子宫下段切开,实现胎儿的分娩,随后对产妇的子宫进行彻底的清理,进行逐层缝合[3]。在两组产妇经过手术之后,对其各项资料进行回顾性分析,进行详细的记录。
1.4.3 血、尿、肾组织标本留取和指标检测 干预期间每周测量各组大鼠体质量。干预16周末次给药后,测量大鼠体质量,收集大鼠24 h尿液记录尿量,离心转速为3 000 r/min,离心半径13.5 cm,4 ℃离心10 min后,采用酶联免疫吸附试验(ELISA)测定大鼠尿微量白蛋白,根据尿量计算大鼠24 h尿微量白蛋白。打开大鼠腹腔,腹主动脉取血,离心条件同前,离心10 min后,取上层血清,全自动生化分析仪测量各组大鼠血肌酐(Scr)、血清尿素氮(BUN)和血清白蛋白(ALB);摘取肾脏并称量肾脏重量,各组大鼠只留取左肾作为标本,肾重指数=肾脏重量/体质量×1 000。肾组织石蜡包埋,切成厚度2 µm的切片备用。
1.4.4 HE染色 HE染色具体步骤如下:(1)肾组织石蜡切片于60 ℃烤片机烤片1 h,新鲜二甲苯Ⅰ/Ⅱ/Ⅲ脱蜡3次,10 min/次。(2)100%、95%、80%、75%梯度乙醇水化各3 min,磷酸盐缓冲液(PBS)洗3次,5 min/次。(3)苏木素染细胞核5 min,自来水冲洗2 min,1%盐酸乙醇分化3 s,自来水冲洗15 min,返蓝。(4)伊红染色8 min,95%、95%、100%、100%梯度乙醇脱水各3 min。(5)二甲苯Ⅰ/Ⅱ/Ⅲ各透明1次,10 min/次。中性树胶封固,通风橱晾干后,在光镜下对肾脏组织切片进行观察和分析。
1.4.5 PAS染色 PAS染色具体步骤如下:(1)肾组织常规烤片、脱蜡、水化同上,双蒸水浸洗2次,5 min/次。(2)滴加氧化剂室温反应8 min。自来水冲洗1次,蒸馏水浸洗2次。(3)滴加Schiff染液,避光浸染20 min。自来水冲洗10 min。苏木素染核2 min。酸性分化液分化2 s。自来水冲洗10 min返蓝。脱水、透明同前,树胶封固。PAS染色后,每张切片随机挑选至少3个200倍视野并采集图像进行肾小球硬化水平评分。评分标准如下:0分,无硬化症;1分,≤10%的肾小球硬化;2分,>10%,≤25%的肾小球硬化;3分,>25%~50%的肾小球硬化;4分,>50%的肾小球硬化。
1.4.6 Masson染色 Masson染色具体步骤如下:(1)肾组织常规烤片、脱蜡、水化同上,媒染液室温过夜媒染。(2)次日流水冲洗10 min,滴加天青石蓝染色液染色2~3 min,水洗2次,15 s/次。(3)Mayer苏木素染核3 min,双蒸水洗2次,10~15 s/次。酸性乙醇分化液分化3 s至组织完全变红,水洗终止分化,双蒸水冲洗10 min。(4)丽春红染色10 min,双蒸水洗2次,15 s/次。(5)磷钼酸溶液处理约10 min。倾去上液,滴加苯胺蓝染色液染色5 min。(6)弱酸溶液洗去苯胺蓝后,继续滴加弱酸处理2 min。(7)脱水、透明、封固同前。每张切片随机挑选至少3个200倍视野并采集图像,使用Image-Pro Plus 6.0软件检测肾脏组织蓝色胶原纤维面积百分比。
1.4.7 免疫组化法(IHC)检测肾组织中p16和Caspase-3表达 IHC具体步骤如下:(1)肾组织常规烤片、脱蜡和水化。(2)95 ℃的柠檬酸盐抗原修复液修复20 min。(3)滴加100 µl内源性过氧化物酶阻滞剂,室温孵育10 min;PBS洗5 min,重复3次。(4)100 µl山羊血清,湿盒中37 ℃封闭30 min。(5)滴加p16(1∶50)和Caspase-3抗体(1∶100),湿盒中4 ℃冰箱孵育过夜。(6)次日恢复室温20 min,滴加100 µl反应增强液剂,37 ℃孵育30 min。PBS洗3次,5 min/次。(7)滴加羊抗兔或者羊抗小鼠二抗,37 ℃孵育30 min后PBS洗涤,方法同上。(8)DAB染色约1 min,用双蒸水终止反应后,苏木素染核8 min。脱水、透明、封固同前。每张切片随机挑选至少3个200倍视野并采集图像。p16和Caspase-3阳性表达通过Image-Pro Plus 6.0软件进行半定量分析,检测累积光密度值(IOD)和阳性面积(Area),取二者比值为表达水平。
1.4.8 TUNEL法检测肾小管细胞凋亡率 (1)肾组织常规烤片、脱蜡和水化。(2)滴加20 µg/ml不含DNase的蛋白酶K〔碧云天ST532/ST533蛋白酶K(20 mg/ml),用P0106免疫染色洗涤液或10 mmol/L Tris-HCl pH 7.4~7.8稀释1 000倍即为20 µg/ml不含DNase的蛋白酶K〕,20~37 ℃作用15 min。(3)PBS洗涤3次。在样品上加50 µl TUNEL检测液,37 ℃避光孵育60 min。PBS洗涤3次。(4)含DAPI的抗荧光淬灭封固液封片后荧光显微镜下观察。每张切片随机挑选至少3个400倍视野并采集图像。通过Image J对绿色凋亡细胞和蓝色细胞核进行细胞计数,取二者比值的百分数为凋亡率。
2 结果
2.1 各组大鼠体质量和肾重指数结果 各组大鼠体质量和肾重指数比较,差异均有统计学意义(P<0.01);其中DKD亚组、QRXZF亚组体质量均低于NC组,肾重指数均高于NC组(P<0.01);QRXZF亚组体质量高于DKD亚组、肾重指数低于DKD亚组(P<0.01),差异均有统计学意义,见表1。
表1 各组大鼠体质量、肾重指数水平比较(±s)Table 1 Comparison of body weight and kidney weight index in rats in control group,DKD and QRXZF subgroups

表1 各组大鼠体质量、肾重指数水平比较(±s)Table 1 Comparison of body weight and kidney weight index in rats in control group,DKD and QRXZF subgroups
注:NC组=假手术组,DKD亚组=糖尿病肾病亚组,QRXZF亚组=清热消癥方亚组;a表示与NC组相比P<0.01,b表示与DKD亚组相比P<0.01;因血清样本时有溶血,以及剔除异常值后,为保证各组样本量一致,各组选取样本时n=6
组别 只数 体质量(g) 肾重指数(%)NC组 6 488.83±36.71 2.80±0.10 DKD 亚组 6 230.33±38.61a 11.11±0.93a QRXZF 亚组 6 318.67±40.89ab 9.13±1.04ab F值 68.92 127.93 P值 <0.01 <0.01
2.2 各组大鼠24 h尿微量白蛋白、Scr、BUN和ALB结果 各组大鼠24 h尿微量白蛋白、Scr、BUN和ALB比较,差异均有统计学意义(P<0.05);其中DKD亚组24 h尿微量白蛋白、Scr、BUN水平均高于NC组,ALB水平低于NC组(P<0.01);QRXZF亚组24 h尿微量白蛋白、BUN水平均高于NC组,ALB水平低于NC组(P<0.01);QRXZF亚组24 h尿微量白蛋白、Scr、BUN水平均低于DKD亚组,ALB水平高于DKD亚组,差异均有统计学意义(P<0.01),见表2。
表2 各组大鼠Scr 、BUN、ALB和24 h尿微量白蛋白水平比较(±s)Table 2 Comparison of the levels of Scr,BUN,ALB and 24 h Upro in rats in control group,DKD and QRXZF subgroups
表2 各组大鼠Scr 、BUN、ALB和24 h尿微量白蛋白水平比较(±s)Table 2 Comparison of the levels of Scr,BUN,ALB and 24 h Upro in rats in control group,DKD and QRXZF subgroups
注:Scr=血肌酐,BUN=尿素氮,ALB=白蛋白;a表示与NC组相比P<0.01,b表示与DKD亚组相比P<0.01;因血清样本时有溶血,以及剔除异常值后,为保证各组样本量一致,各组选取样本时n=6
ALB(g/L)NC 组 6 20.35±5.00 27.50±4.22 5.41 ± 0.28 27.9±1.95 DKD亚组 6 68.15±12.70a 44.45±6.46a 24.47±3.06a 22.55±0.69a QRXZF亚组 6 41.19±7.0ab 31.90±4.09b 14.40±2.60ab 25.68±1.16ab F值 26.55 10.22 54.98 23.09 P值 <0.01 <0.01 <0.01 <0.01组别 只数24 h尿微量白蛋白(mg/L)Scr(µmol/L)BUN(mmol/L)
2.3 各组大鼠肾脏组织病理染色结果
2.3.1 HE染色结果 HE染色可见:DKD亚组肾小球肥大,系膜细胞及系膜基质增生,肾小管上皮细胞空泡变性;QRXZF亚组大鼠肾脏病理变化程度明显轻于DKD亚组;NC组大鼠肾小球、肾小管及系膜基质未见明显病理变化,详见图1。
2.3.2 PAS染色结果 PAS染色可见:NC组大鼠肾小球均匀光滑,肾小管基膜及系膜基质无明显病理性改变,肾小球血管袢薄,未见肾小球肥大及肾小管管型。DKD亚组大鼠肾组织损伤明显,肾小球基底膜明显增厚,系膜细胞及基质增多,部分肾小管出现空泡样病变,管腔扩张,可见肾间质水肿。QRXZF亚组大鼠肾小球基底膜较NC组轻度增厚,肾小管管腔轻度扩张,系膜细胞增多不明显,详见图1。对PAS染色进行量化评分发现,NC组PAS肾小球硬化评分为(0.68±0.47)分,DKD亚组为(3.36±0.49)分,QRXZF亚组为(1.50±0.51)分,各组PAS肾小球硬化评分比较,差异有统计学意义(F=170.42,P<0.01);其中DKD亚组和QRXZF亚组PAS肾小球硬化评分高于NC组,QRXZF亚组PAS肾小球硬化评分低于DKD亚组,差异均有统计学意义(P<0.01)。
2.3.3 Masson染色结果 Masson染色可见:DKD亚组肾小管严重萎缩,肾小球、小管及间质出现大量蓝色胶原纤维;QRXZF亚组大鼠肾小球及间质存在少量蓝色胶原沉积物,肾小管轻度萎缩;NC组大鼠肾小球基底膜、系膜基质均正常,未见间质纤维化,详见图1。对各组大鼠肾组织Masson染色阳性区域面积进行定量分析,NC组蓝色胶原纤维面积百分比为(11.96±0.42)%,DKD亚 组 为(25.51±1.42)%,QRXZF亚 组 为(16.10±0.55)%,各组蓝色胶原纤维面积百分比比较,差异有统计学意义(F=1102.28,P<0.01);其中DKD亚组和QRXZF亚组蓝色胶原纤维面积百分比均高于NC组,QRXZF亚组蓝色胶原纤维面积百分比低于DKD亚组,差异均有统计学意义(P<0.01)。

图1 各组大鼠肾脏组织形态学变化(×200)Figure 1 Renal morphological changes of rats in control group,DKD and QRXZF subgroups
2.4 各组大鼠p16和Caspase-3 IHC染色结果
2.4.1 各组大鼠IHC肾组织p16检测 NC组大鼠肾组织p16表达水平为(0.12±0.01),DKD亚组大鼠肾组织p16表达水平为(0.42±0.02),QRXZF亚组大鼠肾组织p16表达水平为(0.20±0.01)。三组大鼠肾组织p16表达水平比较,差异有统计学意义(F=2 138.86,P<0.01);其中DKD亚组、QRXZF亚组肾组织p16表达水平高于NC组,QRXZF亚组肾组织p16表达水平低于DKD亚组,差异均有统计学意义(P<0.01),见图2。
2.4.2 各组大鼠IHC肾组织Caspase-3检测 NC组大鼠肾组织Caspase-3表达水平为(0.10±0.02),DKD亚组大鼠肾组织Caspase-3表达水平为(0.62±0.08),QRXZF亚组大鼠肾组织Caspase-3表达水平为(0.18±0.02)。三组大鼠肾组织Caspase-3表达水平比较,差异有统计学意义(F=913.54,P<0.01)。其中DKD亚组、QRXZF亚组肾组织Caspase-3表达水平高于NC组,QRXZF亚组肾组织Caspase-3表达水平低于DKD亚组,差异均有统计学意义(P<0.01),见图2。
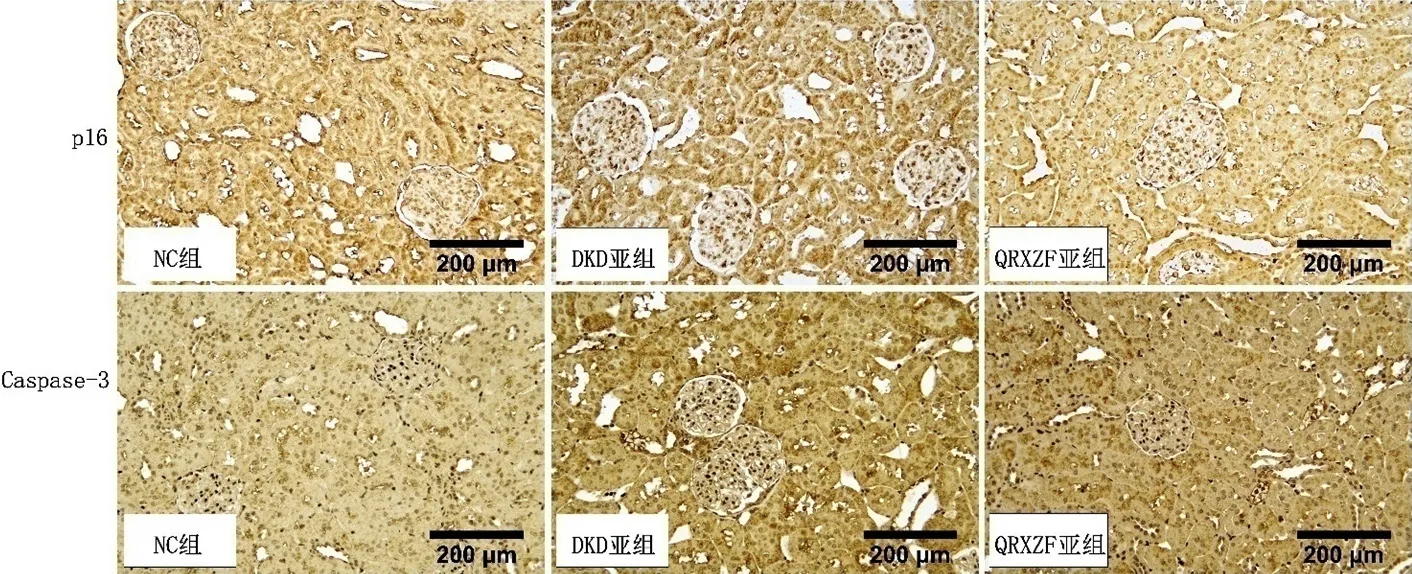
图2 各组大鼠肾组织p16和Caspase-3表达(×200)Figure 2 Expression levels of p16 and Caspase-3 in renal tissue of rats in control group,DKD and QRXZF subgroups
2.5 各组大鼠肾小管细胞凋亡情况比较 NC组大鼠肾小管细胞凋亡率为(1.50±0.19)%,DKD亚组大鼠肾小管细胞凋亡率为(12.49±0.83)%,QRXZF亚组大鼠肾小管细胞凋亡率为(5.11±0.75)%。三组大鼠肾小管细胞凋亡率比较,差异有统计学意义(F=1 533.96,P<0.01)。其中DKD亚组、QRXZF亚组大鼠肾小管细胞凋亡率高于NC组,QRXZF亚组肾小管细胞凋亡率低于DKD亚组,差异均具有统计学意义(P<0.01),见图3。
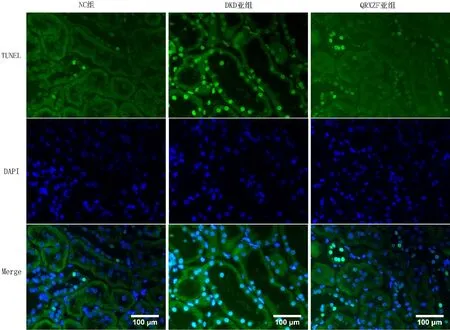
图3 各组大鼠肾组织肾小管细胞凋亡情况(×400)Figure 3 Apoptosis of renal tubular cells in renal tissue of rats in control group,DKD and QRXZF subgroups
3 讨论
研究证实肾脏细胞衰老和凋亡是DKD发生、发展的重要原因[20]。高糖可导致肾小球系膜细胞过早衰老[21],衰老与肾纤维化密切相关。2型糖尿病患者的肾脏近端小管可见大量衰老细胞,其肾小球中p16INK4A表达与蛋白尿水平呈正相关[22]。研究证实,抑制p16可减轻衰老相关的分泌表型SASP(senescence-associated secretory phenotype)的表达[23],抑制p16等衰老相关因子的表达,改善DKD肾损伤[24-25]。本研究对各组大鼠肾组织进行衰老相关蛋白p16的IHC检测发现,与NC组相比,DKD亚组和QRXZF亚组p16阳性染色明显更深,且QRXZF亚组明显低于DKD亚组。本研究结果发现清热消癥方可以有效减少DKD大鼠肾组织中p16的表达。
Caspase-3是关键的凋亡因子,处于Caspase级联反应的末端,并被细胞凋亡的内在和外在死亡途径激活,活化的Caspase-3可降解细胞内结构蛋白和功能蛋白,诱导细胞死亡[26]。细胞凋亡会导致肾细胞外基质沉积、肾小管上皮细胞肥大以及肾小球膜扩张,直至肾小管间质纤维化和肾小球硬化[27-28]。本研究采用凋亡试剂盒对大鼠肾小管进行凋亡细胞检测,结果发现,DKD亚组大鼠凋亡细胞率明显高于NC组和QRXZF亚组。IHC结果显示,Caspase-3在DKD大鼠肾组织中的阳性面积明显大于NC组和QRXZF亚组,说明清热消癥方可以减少肾脏细胞凋亡。
本研究发现清热消癥方可以降低DKD大鼠24 h尿微量白蛋白水平。在肾功能指标方面,与NC组相比,DKD亚组大鼠Scr和BUN显著升高,而QRXZF亚组明显低于DKD亚组,说明清热消癥方可以促进肾脏代谢,保护DKD大鼠的肾功能。本研究还发现DKD亚组大鼠出现消瘦和肾脏肥大,其体质量低于NC组和QRXZF亚组,而肾重指数则明显高于其他两组。因此,笔者认为清热消癥方可以改善DKD大鼠消瘦状况,减少肾小球肥大。HE染色发现,DKD亚组大鼠肾脏基底膜增厚,系膜细胞和基质增厚,肾小管扩张等。Masson染色提示,DKD亚组大鼠肾小管和间质蓝色胶原沉积较其他两组更明显,QRXZF亚组蓝色胶原面积较少,说明清热消癥方可以减少高糖环境引起的胶原沉积,改善肾脏纤维化。PAS染色发现,QRXZF亚组肾小球系膜增厚较DKD亚组程度轻。因此,笔者认为清热消癥方可以改善肾脏纤维化,保护肾脏病理损伤。
清热消癥方由黄芪、黄蜀葵花、黄芩、熟大黄、水蛭、土元六味药组成,全方共奏清热散结、益气活血消癥之效。方中黄芪大补元气,气旺则推动血行,使瘀血去,络脉通。方中黄芩泻火解毒、清热燥湿,善清阳明胃经之热,阻断阳明经热之源头。黄蜀葵花味辛,性凉,辛味走窜性强,能散、能行、能开郁结,可宣达三焦之气机,功善清热解毒。大黄善泻下攻积、清热解毒、活血化瘀,荡涤胃肠热邪,泻浊通腑,破积滞,行瘀血,消癥瘕。水蛭功专破血通经,逐瘀消癥,善化肾络之瘀血,《神农本草经》云:“主逐恶血,瘀血,月闭,破血瘕积聚,无子,利水道。”土鳖虫能软坚散结,消癥瘕积聚。《神农本草经》曰:“主心腹寒热洗洗,血积癥瘕,破坚,下血闭。”研究证实清热消癥方中多种化学成分具有抗衰老作用和凋亡作用,如黄芪的活性成分黄芪多糖可以通过调控机体免疫,清除自由基及抗脂质过氧化发挥抗衰老作用[29],黄蜀葵花的有效活性成分槲皮素可以减少DKD患者脂肪和皮肤组织中的p16INK4A和p21CIP1等衰老细胞因子的表达[30],槲皮素还可以降低高糖刺激的小鼠肾小球系膜细胞中Casapse-3的表达,减少细胞凋亡,拮抗葡萄糖波动引起的肾损伤[31]。
综上所述,本研究推测清热消癥方可能通过下调DKD大鼠肾组织中p16和Caspase-3的表达,抑制肾脏细胞衰老和凋亡,改善肾脏病理损伤,延缓DKD进展。
作者贡献:王玉洁进行文章的构思与设计,文献资料和实验数据的收集与整理,撰写论文;王健协助实验操作;周静威负责文章的质量控制及审校,对文章整体负责。
本文无利益冲突。

