急性心力衰竭中国急诊管理指南(2022)
中国医疗保健国际交流促进会急诊医学分会, 中华医学会急诊医学分会, 中国医师协会急诊医师分会, 解放军急救医学专业委员会
心力衰竭(heart failure, HF,简称心衰)是由于心脏结构和(或)功能异常导致心室充盈和(或)射血能力受损的一组临床综合征,其病理生理学特征为肺淤血和(或)体循环淤血、伴或不伴有组织器官低灌注,主要临床表现为呼吸困难、乏力(活动耐量受限)和(或)液体潴留(外周水肿),以及血浆利钠肽水平升高[1-4]。心衰是大部分心血管疾病发展的最终阶段,其发病率高,目前我国≥35岁人群心衰的患病率为1.3%(女性1.2%,男性1.4%),估计有心衰患者890万[5]。
急性心力衰竭(acute heart failure, AHF)是指继发于心脏功能异常而迅速发生或恶化的症状和体征,并伴有血浆利钠肽水平的升高[2-4],临床上可以表现为新发的AHF(左心或右心衰竭)以及急性失代偿心力衰竭(acute decompensated heart failure, ADHF),其中ADHF多见,约占70%[6]。与ADHF相比,新发的AHF有更高的院内病死率,但出院后病死率和再住院率较低[7-8]。急性右心衰竭虽较少见,但近年有增加的趋势。
AHF是常见急重症,须快速诊断评估和紧急救治。《中国急性心力衰竭急诊临床实践指南(2017)》的发布对于指导急诊医师科学化、规范化的AHF评估、诊断与治疗发挥了重要作用。随着急诊医学专业学术理论与技术的不断进步,以及心衰诊断、评估和治疗已是急诊“全程化”管理的重要工作,原“指南”有更新之必要。中国医疗保健国际交流促进会急诊医学分会协同中华医学会急诊医学分会、中国医师协会急诊医师分会、解放军急救医学专业委员会等组织相关专家成立《急性心力衰竭中国急诊管理指南(2022)》指导组、撰写组、审定组,在充分遵循《中国制订/修订临床诊疗指南的指导原则(2022版)》[9]的基础上,经反复讨论和函审修改,形成具有我国特色的新版AHF急诊管理指南。
本指南沿用欧洲心脏协会(ESC)临床实践指南委员会的政策,标示了诊断与评估、药物和各种治疗方法的应用推荐类别与证据水平[3]。推荐类别:Ⅰ类为已证实和(或)一致认为有益和有效;Ⅱ类为疗效的证据尚不一致或存在争议,其中相关证据倾向于有效的为Ⅱa类,尚不充分的为Ⅱb类;Ⅲ类为已证实或者一致认为无用或者无效,甚至可能有害。证据水平:证据来自多项随机对照临床试验或多项荟萃分析为A级,证据来自单项随机对照临床试验或非随机研究为B级,证据来自小型研究或专家共识为C级。
鉴于右心的结构和功能与左心有诸多迥异,本指南将新发的急性右心衰竭有特征的部分单独简要叙述。
1 病因和诱因
心衰的常见病因包括心肌损伤(如心肌梗死、心肌炎、心肌病等)、心瓣膜病变[狭窄和(或)关闭不全]、容量或阻力负荷过重(如高血压、肺动脉高压等)、机械性梗阻(严重主动脉狭窄、左房黏液瘤、心包压塞等)等,其中新发急性左心衰竭最常见的病因包括由急性心肌缺血、机体严重感染和急性中毒等导致的急性心肌细胞损伤或坏死,以及急性心瓣膜功能不全和急性心包压塞;ADHF大多是由一个或多个诱因所致,例如感染、严重心律失常、未控制的高血压、心衰患者不恰当地调整或停用药物(治疗依从性差)及静脉输入液体(尤其是含钠液体)过多过快等。
基于AHF的病因与诱因在诸多临床情况下难以截然区分,且临床管理意义同等重要,本文合并表述。常见病因和诱因见表1。

表1 AHF常见病因和诱因
2 临床表现、初始评估和紧急处理
2.1 临床表现
AHF临床表现以肺淤血/肺水肿、体循环淤血及低心排血量和组织器官低灌注为特征,严重者并发急性呼吸衰竭、心源性休克。
2.1.1 肺淤血/肺水肿的症状和体征 端坐呼吸、夜间阵发性呼吸困难、咳嗽并咯血痰或粉红色泡沫痰、紫绀、肺部湿啰音伴或不伴哮鸣音、P2亢进、S3和(或)S4奔马律。
2.1.2 体循环淤血的症状和体征 颈静脉充盈或怒张、外周水肿(双侧)、肝淤血(肿大伴压痛)、肝-颈静脉回流征、胃肠淤血(腹胀、纳差)、胸腔或腹腔积液。
2.1.3 低心排血量与组织器官低灌注的表现 低血压(收缩压<90 mm Hg)、四肢皮肤湿冷、少尿[尿量<0.5 mL/(kg·h)]、意识模糊、头晕、血乳酸升高、肝功能异常、血肌酐水平增长≥1倍或肾小球滤过率下降>50%。需注意,低灌注常伴有低血压,但不等同于低血压。
2.1.4 心源性休克(cardiogenic shock) 心源性休克是指因心脏功能障碍导致心排血量明显减少而引起组织器官严重灌注不足的临床综合征,常见于急性心肌梗死(acute myocardial infarction, AMI)、暴发性心肌炎等,也可能是进展的ADHF,主要表现:没有低血容量存在的情况下,收缩压<90 mm Hg持续>30 min,或需要血管收缩药才能维持收缩压>90 mm Hg;存在肺淤血或左室充盈压升高(肺毛细血管楔压≥18 mm Hg),心脏指数明显降低[CI≤2.2 L/(min·m2)];同时伴有至少一个组织器官低灌注的表现,如意识改变、皮肤湿冷、少尿、血乳酸升高等。
2.1.5 呼吸衰竭 呼吸衰竭是由于心力衰竭、肺淤血或肺水肿导致的严重呼吸功能障碍,引起动脉血氧分压(PaO2)降低,标准大气压下静息呼吸空气时PaO2<60 mm Hg,伴或不伴有动脉血二氧化碳分压(PaCO2)增高(>50 mm Hg)而出现一系列病理生理紊乱的临床综合征。
ADHF发生在既往有明确心衰病史的患者,常呈渐进性起病,表现原有肺淤血、体循环淤血甚或组织器官低灌注的恶化或加重;新发的急性左心衰竭主要表现急性肺淤血、甚至肺水肿,伴或不伴有组织器官低灌注;急性右心衰竭主要表现低心排血量与组织器官低灌注及体循环淤血。
2.2 初始评估与紧急处理
不论是院前阶段、还是直接入急诊科的疑似AHF患者,首次医疗接触(first medical contact, FMC)时的首要措施都是紧急评估循环、呼吸(包括气道)和意识状态,并给予必要的支持治疗。
院前阶段积极采取下列措施可能带来早期获益[3-4,10]:
①完善心电图,检测血浆利钠肽和心肌肌钙蛋白I/T,无创监测脉搏血氧饱和度(SpO2)、血压、呼吸频率及连续心电监测等。
②若SpO2<90%,应及时给予常规氧疗如鼻导管或面罩吸氧,对于呼吸困难明显的患者除非禁忌证可尽早使用无创正压通气治疗[11-13]或经鼻高流量湿化氧疗,必要时可考虑气管插管行有创通气支持。
③建立静脉通路,若需要应用升压药物,可首选去甲肾上腺素,也可酌情使用多巴胺、间羟胺,维持循环基本稳定;亦或根据患者高血压和(或)淤血程度决定血管扩张剂、利尿剂的应用。
④尽快转诊至附近有完备急诊科、心内科和(或)重症监护病房(intensive care units, ICU)的大中型医院或区域医疗中心。
在急诊科循环和(或)呼吸评估与支持基本稳定的同时,尽快采取综合措施迅速识别出AHF的致命性病因以及促使心功能恶化的各种可逆性因素[如急性冠脉综合征(acute coronary syndrome, ACS)、高血压急症(hypertension emergency)、严重心律失常(arrhythmia)、急性机械性损伤(acute mechanical cause)、急性肺栓塞(pulmonary embolism)、急性感染(infection)、心包压塞(tamponade)等,简称CHAMPIT],给予相应紧急处理[3,10]。
院前和急诊科对AHF患者的初始评估和紧急处理流程充分体现急诊特有的“救命-治病”思维与临床实践,见图1。
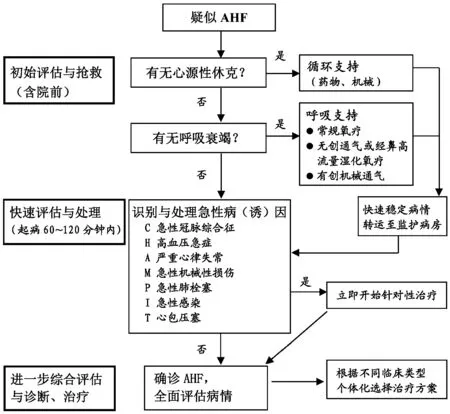
注:C-acute Coronary syndrome, H-Hypertension emergency,A-Arrhythmia, M-acute Mechanical cause, P-Pulmonary embolism, I-Infection, T-Tamponade; AHF-急性心力衰竭

推荐意见推荐类别证据水平首次医疗接触(FMC)即应启动评估、诊断(如心电图、血浆利钠肽检测)与无创监测ⅠC低氧血症患者给予吸氧,呼吸困难明显者除非禁忌证可应用无创正压通气治疗ⅠB建立静脉通路,根据患者血压、肺淤血等情况使用血管活性(扩张或收缩)药和(或)利尿剂,维持循环基本稳定ⅠC尽快转送至附近有完备急诊科、心内科和(或)ICU的大中型医院或区域医疗中心ⅠC迅速识别出AHF的致命性病因及促使心功能恶化的各种可逆性因素(如ACS、高血压急症、严重心律失常、急性肺栓塞、急性机械性损伤、急性感染、心包压塞等),并紧急处理ⅠC
3 诊断与进一步综合评估
AHF的最初诊断(疑诊)大多是以呼吸困难为突出临床表现开始的。早评估、早诊断、早治疗可以明显改善预后。
AHF的诊断应具备三个要素:AHF的病因或诱因、新发生或恶化的心衰症状和体征、血浆利钠肽水平升高(>诊断的界值)。AHF并发的呼吸衰竭与心源性休克的诊断标准见2.1。
3.1 病史与临床表现
新发AMI或病毒性心肌炎等心脏病变,既往基础心脏病和(或)心衰史、有前述诱因,以夜间阵发性呼吸困难、端坐呼吸为主要症状,若咯出粉红色泡沫痰伴两肺湿啰音,基本可明确急性心源性肺水肿。S3和(或)S4奔马律是心衰较为特异的体征。
3.2 心脏生物学标志物检查
3.2.1 利钠肽(钠尿肽)
多项随机、对照临床研究[14-16]证实,血浆B型钠尿肽(B-type natriuretic peptides, BNP)或N末端B型钠尿肽前体(NT-proBNP)有助于鉴别心源性和非心源性呼吸困难,在AHF的诊断与鉴别诊断中有重要价值,是临床诊断AHF的良好生物学标志物。所有疑似AHF的呼吸困难患者均应进行检测[3,17],其诊断AHF的界值(cut off)分别为:BNP>400 pg/mL;NT-proBNP需参考年龄因素,50岁以下>450 pg/mL、50~75岁>900 pg/mL、75岁以上>1800 pg/mL[15-17],肾功能不全[肾小球滤过率<60 mL/(min·1.73 m2)]时应>1200 pg/mL;伴有心房颤动的患者,也宜将NT-proBNP的界值提高20%~30%。利钠肽敏感性较高,阴性预测价值突出,血BNP<100 pg/mL、NT-proBNP<300 pg/mL,基本可排除AHF[3, 16-19]。介于诊断和排除标准之间(灰区)的利钠肽水平应基于患者的临床表现并着重参考心肺超声等结果综合判定。
利钠肽还有助于心衰严重程度和预后的评估[17]。患者的BNP或NT-proBNP明显增高,提示心衰病情较重,其短期与长期死亡风险均较高[16,20]。动态观察血浆利钠肽变化对于指导治疗也有一定帮助,可能益于降低心衰患者的病死率[21]和再住院风险[22]。
BNP和NT-proBNP的诊断和预后评估的准确性相当[17,19],应注意使用同一方法(BNP或NT-proBNP)进行动态观察。此外,血管紧张素受体-脑啡肽酶抑制剂(angiotensin receptor neprilysin inhibitor, ARNI)类药物和重组人BNP类药物通过提高机体内BNP水平发挥作用,此时的BNP检测结果难以如实反映心脏功能状态,而NT-proBNP则基本不受影响。目前利钠肽可在床旁快速检测。
年龄、性别和体重指数是影响利钠肽的主要生理因素;许多病理状况如缺血性卒中、肾功能不全、肝硬化伴腹水、肺血栓栓塞症、甲状腺疾病、营养不良或低白蛋白血症、严重感染或脓毒症等都可引起血浆利钠肽升高[17-18]。因此,要充分结合临床,科学评估。
3.2.2 心肌肌钙蛋白I/T(cTn I/T) 对AMI的诊断有明确意义,也用于对肺血栓栓塞危险分层。虽然部分心肌肌钙蛋白增高的AHF患者没有明确的心肌缺血或急性冠脉事件,但提示存在心肌损伤[23-24]。重要的是,心肌细胞损伤与心功能恶化或加重往往互为因果,研究认为,cTn I/T增高的AHF患者病死率和再住院率明显增高[24-25]。高敏心肌肌钙蛋白(hs-cTn)对评价早期、进展性(ongoing)心肌损伤及其严重程度的意义越来越受到重视,可独立地评估AHF患者的死亡和再住院等不良预后[26-28]。
3.2.3 其他 有研究证实,一些反映炎症、应激、神经内分泌、心肌和基质重构的生物标志物如可溶性生长刺激表达基因2蛋白(soluble suppression of tumorigenesis-2, sST2)[29-31]、和肽素(copeptin)[32-33]、糖类抗原125(carbohydrate antigen 125, CA125)[34-35]等对AHF的诊断和预后评估也有一定价值,部分已应用于临床。两项队列研究[36-37]提示,sST2-SCD积分对心衰患者发生心脏性猝死(sudden cardiac death, SCD)有良好的预测作用。检测AHF患者基线水平和治疗后的sST2水平变化,对短期、中期或长期的不良心血管事件发生都有较好的预测价值,若与其他临床或生物学指标联合使用,评价意义更高[22,30-31,38]。
3.3 心电图
AHF患者的心电图极少完全正常,其阴性评价意义较高,对于呼吸困难的快速诊断不可或缺[39-41]。虽然心衰患者的心电图表现缺乏特异性,但心电图异常对于协助确定心衰的心脏病因和(或)诱因如心肌梗死、心律失常等很有价值[39]。此外,AHF住院患者的心电图异常还可能提供重要的短期与长期不良结局的预后信息,应仔细评估[39-41]。
3.4 胸部X线
尽管20%左右的AHF患者X线胸片可正常,其阴性除外价值有限[42],但胸部X线检查对AHF的诊断仍很重要,其典型表现为肺静脉淤血、胸腔积液、间质性或肺泡性肺水肿,心影增大。胸部X线检查还能为肺炎、气胸等疾病的鉴别诊断提供依据。
患者病情与检查条件许可,也可尽早行肺部CT扫描,以进一步全面了解心肺影像学变化。
3.5 超声心动图与肺部超声
超声心动图可准确评价心脏形态、结构、运动与功能,尤其可清晰甄别收缩功能还是舒张功能异常[43-45]。对于首发AHF和心脏功能不明的患者,应当早期(入院24~48 h内)检查;但对血流动力学不稳定特别是心源性休克或是怀疑有致命性的心脏结构和功能异常的患者(如机械并发症、急性瓣膜返流、主动脉夹层等),应紧急行床旁超声心动图检查[46-47]。
肺部超声发现肺淤血、间质水肿的征象(增多的B线,呈现肺“火箭征”)[43-45],可鉴别患者的呼吸困难是AHF或是非心源性原因[48-49],在诊断和监测肺淤血/水肿、评价治疗和病情变化中的作用确定,已成为管理心衰患者一种可定量、简单、快速和可动态评估的方法[43]。在AHF患者,胸部X线诊断肺水肿的敏感性只有56.9%~76.5%, 特异性是87%~89%[50-51],而肺超声诊断肺水肿远比胸部X线更敏感,其检出B线的敏感性和特异性均在90%以上[49,51-52]。两项随机对照试验分别显示,与使用胸部X线和NT-proBNP结合临床评价相比,肺超声联合临床评价的策略对于诊断AHF有更高的准确性[53];与标准的治疗管理相比,肺超声引导的治疗在最初48 h期间能更快地减轻淤血[54]。
3.6 动脉血气分析
动脉血气分析对于诊断AHF并发的呼吸衰竭有重要价值,并提供酸碱平衡失调等关键信息[55],是判断AHF病情严重程度、指导治疗的必要检查之一。
临床多功能监护的SpO2虽能及时获得动脉氧供的信息,但在循环(灌注)不良和(或)休克的状况下不能真实反映动脉血氧饱和度(SaO2),应直接进行动脉血气分析。
3.7 其他辅助检验和检查
一些实验室指标的检验有助于发现AHF的部分病因和诱因,综合评价患者病情与预后:全血细胞计数、血乳酸、尿素氮(BUN)、血肌酐(Scr)、电解质、肝功能、血糖等。D-二聚体(D-dimer)对疑似肺血栓栓塞(低风险)的阴性排除价值较高,若是高风险患者,则直接行肺动脉CT成像(CTPA)[56]。怀疑合并急性感染的患者需完善降钙素原(PCT)检测[57]。甲状腺功能减退或亢进都可并(诱)发AHF,尤其对新发的AHF应检测甲状腺功能[58]。疑似ACS时,可行冠状动脉CT成像或造影。
乳酸是葡萄糖无氧酵解的产物。高乳酸血症是急重症患者氧代谢障碍的结果,往往提示存在组织缺氧,且在器官功能障碍早期即可出现,是急重症患者的早期预警指标,增高的血乳酸水平与急重症的严重程度和不良预后密切相关。组织缺氧与低灌注虽不能等同视之,但多数情况下二者是直接关联的,临床上,与尿量和部分体征相比,血乳酸是更好反映组织低灌注的替代指标[59]。
AHF住院患者中急性肾损伤(acute kidney injury, AKI)的发生率约为25%[60]。AHF出现AKI或是伴有慢性肾功能不全都是预后不良的危险因素[60]。住院期间宜定期监测血肌酐、尿素氮和电解质,根据病情严重程度变化调整检测频次。近期研究证明,与血肌酐相比,半胱氨酸蛋白酶抑制剂C(Cystatin C,简称胱抑素C)不受年龄、性别、肌肉含量等因素的影响,能更好地反映肾小球滤过率以及敏感地反映早期肾损伤,是有前景的生物学标志物之一[61];中性粒细胞明胶酶相关脂质运载蛋白(neutropil gelatinase-associated lipocalin, NGAL)也是反映AKI的有价值的早期标志物[62]。
由于心排血量减少和静脉充血增多,部分患者的肝功能受损,提示患者的不良预后风险增加。

推荐意见推荐类别证据水平AHF的诊断应具备三个要素:心衰的病因或诱因、新发生或恶化的心衰症状和体征、血浆利钠肽水平升高(>诊断的界值)ⅠC仔细询问AHF相关病史、症状和本次发作的心源性或非心源性诱因ⅠC全面评估肺淤血、体循环淤血和(或)组织器官低灌注的表现ⅠC常规进行血浆利钠肽(BNP或NT-proBNP)检查,辅助AHF诊断,并有助于病情严重程度和预后的评估ⅠABNP和NT-proBNP的诊断和预后评估的准确性相当ⅠA常规检查心肌肌钙蛋白I/T(或高敏肌钙蛋白I/T)ⅠA常规心电图、胸部X线检查ⅠC常规动脉血气分析,明确呼吸衰竭诊断ⅠC尽早(24~48 h内)行超声心动图检查,明确心脏结构、运动与功能ⅠB肺超声检查对于诊断AHF以及监测肺淤血/水肿、评价病情变化有重要价值ⅠA常规实验室检查(全血细胞计数、乳酸、电解质、肌酐、尿素氮、转氨酶、胆红素等),综合评估病情ⅠC检测可溶性生长刺激表达基因2蛋白(sST2)有助于评估不良预后ⅡaB酌情检查PCT,D-二聚体,T3、T4、TSH等ⅡaC酌情行冠状动脉造影(可疑ACS时)、肺动脉CT成像(可疑肺栓塞时)ⅡaC
4 临床分型与分级
AHF除前述的新发AHF和ADHF两大临床类型外,还可依据患者的临床表现、血流动力学特征等进行AHF临床分型与分级,以利于临床医师进行恰当的病情评估和制定个体化治疗方案。
4.1根据是否存在肺/体循环淤血(干湿)和组织器官低灌注(暖冷)的临床表现,快速地将AHF分为四型(见表3)[63],其中以暖而湿型最常见。此临床分型与血流动力学分类是相对应的,不仅提供对病情严重程度和危险分层的起始评价并据此提供治疗指导,而且对预后评估有一定价值[2],暖和干的患者6个月病死率为11%,而冷和湿的患者达40%[63]。此外,该分型的突出优势还在于简洁、便于快速应用,特别适用于AHF急诊管理[2]。
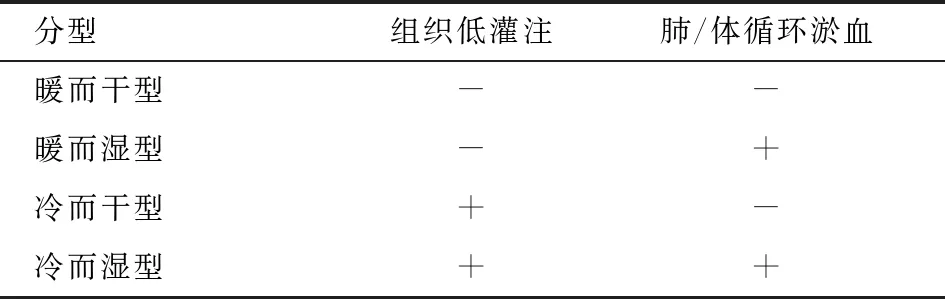
表3 AHF临床分型
4.2根据患者的收缩压可快速将AHF分为三种情况,有利于初步确定血管扩张剂的应用与否以及评估近期预后。大多数的AHF患者表现为收缩压正常(90~140 mm Hg)或收缩压升高(>140 mm Hg,高血压性AHF),这部分患者的近期预后多较好,只有少数(<10%)表现为收缩压降低(<90 mm Hg,低血压性AHF)[2,64],后者应避免使用血管扩张剂,且多与预后不良相关。
4.3依据左心室射血分数(left ventricular ejection fraction, LVEF),心衰可分为LVEF降低(<40%)的心衰(heart failure with reduced left ventricular ejection fraction, HFrEF)、LVEF保留(50%)的心衰(heart failure with preserved left ventricular ejection fraction, HFpEF)以及EF轻度降低(40%~49%)的心衰(heart failure with mildly reduced left ventricular ejection fraction, HFmrEF)[1];此外,基线LVEF≤40%,再次测量时>40%,且较基线水平提高10%,称为射血分数改善的心衰(heart failure with improved left ventricular ejection fraction, HFimpEF)[1]。一般来说,HFrEF多指传统意义上的收缩性心衰,提示可能是正性肌力药使用的适应证。与HFpEF患者相比,HFmrEF患者可从神经内分泌抑制治疗中获益,随访过程中有半数左右患者LVEF可能改善>50%。HFimpEF是HFrEF患者治疗与随访过程中的诊断,可能属于HFrEF的一种亚型,其临床结局相对较好。
4.4AMI出现AHF可应用Killip分级,其与患者的近期病死率相关,见表4。

表4 AMI的Killip分级

推荐意见推荐类别证据水平AHF的“冷暖湿干”临床分型简洁,与血流动力学相对应,便于快速评估病情、指导治疗和判断预后ⅠC根据不同收缩压的AHF临床分型有利于急诊确定血管扩张剂治疗和初步评估预后。ⅠC根据左室射血分数(LVEF)的AHF临床分型有助于评价心衰机制,指导正性肌力药物的应用ⅡaC
5 监测与持续评估
AHF患者均应监测症状和体征、心率和心律、呼吸频率、血压和SpO2的变化等。严格控制与记录出入液量,条件允许可每日称体重,动态监测肾功能、血乳酸和电解质,反复评估患者的淤血证据与容量状态。
无创性血流动力学监测(non-invasive hemodynamic monitoring)包括生物阻抗法、连续多普勒心输出量监测(ultrasonic cardiac output monitors, USCOM)[65]等,使用安全方便,患者易于接受,可获得部分心血管功能参数;有创性监测包括中心静脉压(central venous pressure, CVP)、动脉内血压、肺动脉导管(Swan-ganz)[66-68]、脉搏波指示连续心排量(pulse index continuous cardiac output, PiCCO)[69]等。
CVP是上、下腔静脉进入右心房处的压力,多年来一直是临床评价心功能与血流动力学的主要指标之一[70]。然而,CVP的变化受总容量、胸腔内压、腹内压及血管张力等多因素的影响,而且研究表明,CVP在接近正常(8~12 mm Hg)时难以预测液体反应性[71],目前可不作为常规监测与评价。肺动脉导管、PiCCO监测能够获得较为全面、准确的血流动力学参数,评价心脏前负荷与容量状况、肺水肿、心脏收缩功能等,有利于深入和全面地了解病情,适用于血流动力学状态持续不稳定、病情严重且治疗效果不理想、心功能恶化机制不明危重患者的诊治[66-68],其缺点是对机体有一定损伤,操作不当会引起并发症。应根据患者的病情与治疗的需要权衡利弊,选择实施具体的监测方法,还须准确地理解监测指标的含义,正确使用[66-68]。

推荐意见推荐类别证据水平严密监测患者的生命体征和SpO2、肾功能、电解质等,反复评估患者的淤血证据和容量状态ⅠC血流动力学状态持续不稳定、病情严重且治疗效果不理想、心功能恶化机制不明的患者可尽早使用有创血流动力学监测ⅡaB中心静脉压可不作为常规监测ⅡbB
6 治疗
AHF治疗目标依据病情的不同阶段而不同。早期急诊抢救以迅速稳定血流动力学状态、纠正低氧、改善症状、维护重要器官灌注和功能为主,后续阶段应进一步明确与纠正心衰的病因和诱因、控制症状和淤血、预防血栓栓塞,病情趋稳定后优化治疗方案,制定随访计划,改善远期预后[4]。
AHF治疗原则为减轻心脏前后负荷、改善心脏收缩与舒张功能、积极去除诱因以及治疗原发病因。
AHF危及生命,对疑诊AHF的患者,在完善检查的同时即应开始药物和非药物治疗。
6.1 一般处理
一般性处理包括无创性多功能心电监测、建立静脉通路以及必要的病情告知与患方的知情同意等。
允许患者采取最舒适的体位。急性肺水肿(淤血)患者通常取端坐位,两下肢下垂,保持此体位10~20 min后,可使肺血容量降低约25%。若患者出现组织器官低灌注表现,应取平卧位或休克卧位,并注意保暖。
6.2 氧疗与呼吸支持
氧疗适用于呼吸困难明显伴低氧血症(SaO2<90%或PaO2<60 mm Hg)的患者[72]。
常规氧疗方法包括①鼻导管吸氧:是常用的给氧方法,适用于轻-中度缺氧者,氧流量从1~2 L/min起始,根据动脉血气结果可增加到4~6 L/min;②面罩吸氧:适用于伴呼吸性碱中毒的患者[72]。
当常规氧疗效果不满意或呼吸频率>25次/min、SpO2<90%的患者除外禁忌证应尽早使用无创正压通气(non-invasive positive pressure ventilation, NIPPV)[73-74]。多项随机、对照研究[13, 75-78]结果显示,NIPPV治疗急性心源性肺水肿可改善氧合,减轻呼吸困难,缓解呼吸肌疲劳、降低呼吸功耗,降低插管率与早期病死率。NIPPV包括持续气道正压(continuous positive airway pressure, CPAP)和双水平气道正压(bi-level positive airway pressure, BiPAP),其中对于有二氧化碳潴留者,应首先考虑BiPAP模式[74]。
对于有NIPPV适应证而又不能良好耐受NIPPV的轻-中度低氧型呼吸衰竭患者可应用经鼻高流量湿化氧疗(high-flow nasal cannula oxygen therapy, HFNC)[79-80]。HFNC是指一种通过高流量鼻塞持续为患者提供可以调控并相对恒定吸氧浓度(21%~100%)、温度(31~37 ℃)和湿度的高流量(8~80 L/min)空氧混合气体的治疗方式。一项急诊科纳入急性心源性肺水肿患者(SpO2为88.7%±8.0%)的随机对照研究[81]显示,在30 min内HFNC比传统氧疗能更明显地降低呼吸频率,提高SpO2,但在改善住院率、机械通气率及病死率等方面差异无统计学意义。
经积极治疗后病情仍继续恶化(意识障碍、呼吸节律异常、呼吸频率>35~40次/min或<6~8次/min、自主呼吸微弱或消失、PaCO2进行性升高或pH动态性下降)、不能耐受NIPPV或是存在NIPPV治疗禁忌证者,应气管插管,行有创机械通气(invasive positive pressure ventilation, IPPV)[73-74]。

推荐意见推荐类别证据水平氧疗适用于呼吸困难明显伴低氧血症(SaO2<90%或PaO2<60 mm Hg)的患者ⅠC当常规氧疗(鼻导管和面罩)效果不满意时,除外禁忌证应尽早使用无创正压通气(NIPPV)ⅠA有NIPPV适应证而又不能良好耐受NIPPV的轻-中度低氧型呼吸衰竭患者可应用经鼻高流量湿化氧疗(HFNC)ⅡaB经积极治疗后病情仍持续恶化不能耐受NIPPV或是存在NIPPV治疗禁忌证者,应及时气管插管,行有创机械通气ⅠC
6.3 心源性休克的救治
6.3.1 超声心动图检查 AHF并发心源性休克的患者虽不足5%,但其院内病死率比不伴有休克的AHF患者高约10倍[82]。AMI、重症心肌炎、应激性心肌病、急性瓣膜返流(感染性心内膜炎、急性乳头肌功能不全或断裂等)是心源性休克的主要病因。对于所有疑似心源性休克的患者,除前述常规检查外,强调尽早行超声心动图检查,对于快速鉴别休克是心源性或非心源性原因有重要意义[46-47]。
6.3.2 冠状动脉再灌注治疗 冠状动脉再灌注治疗是AMI并发心源性休克患者有循证医学证据的主要干预措施[83-84]。对所有可疑ACS的心源性休克患者,推荐早期介入治疗策略[84-85],2 h内行经皮冠状动脉介入治疗(percutaneous coronary intervention, PCI)。对于急性ST段抬高心肌梗死(STEMI)合并的心源性休克患者,若早期介入不能及时完成,可在权衡再灌注获益、出血风险和预期造影时间延迟的基础上,积极考虑静脉溶栓治疗[86]。部分病例在必要时也可选择冠状动脉旁路移植术(coronary artery bypass graft, CABG)[83-84]。
6.3.3 扩容管理 心源性休克时,心脏泵功能及外周循环功能障碍并存,此时的扩容治疗应严格掌握补液量及补液速度,最好是在血流动力学的监测指导下进行。无临床征象提示容量负荷增多的情况下,可先在15~30 min内给予生理盐水或平衡盐溶液200~250 mL(即4 mL/kg)[82],观察病情变化;或临床考虑患者有低循环容量状态,亦可谨慎地进行容量负荷试验[87]或下肢被动抬高试验[88],仔细评估患者的液体反应性。床旁超声检查对评价心脏功能和容量状态有很好价值。
6.3.4 正性肌力药与血管收缩药
除外低血容量的心源性休克、心排量降低和组织器官低灌注,应用静脉正性肌力药(见6.6.3)治疗,一旦临床状况改善或是出现药物不良反应则应停用[89]。一项系统综述[90]提示,心源性休克使用正性肌力药(左西孟旦)可获得短期生存率改善的益处,但同时也强调了研究的低质量证据,而且这种获益在长期随访中消失不在。
应用正性肌力药后仍存在低血压的心源性休克患者,可给予血管收缩药提升平均动脉压和增加重要器官灌注[91],然而这多可增加左心室后负荷,因此正性肌力药联合使用血管收缩药可能更为合理。AMI相关心源性休克的AHA科学声明推荐去甲肾上腺素为一线血管收缩药[84-85]。有研究[92]提示,与多巴胺相比,去甲肾上腺素具有不增加心室率、不增加心肌氧耗的优势,副作用较少且病死率较低。多巴胺可用于心动过缓或快速心律失常如房颤风险较低的患者[93]。目前仍缺乏足够的证据表明AMI相关的心源性休克使用血管收缩药和正性肌力药能降低病死率[94]。
长时间(>2~6 h)输注血管收缩药应选中心静脉通路,因病情紧急中心静脉建立之前,也可经外周静脉通路过渡性使用,间羟胺可能造成的局部组织损伤最小[91]。因血管收缩药可致心律失常、心肌缺血,除常规多功能心电监测外,最好能监测动脉内血压。
6.3.5 机械循环支持装置
机械循环支持(mechanical circulatory support, MCS)装置可改善心脏功能,提供足够的心输出量,从而提高器官组织灌注,促进器官功能恢复。根据患者的年龄、合并症和神经功能情况,可考虑使用短期机械循环支持装置治疗难治性心源性休克[95-96],亦或是为治疗心源性休克的病因以及为等待心脏移植争取机会。
主动脉内球囊反搏(intraaortic balloon pumping,IABP)用于循环支持的常规适应证包括外科手术解决急性机械问题(如室间隔穿孔和急性二尖瓣反流)前、重症急性心肌炎、急性心肌缺血或心肌梗死患者在PCI或手术血运重建的围术期。多中心研究[97]发现,IABP对AMI合并心源性休克的患者没有生存获益。近期的观察性研究[98-99]也表明IABP治疗心源性休克的效果有限,且可能存在潜在的危害。新近的指南[3]不推荐常规使用IABP治疗心肌梗死后心源性休克。
体外膜肺氧合(extracorporeal membrane oxygenation, ECMO)治疗可部分或全部代替心肺功能,为呼吸和心脏提供支持。近年来,研究[100-101]表明,静脉-动脉体外膜肺氧合 (VA-ECMO) 短期应用可改善预后,且可在床边经皮启动,已渐成为对标准治疗无反应的心源性休克的一线治疗。
由于VA-ECMO在主动脉中提供逆行血流,可能增加左心室后负荷,导致左心室压力增加,阻碍心肌恢复并可能延迟心脏收缩力的改善,而IABP可在提供血流动力学支持的基础上能降低左室后负荷,两者联合应用可有效避免单独应用VA-ECMO的上述副作用,可促进患者心脏功能的恢复,提高VA-ECMO脱机的成功率以及降低患者病死率[102]。此外,有研究[103]还提出在VA-ECMO基础上增加一个心室辅助装置(ventricular assist device, VAD)用于主动为左心室减负荷的策略,但目前尚无足够、可靠的证据支持其使用。尽管VA-ECMO使用在逐年增加,但难治性心源性休克患者的预后仍然很差[100]。临床医生除全面、谨慎评估VA-ECMO的最佳适应证外,其启动时机也很关键。
近年来,Impella、TandemHeart及右心辅助装置如Impella RP等在心源性休克患者中也陆续有应用的报道[104],其结果尚待深入研究与评价。

推荐意见推荐类别证据水平疑似心源性休克,尽早行超声心动图检查确定病因ⅠAACS并发心源性休克,尽早实施冠脉再灌注治疗策略ⅠA心源性休克患者的容量状态需谨慎评估,并在治疗中观察病情变化ⅡbC心排血量严重降低导致组织器官低灌注,可静脉使用正性肌力药ⅡbB持续存在组织器官低灌注,可使用血管收缩药,首选去甲肾上腺素ⅡbB可考虑使用短期循环支持装置治疗难治性心源性休克或为治疗心源性休克的病因及等待心脏移植争取机会ⅡaB不常规使用IABP治疗心肌梗死后心源性休克ⅢA
6.4 识别并紧急处理导致AHF的急性可逆病因和诱因
早期识别AHF的病因或诱因,并积极处理一些急性可逆性因素(如CHAMPIT),可以避免心功能的进一步恶化。AMI合并AHF患者应积极进行再灌注治疗[86];高血压急症导致的AHF应尽早应用血管扩张剂和利尿剂,积极控制血压;因快速型心律失常或严重的缓慢型心律失常导致的AHF应通过药物或电转复、临时起搏等纠正心律失常[105-106];对于急性心脏机械并发症导致的AHF应给予机械循环支持[101];而急性肺血栓栓塞合并AHF者应给予药物溶栓、介入或外科取栓治疗[56];急性严重感染的治疗可早期经验性、降阶梯式应用抗感染药物;心包压塞的急诊管理主要是紧急排出心包积液、减轻心包腔的压力,最常用床旁心包穿刺或开窗术。

推荐意见推荐类别证据水平早期识别AHF的病因或诱因,并积极处理急性可逆性因素如CHAMPIT,可避免心功能的进一步恶化ⅠC
6.5 药物治疗
利尿剂、血管扩张剂、正性肌力药是治疗AHF的主要药物,具体方案基于AHF的病理生理学特征或临床分型。高血压导致急性肺水肿的患者需要积极的扩血管、降压治疗;对于血压正常的容量超负荷患者,优选利尿剂联合血管扩张剂;低血压但血管内容量超负荷患者无法耐受血管扩张剂,单用利尿剂或利尿剂联合正性肌力药物可能有效。正性肌力药一般不适用于HFpEF的患者。不同临床类型的AHF治疗策略见图2[2]。
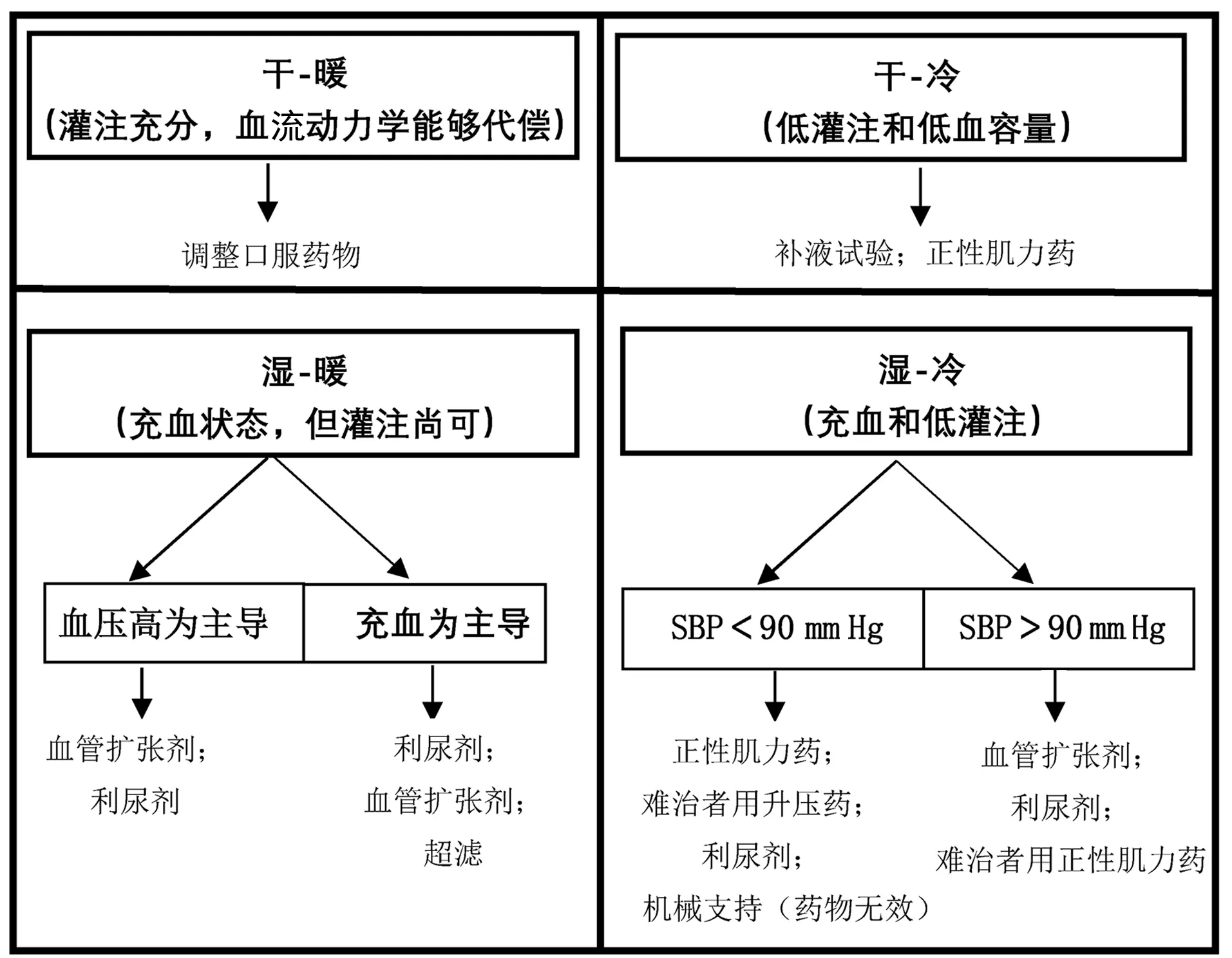
图2 不同临床类型AHF的治疗策略
6.5.1 利尿剂
利尿剂是治疗心衰的重要基石,通过增加尿量和减轻水肿有效治疗AHF的作用已被临床观察所证实。无论病因为何,有容量超负荷证据的AHF患者均应在初始治疗中采用静脉利尿剂[107-108],但对于有低灌注表现的AHF患者,在达到足够的灌注前应避免应用利尿剂[107]。
袢利尿剂作为治疗AHF的一线药物,多首选静脉注射或滴注。呋塞米(速尿)一般首剂量为20~40 mg,也可用布美他尼(丁尿胺)1~2 mg或托拉塞米10 mg。单次静脉给药和持续输注在有效性及安全性终点上差异均无统计学意义[109]。DOSE试验[109-110]提示,与低剂量利尿剂相比,较高剂量的利尿剂对AHF患者的呼吸困难症状缓解、水肿减轻有更好的作用,但主要的有效性结局(60天病死率、再住院率及因AHF急诊)差异无统计学意义;高剂量的利尿剂还可能引起神经内分泌的过度激活与电解质紊乱,后者往往与不良结局有关[111]。利尿剂剂量应个体化,一般情况下起始静脉治疗采用较低常规剂量是合理的,而长期使用袢利尿剂的患者或有大量水钠潴留或高血压的患者可能需要更高的剂量,静脉给药应≥2~2.5倍的口服维持剂量,其后根据疗效和患者状态逐步调整[112]。
在淤血的AHF患者使用袢利尿剂后的前6 h尿量<100~150 mL/h和(或)2 h尿钠含量<50~70 mEq,一般提示对利尿剂反应不良[107-108]。推荐早期评价利尿剂反应,以识别利尿剂抵抗患者[113],通过调整给药方式、增加剂量、联合应用利尿剂(如噻嗪类)或其他药物[如重组人脑利钠肽(rh-BNP)]等快速改善利尿效果。应注意监测血电解质和肾功能,过度利尿可能引起低血容量、AKI和电解质紊乱如低钾血症等。患者的淤血缓解、病情趋于稳定,即应开始静脉向口服袢利尿剂的转换,尽可能以最低的剂量维持疗效。
血管加压素受体拮抗剂选择性阻断肾小管上的精氨酸血管加压素受体,具有排水不排钠的特点[114]。EVEREST研究[114]结果表明,ADHF患者短期应用托伐普坦(Tolvaptan),可使容量负荷加重的患者呼吸困难和水肿明显减轻,临床状况明显好转,并使低钠血症患者的血钠正常化;虽长期治疗未见病死率的降低,心血管死亡及住院的复合终点差异无统计学意义,但在低钠亚组(Na+<130 mEq/L),托伐普坦治疗组的心血管病死率和心衰再住院率均低于常规治疗组,且对肾功能无不良影响。国内的一项随机对照研究[115]也提示,常规治疗基础上联用托伐普坦片治疗心源性水肿的有效性和安全性皆良好。然而,TACTICS-HF研究[116]却显示,AHF住院24 h内在给予标准剂量呋塞米的基础上加服托伐普坦和安慰剂,虽水肿明显减轻,但治疗期间可能经历肾功能恶化的危险有所增加,且住院期间和出院后的主要临床结局差异也无统计学意义。另外一项研究(SECRET of CHF)[117]也提示,使用托伐普坦与早期呼吸困难的改善无明显关联。由于血管加压素受体拮抗剂的特殊药理作用,更适用于心衰合并低钠血症的患者。该药副作用主要是血钠增高。

推荐意见推荐类别证据水平有容量超负荷证据的AHF患者,应在初始治疗中采用静脉利尿剂ⅠA有组织器官低灌注表现的AHF患者,在达到足够的灌注前应避免用利尿剂ⅢC袢利尿剂作为治疗AHF的一线药物ⅠB对正在使用呋塞米或有大量水钠潴留或高血压的AHF患者,袢利尿剂首剂量可加倍ⅡaB避免过度利尿,否则可能引起低血容量、AKI与电解质紊乱如低钾血症等ⅢC 应早期评价利尿剂反应,识别利尿剂抵抗ⅠB 血管加压素受体拮抗剂适用于合并低钠血症的AHF患者ⅡaB
6.5.2 血管扩张剂 经静脉常用的血管扩张剂包括硝酸酯类、硝普钠、α-受体阻滞剂(乌拉地尔),rh-BNP由于较强的扩血管作用,也归入此类。虽然血管扩张剂治疗AHF在降低患者病死率方面的获益尚缺乏充分的证据[118],但血管扩张剂可降低静脉张力(优化前负荷)和动脉张力(降低后负荷),仍是治疗AHF的重要部分,特别是对伴有高血压的AHF治疗有效[119-122]。除外特定血管扩张剂应用的禁忌证外,SBP>110 mm Hg的AHF患者可安全使用;SBP 90~110 mm Hg的患者可酌情谨慎使用,临床严密观察;SBP<90 mm Hg或有症状性低血压的患者避免使用血管扩张剂。血管扩张剂在初始治疗时通常选择静脉用药,监测血压,根据其变化及时调整剂量,直至心衰的症状缓解或收缩压降至110 mm Hg左右。避免过度降压,其与预后不良相关。
6.5.2.1 硝酸甘油与硝酸异山梨酯 硝酸酯类药作用主要是扩张静脉容量血管、降低心脏前负荷,较大剂量时可同时降低心脏后负荷,在不减少每搏输出量和不增加心肌耗氧的情况下减轻肺淤血。硝酸酯类药虽然一直用于AHF的治疗,但只是2000年前后的几个前瞻性、随机、对照研究[120,123]肯定了对AHF的疗效,确定了其在AHF治疗中的重要作用,尤其是适用于ACS伴心衰的患者。硝酸甘油静脉给药一般采用微量泵输注,从10~20 μg/min开始,以后每5 min递增5~10 μg/min,直至心衰的症状缓解或收缩压降至110 mm Hg左右;硝酸异山梨酯静脉滴注剂量1 mg/h,根据症状体征可以增加到不超过10 mg/h。病情稳定后逐步减量至停用,突然终止用药可能会出现反跳现象。硝酸酯类药物长期应用均可能产生耐药,为避免耐药,可采用偏心给药。严重心动过缓(<40次/min)或心动过速(>120次/min)患者也不宜使用硝酸酯类药物。
6.5.2.2 硝普钠 硝普钠能均衡地扩张动脉和静脉,同时降低心脏前、后负荷,适用于急性左心衰特别是伴有高血压的患者。常用剂量3 μg/(kg·min),通常以0.5 μg/(kg·min)开始,根据治疗反应以0.5 μg/(kg·min)递增,逐渐调整,直至症状缓解、收缩压由原水平下降30 mm Hg或血压降至110 mm Hg左右为止。停药应逐渐减量,以免反跳。通常疗程不超过72 h,长期用药可引起氰化物和硫氰酸盐中毒,合并肾功能不全患者尤其谨慎。静脉输注时需避光。
6.5.2.3 乌拉地尔[124-125]乌拉地尔主要阻断突触后α1受体,使外周阻力降低,同时激活中枢5-羟色胺1A受体,降低延髓心血管中枢的交感反馈调节,外周交感张力下降。可降低心脏负荷和肺动脉压,改善心功能,对心率无明显影响。通常静脉注射12.5~25 mg,如血压无明显降低可重复注射,然后以0.4~2 mg/min静脉滴注维持,并根据血压调整。
6.5.2.4 rh-BNP rh-BNP具有扩张静脉、动脉和冠状动脉作用,降低前、后负荷,增加心排血量,增加钠盐排泄(不影响钾离子),并抑制肾素-血管紧张素系统和交感神经系统,无直接正性肌力作用。几项随机、安慰剂对照的临床研究显示,AHF患者静脉输注rh-BNP可获有益的临床与血流动力学效果:左室充盈压或肺毛细血管楔压(PCWP)降低、心排血量增加,呼吸困难症状改善,安全性良好[126-128]。ASCEND-HF研究[129-130]等证实rh-BNP不影响肾功能,可改善预后。该药可作为血管扩张剂单独使用,也可与其他血管扩张剂(如硝酸酯类)合用,还可与正性肌力药(如多巴酚丁胺等)合用。给药方法:1.5~2 μg/kg负荷剂量缓慢静脉注射,继以0.0075~0.01 μg/(kg·min)持续静脉滴注,最大可调整至0.015~0.02 μg/(kg·min);对于血压较低患者,可直接以维持量静脉滴注。国内新近一项随机对照的前瞻性研究观察了序贯使用rh-BNP与ARNI(停用rh-BNP当日启用沙库巴曲/缬沙坦)治疗ADHF患者的有效性和安全性,结果提示,rh-BNP与沙库巴曲/缬沙坦的序贯治疗可明显改善患者的心功能,提高生存质量,降低3个月内心衰再入院风险[131]。
6.5.3 正性肌力药 临床上应用的正性肌力药主要包括儿茶酚胺类、磷酸二酯酶抑制剂、钙增敏剂和洋地黄类药。对于LVEF降低与低心排血量的AHF患者,如果存在低血压等组织灌注不足[89, 132],或在采取氧疗、利尿和可耐受血管扩张剂治疗的情况下仍有肺水肿,静脉给予正性肌力药以缓解症状[133]。静脉给予正性肌力药时需监测血压、心律(率)。
6.5.3.1 儿茶酚胺类 常用多巴胺和多巴酚丁胺。多巴胺(Dopamine)是剂量依赖性药物,小剂量[1~4 μg/(kg·min)]时主要兴奋多巴胺受体,有轻度正性肌力和肾血管扩张作用;5~10 μg/(kg·min)时主要兴奋β-受体,可增加心肌收缩力和心排血量,10~20 μg/(kg·min)时α-受体激动效应占主导地位,使外周血管阻力增加。多巴酚丁胺(Dobutamine)主要通过激动β1-受体发挥作用,具有很强的正性肌力效应,在增加心排血量的同时伴有左室充盈压的下降,且具有剂量依赖性,常用于严重收缩性心衰的治疗。但FIRST研究[134-135]等提示,多巴酚丁胺可能增加ADHF患者心脏不良事件(如心衰恶化、需要血管活性药、机械辅助装置、气管插管、心脏骤停复苏、心肌梗死)的发生以及随访6个月的病死率增加。多巴酚丁胺的剂量一般在2~20 μg/(kg·min),但药物反应的个体差异较大,老年患者对药物的反应明显下降。常见不良反应有心律失常、心动过速。用药72 h后可出现耐受。正在应用β-受体阻滞剂的患者不宜应用多巴酚丁胺。
6.5.3.2 磷酸二酯酶抑制剂 磷酸二酯酶抑制剂选择性抑制心肌和平滑肌的磷酸二酯酶同工酶Ⅲ,减少cAMP的降解而提高细胞内cAMP的含量,发挥强心与直接扩血管作用,一般应用于利尿剂联合血管扩张剂无效且外周循环较差的AHF患者,可稳定血流动力学状态,改善临床症状及生活质量,其作用机制不受β-受体阻滞剂影响。常用药物有米力农、奥普力农、依诺昔酮等。米力农增加患者心脏指数的作用不具有剂量依赖性,但其肺血管扩张作用随剂量的增加而增强,首剂25~75 μg/kg静脉注射(>10 min),继以0.375~0.75 μg/(kg·min)滴注,常见不良反应有低血压和心律失常。早期的研究[136-138]提示,米力农、依诺昔酮可能增加急性失代偿HFrEF患者心脏不良事件和死亡风险。盐酸奥普力农在低剂量时,以肺血管扩张作用为主,随着剂量的增加,增加心排血量的作用更为突出并占主导地位,并且不明显增加心率和心肌耗氧量,特别适用于肺淤血伴心排血量降低的AHF患者,每日总量不超过0.6 mg/kg,即相当于0.4 μg/(kg·min)连续24 h[139]。肥厚性梗阻型心肌病患者、孕妇与妊娠者禁用该类药物。
6.5.3.3 钙增敏剂(左西孟旦) 钙增敏剂与肌钙蛋白C(Tnc)结合,增加Tnc与Ca2+复合物的构象稳定性而不增加细胞内Ca2+浓度,促进横桥与细肌丝的结合,增强心肌收缩力而不增加心肌耗氧量,并能改善心脏舒张功能,同时激活血管平滑肌的K+通道,扩张组织血管。对于缺血性心肌病,尤其是ACS伴HFrEF患者有一定优势[140]。几项研究[141-144]结果显示,左西孟旦增加ADHF患者的每搏输出量和LVEF,改善临床症状,导致BNP水平明显下降,安全性良好。一项回顾性队列研究[145]结果显示,左西孟旦不增加伴有肾功能异常的急性HFrEF患者的短期或长期病死率。两项Meta分析[146]表明,左西孟旦能降低左心室功能不全患者的血肌酐浓度,急性肾衰竭的风险下降,还可改善患者的肾小球滤过率和尿量;可产生血流动力学和心脏的获益,总病死率降低[147]。左西孟旦宜在低心排血量或组织低灌注时尽早使用,负荷量12 μg/kg静脉注射(>10 min),继以0.1~0.2 μg/(kg·min)滴注,维持用药24 h;如血压偏低,可直接静脉滴注维持量24 h。使用过程中出现严重心律失常如持续性室性心动过速应停用。
6.5.3.4 洋地黄类药 洋地黄类药是唯一既有正性肌力作用又有负性传导作用的药物,对于HFrEF特别是伴房颤快速心室率(>110 bpm)的AHF患者多是首选[148]。可选用毛花甙丙(西地兰)0.2~0.4 mg缓慢静注;必要时2~4 h后再给0.2~0.4 mg,24 h总量不超过1.0~1.2 mg。也可选用静脉地高辛注射液。使用洋地黄之前,应描记心电图确定心律,了解是否有AMI、心肌炎或高血钙、低血钾等,AMI后24 h内应尽量避免用洋地黄药物;单纯性二尖瓣狭窄合并急性肺水肿时,如为窦性心律不宜使用洋地黄制剂,因洋地黄能增加心肌收缩力,使右室排血量增加,加重肺水肿。待心率稳定改为地高辛口服,较低剂量的地高辛可能为HFrEF的患者带来更好的预后[149-150]。RATE-AF试验[151]12个月的随访结果提示,地高辛可能作为永久性房颤伴心衰老年患者长期心率控制和改善症状的一线治疗。还应注意,对于有基础合并症如慢性肾脏病、存在影响地高辛代谢的因素如合并其他用药及老年患者,宜定时测定血地高辛浓度。

推荐意见推荐类别证据水平静脉正性肌力药可用于心排血量降低导致组织器官低灌注的LVEF降低的患者Ⅱa B在氧疗、利尿和可耐受血管扩张剂治疗的情况下仍有肺水肿,可应用静脉正性肌力药ⅡbC正在应用β-受体阻滞剂的患者不宜应用多巴酚丁胺Ⅲ C 使用静脉正性肌力药时需要监测血压、心律(率)Ⅰ C
6.5.4 抗凝治疗
血栓栓塞是心衰患者重要的并发症。由于多种生理与病理因素,心衰患者存在血液高凝状态,易于血栓形成。心衰患者血栓栓塞风险估计为每年1.0%~4.5%[152]。住院的心衰患者发生有症状的肺动脉栓塞和深静脉血栓栓塞的风险分别为非心衰患者的2.15倍和1.21倍,且由于临床表现不一,鉴别困难,心衰患者发生血栓并发症的风险可能更高[153]。MEDENOX研究[154]发现,心衰住院患者给予依诺肝素40 mg,每日1次,与安慰剂组相比,深静脉血栓风险从14.5%降低到4.0%。
心衰伴发房颤进一步增加血栓栓塞并发症风险[106]。伴发房颤、CHA2DS2-VASc评分男性≥2分或女性≥3分的心衰患者,应接受维生素K拮抗剂(华法林)或新型口服抗凝药(Non-vitamin K antagonist oral anticoagulant, NOAC)治疗,除非有禁忌证[105,155-156]。与华法林相比,NOAC将卒中/体循环栓塞风险降低了14%,大出血率降低了23%,颅内出血率降低了57%[155-156]。需要关注的是,心衰患者中慢性肾脏病的患病率较高,NOAC治疗房颤的随机试验是排除了严重肾功能不全(肌酐清除率<20 mL/min)的患者,中度肾功能不全(肌酐清除率20~40 mL/min)患者在严密监测下可以考虑使用NOAC[106]。
多数HFrEF患者合并冠状动脉疾病,对于这些不伴有房颤患者的抗凝治疗尚存争议。COMMANDER-HF研究[157]对于冠心病心衰住院史的HFrEF患者启用利伐沙班治疗,而COMPASS研究[158]对于合并冠心病、LVEF>30%的HFrEF患者,可考虑在使用阿司匹林的基础上加用利伐沙班以减少卒中和死亡风险。

推荐意见推荐类别证据水平无接受抗凝治疗史和无抗凝治疗禁忌证的AHF患者,应用低分子肝素以降低深静脉血栓和肺血栓栓塞风险Ⅰ A 伴发房颤的AHF患者,除非有禁忌证,应接受维生素K拮抗剂或新型口服抗凝药治疗Ⅰ A 不伴房颤的HFrEF近期住院患者,可酌情加用新型口服抗凝药ⅡbB
6.5.5 其他药物治疗
6.5.5.1 阿片类药物 阿片类药物(吗啡)由于其独特的药理学作用长期以来一直是治疗急性左心衰竭的经典药物[159]。急性失代偿心衰国家注册研究(ADHERE)结果和近期几项系统综述与Meta分析[160-162]均提示,AHF应用吗啡者机械通气比例增多、在ICU时间和住院时间延长及病死率可能更高,吗啡治疗AHF的安全性受到质疑,因此不推荐常规使用。但对烦躁不安又除外持续低血压、意识障碍、严重慢性阻塞性肺疾病的患者,可小剂量(3~5 mg)吗啡缓慢静脉注射,同时注意个体化。此外,AMI合并的不伴有低血压的AHF应用阿片药物兼具镇痛、镇静和减轻心脏负荷的多重效应[159],获益明确。
6.5.5.2 β-受体阻滞剂 目前尚无随机临床研究使用β-受体阻滞剂治疗AHF改善急性期病情。若AHF患者发生持续的心肌缺血或心动过速,在除外严重收缩功能降低、低血压及其他禁忌证的情况下,可考虑谨慎地静脉使用β-受体阻滞剂,以期打断“缺血—心衰—交感神经激活—缺血”恶性循环[163]。此外,β-受体阻滞剂有很好的控制急性房颤心室率的作用[164],特别是对于伴有交感张力高的AHF患者,能更快地发挥功效;多项高质量研究[165-167]证实,β-受体阻滞剂还可降低合并房颤心衰患者的病死率。LVEF降低的AHF,若未长期行β-受体阻滞剂治疗,不宜在早期治疗阶段使用β-受体阻滞剂;若是平时服用β-受体阻滞剂者,除明显低血压或有明显灌注不足证据,β-受体阻滞剂可根据耐受情况继续使用。部分研究[168-170]表明,对于AHF 住院患者,停用β-受体阻滞剂与住院病死率、短期病死率和短期再住院或死亡联合终点增高相关。严重的容量超负荷和(或)需要正性肌力药支持的患者,不能用β-受体阻滞剂。
6.5.5.3 血管紧张素-脑啡肽酶抑制剂(ARNI) 是新型抗心衰药物,在PIONEER-HF研究中[171],因新发心衰或ADHF住院的HFrEF患者在稳定后随机给予沙库巴曲/缬沙坦或依那普利,在4周和8周时可观察到沙库巴曲/缬沙坦组患者NT-proBNP下降幅度更大,心衰相关不良事件数更少。在开放标签的TRANSITION研究中[172],超过1000例因ADHF的HFrEF患者随机分配到早期院内用药组(血流动力学稳定24 h后)和出院后用药组(出院14 d内),结果显示两组安全性相同。对于新发心衰或ADHF住院的患者,可考虑起始便使用沙库巴曲/缬沙坦进行治疗,以减少发生不良事件的短期风险,并可简化管理流程(避免先使用ACEI/ARB,再改用沙库巴曲/缬沙坦)[173]。
6.5.5.4 伊伐布雷定(Ivabradine) 伊伐布雷定是选择性If通道抑制剂,减慢窦房结电冲动发放频率,从而减慢心率,并可明显降低心肌耗氧量。SHIFT研究[174]平均随访23个月,与安慰剂组相比,伊伐布雷定组因心血管死亡或因心衰再住院的患者比率下降18%,导致死亡或住院的联合危险降低26%。应当注意,伊伐布雷定不同于β-受体阻滞剂,没有减慢心率以外的生物学效应,SHIFT研究中伊伐布雷定也只是对心率≥70次/min的患者表现出疗效优势。对于AHF住院患者,经治疗血流动力学稳定后,窦性心律且心率≥75次/min,当β-受体阻滞剂暂时无法耐受,可考虑小剂量(2.5 mg每日2次)起始使用伊伐布雷定,并根据患者心率、血压等调整剂量5~7.5 mg每日2次[175]。也可与β-受体阻滞剂合用[176],有效控制心率,安全性良好。最常见的不良反应为闪光现象和心动过缓,为剂量依赖性。
6.5.5.5 茶碱类药物 茶碱类药物是既往治疗AHF的常用药物,具有扩张支气管改善通气、轻度扩张静脉降低心脏前负荷以及增加肾血流与利尿作用,可适用于伴有支气管痉挛的AHF患者。此外,对于急诊一时难以鉴别的心源性及肺源性呼吸困难,应用茶碱也是有益的[177]。因其增加心肌耗氧量,ACS患者不宜使用,老年人与肝肾功能不全者用量酌减。严重不良反应包括低血压与休克、甚至室性心律失常而猝死,不能在AHF患者中常规使用。

推荐意见推荐类别证据水平不常规使用吗啡ⅢA吗啡可用于烦躁不安又除外持续低血压、意识障碍、严重慢性阻塞性肺疾病的患者,小剂量缓慢静脉注射,注意个体化用药ⅡbCAHF患者发生持续的心肌缺血或心动过速,除外禁忌证可谨慎地静脉使用β-受体阻滞剂ⅡaC新发AHF或ADHF住院患者,在血流动力学稳定后即应起始使用沙库巴曲/缬沙坦治疗,简化管理流程ⅠA经住院治疗血流动力学稳定的AHF患者,窦性心律且心率≥75次/min,若暂时无法耐受β-受体阻滞剂时,可小剂量起始使用伊伐布雷定ⅡaB不常规使用茶碱类药物ⅢC茶碱类药可用于伴有支气管痉挛的AHF患者ⅡbC
6.6 超滤与肾脏替代治疗
超滤是肾脏替代治疗的一种,超滤治疗可以清除血浆水分,对于治疗AHF患者减轻容量负荷很有效。较早的UNLOAD研究和AVOID-HF研究等以及近期的随机对照研究[178-179]都证明,超滤在液体去除率和体重减轻方面优于利尿剂,并降低再住院率,可提高生活质量,对病死率没有影响。然而,一些研究并未从超滤中受益,不能在持续恶化的心衰和70岁以上老年患者中产生更好的减轻淤血效果[180],甚至肾功能恶化的发生率较高[181]。CARRESS-HF(ADHF心肾抢救研究)[181]评价了高液体去除率与低液体去除率、射血分数保留与降低不同情况的结果,在AHF患者中使用超滤进行的初始液体清除量增加与肾功能恶化无关,但在LVEF>40%的患者中,无论液体去除率如何,超滤都与肾功能恶化相关,而且较高的初始液体去除率与较高的不良临床结果发生率相关。此外,血管途径可能的并发症也是不能忽视的[181]。因此,不建议超滤代替袢利尿剂作为AHF患者的一线治疗[180],而是应用于难治性淤血、对利尿剂反应不佳的患者。
若合并AKI、液体复苏无效的少尿,以及出现严重高钾血症(K+≥6.5 mmol/L)、严重酸中毒(pH≤7.1)的患者需要使用肾脏替代治疗。

推荐意见推荐类别证据水平超滤不宜代替袢利尿剂作为AHF的一线治疗ⅡbA对于难治性容量负荷过重、利尿剂反应不佳者,可行超滤治疗ⅡaA对合并AKI、液体复苏无效的少尿,可行肾脏替代治疗ⅡaB出现下列情况者可行肾脏替代治疗:严重高钾血症(K+≥6.5 mmol/L)、严重酸中毒(pH≤7.1)ⅡaC
7 药物转换、出院管理
7.1 AHF患者药物治疗的转换
药物治疗是心衰患者长期治疗的基石,其稳定期的主要目标在于:降低病死率,预防因心衰恶化而再次住院,改善临床状态、活动能力和生活质量[4]。AHF患者血流动力学趋于稳定后,及时更换给药方式从注射到口服有循证医学证据的药物。
血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitors, ACEI)/ARNI、β-受体阻滞剂和盐皮质激素受体拮抗剂(MRA)的三联治疗被推荐作为HFrEF的基础疗法,除非有禁忌证或患者不能耐受,而且这些药物应该增加到临床试验中使用的剂量(如果不可能,则增加到最大耐受剂量);对于ACEI或ARNI不耐受的患者可以更换为血管紧张素受体拮抗剂(angiotensin receptor blocker, ARB)[3]。此外,除非有禁忌证或不能耐受,所有已接受ACEI/ARNI、β-受体阻滞剂和MRA治疗的HFrEF患者,无论是否患有糖尿病应使用钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂,后者的利尿、利钠特性可在减少淤血方面提供额外的益处,并可减少患者对袢利尿剂的需求[3]。DAPA-HF试验[182]和EMPEROR-Reduced研究[183]结果显示,与安慰剂相比,达格列净与恩格列净均明显降低心衰患者心血管死亡或心衰恶化风险,治疗获益在糖尿病和非糖尿病患者中保持一致。EMPULSE试验[184-185]表明,在AHF住院患者中使用恩格列净,无论患者的基线特征如何,在减轻症状和改善生活质量等方面均产生了临床益处,同时耐受性良好。
对于HFpEF,除应用利尿剂减轻淤血症状外,由于绝大多数患者有潜在的高血压和(或)冠状动脉疾病,也可接受ACEI/ARB、β-受体阻滞剂或MRA治疗。
7.2 出院管理
AHF患者符合下述标准可考虑出院[186]:①血流动力学稳定、容量恰当、已加用有明确循证医学证据的口服药物以及肾功能稳定至少24 h;②已给患者制定了个体化的健康宣教方案和自我管理的方案。
AHF患者出院后1周内早期随访也是“全程化”治疗的重要内容,可通过探视、电话、视频等方式对患者的功能状态、生活质量、治疗依从性等进行评价,并与患者或其亲属讨论未来可行的治疗目标[187]。需要强调的是,AHF患者出院后的早期随访探视可明显降低30天再住院风险[188]。
一些LVEF减低的终末期或进展期心衰患者往往会因为多种因素容易再次出现症状反弹和血流动力学恶化。早先的研究报告给NYHAⅣ级心衰患者每周静脉输注多巴酚丁胺一次,观察时间平均382 d,其急诊与再住院次数、住院时间都有较好改善[189],提示对于这些患者尝试间歇性静脉输注正性肌力药来维持日常更好的血流动力学状态、减轻心衰症状不失为一种有较好成本效益的治疗方法,而且可能为后期的心脏机械支持装置或心脏移植争取机会[190]。钙增敏剂左西孟旦的活性代谢产物半衰期长(约为76~80 h),一次给药其疗效持续达一周。LEVO-Rep研究[191]和LION-HEART研究[190]及一项Meta分析[192]结果表明,LVEF减低的终末期或进展期心衰患者间歇静脉输注左西孟旦有改善NYHA分级、左心室功能和改善生活质量的趋势,但不增加全因病死率和心脏性猝死发生率。由于该研究和Meta分析中的样本量较小,也不排除会对最终结果有一定的影响。

推荐意见推荐类别证据水平AHF患者的血流动力学趋于稳定后,应及时将注射药物转换为有循证医学证据的口服药物ⅠC血管紧张素转化酶抑制剂/ARNI、β-受体阻滞剂和盐皮质激素受体拮抗剂的三联作为HFrEF的基础治疗,除非有禁忌证或不能耐受ⅠA除非有禁忌证或不能耐受,所有已接受血管紧张素转化酶抑制剂/ARNI、β-受体阻滞剂和盐皮质激素受体拮抗剂治疗的HFrEF患者无论是否患有糖尿病应使用SGLT2抑制剂ⅠAAHF患者病情稳定、已口服有明确循证医学证据的药物,并制定了个体化的健康管理方案,可考虑出院ⅠCAHF患者出院后应早期随访探视,可降低30天再住院风险ⅠBLVEF减低的终末期或进展期心衰患者可尝试定期间歇静脉输注正性肌力药ⅡbA
8 急性右心衰竭
急性右心衰竭(acute right sided heart failure, ARHF)又称急性右心综合征(acute right sided heart syndrome, ARHS),ARHF在HFrEF人群中的比例存在很大的差异。有研究表明,在AHF住院期间接受超声心动图检查的HFrEF患者中,48%有右心室扩张,而且与没有右室扩张的患者相比,90天病死率、紧急移植或紧急左室辅助设备(LVAD)放置的风险皆明显增加[193-194]。
ARHF常见于急性压力和(或)容量负荷过重(如急性肺栓塞、急性肺动脉高压、急性三尖瓣返流等)、右心心肌缺血/坏死、或心肌炎症等原因导致的收缩功能障碍,或是各种诱因导致的慢性右心衰竭急性加重[195]。其中慢性右心衰竭的病因多数归于左室功能不全引起的肺动脉高压,部分是由于右室心肌梗死、致心律失常性右室心肌病、右心瓣膜病等所致[196]。
8.1 临床表现
ARHF以低心排血量、组织器官低灌注和体循环淤血为特征。值得注意的是,突发明显的对氧依赖也往往是ARHF的主要表现[197];持续出现脱机失败往往提示ARHF的存在(右心室功能不全会导致呼吸机依赖和心、肺功能之间的失衡,特别是存在左心收缩功能不全的患者),尤其是既往存在右心功能不全或新近出现深静脉血栓的患者[198]。
8.2 诊断与评估
ARHF的诊断应至少具备两个特征:与RHF一致的症状与体征;右心结构和(或)功能异常(见表5)或心内压增加的客观依据。超声心动图的诊断与评估意义极其重要[43,199]。

表5 经胸超声在ARHF的量化参数
ARHF应常规监测基本生命体征、心肌标志物、肝肾功能和组织灌注等实验室参数,特别是ARHF多同时存在组织低灌注与体循环淤血,行无创或有创血流动力学监测与心功能评估是有益的。其中CVP监测的意义和局限性需全面认知:CVP作为指导容量复苏与增加心排血量关系的指标,其背景原因是CVP与静脉回流相关,并且CVP异常升高始终代表病理性原因或至少可以成为限制容量复苏的“阀门”;但是,CVP是通过压力来评估前负荷、评估血容量或预测液体反应性等容量指标,加之舒张末期心室容积与压力的关系并非呈线性相关,会受到舒张末期的右心房/右心室心肌张力的影响[66,70]。
8.3 急诊管理
右心衰竭可损害左室充盈,终将减少左心排血量[199]。针对急性右心梗死或急性肺栓塞等病因的治疗是急诊管理ARHF的重要环节[3]。若有明显的静脉淤血,利尿剂常是治疗的一线选择。正性肌力药和(或)去甲肾上腺素应用于低心排血量和血流动力学不稳定的患者,其中正性肌力药能降低心脏充盈压当是优选,但其可引起低血压,必要时与去甲肾上腺素联用[199]。此外,容量评估与管理是综合治疗措施的重要部分。流程图3总结了ARHF的急诊管理[195]。

推荐意见推荐类别证据水平ARHF的诊断应至少具备两个特征:与RHF一致的症状和体征;右心结构和(或)功能异常、或心内压增加的客观依据ⅠCARHF多同时存在组织低灌注与体循环淤血,行血流动力学监测与评估是有益的ⅡaC针对急性右心室梗死、急性肺栓塞等病因的治疗是至关重要的ⅠA容量管理是ARHF综合治疗的重要部分ⅡaB
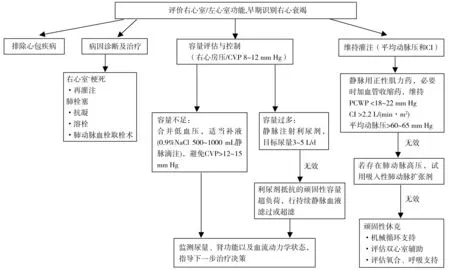
图3 急性右心衰竭急诊管理流程
9 老年AHF
“老龄化”是心衰发病率增加的主要原因之一[200-201]。65岁以后,年龄每增加10岁,心衰的发病率增加2倍(男性)和3倍(女性)[202]。我国2012~2015年65~74岁及>75岁人群心衰患病率分别为2.1%和3.2%,过去15年中我国心衰总患病率增长了44%[5]。除年龄因素外,一些常见的老年疾病如高血压、糖尿病、慢性肺疾病、肾功能不全、心房颤动、肥胖等也是老年心衰发病的危险因素,其中高血压是导致老年心衰的最主要危险因素,尤其是老年女性。
AHF是老年人最常见的住院原因之一[200]。因AHF入院的老年患者平均年龄为75岁[201],其中65岁以上患者约占80%,80岁以上患者占21%~38%。
9.1 临床表现
与年轻心衰患者相比,老年心衰的特征性病理生理机制主要体现在左心室充盈动力和冠状动脉血流储备能力随年龄增长而下降,年轻患者能耐受的轻至中度心脏负荷,在老年患者就可能引发AHF。老年AHF患者的临床特征与非老年患者也有所不同,特别是75岁以上心衰患者多为女性,且更多的是LVEF保留的心衰[203-204]。
老年AHF患者早期最突出的表现是呼吸困难(70%以上)与疲乏无力(20%~30%)。部分老年AHF常以不典型表现为首发症状,例如嗜睡、意识模糊、定向障碍、胃肠道不适或食欲减退等。
9.2 诊断与评估
老年AHF的诊断与评估应特别注意多病共存、多药合用及老年综合征如衰弱等因素的影响[200]。此外,NT-proBNP诊断AHF的界值需参考年龄与肾功能以及是否存在房颤的情况(见前述),老年患者特别是85岁以上患者BNP和NT-proBNP的截断值灰区较宽[201]。
9.3 急诊管理
近期,法国一项纳入15个急诊科503例≥75岁AHF患者的研究[205]认为,老年AHF患者在急诊科接受指南导引的综合性集束化治疗并未改善30天的出院率和生存率。老年AHF的治疗更加强调个体化,以控制症状和改善生活质量为主要目标[200]。
随着增龄,心血管的顺应性降低,老年患者对硝酸酯更为敏感,易于出现血压降幅更大甚至低血压。最近的两项随机研究(GALACTIC trail和ELISABETH trial)[205-206]都对老年AHF患者常规使用硝酸酯类药提出了挑战,研究均未能改善患者的长期结局或30天的出院生存率。因此,老年AHF患者应用硝酸酯类药或许应只限于血压增高的情况,并严密临床监测。
老年患者更易于出现容量偏移,并且由于低白蛋白血症和内皮功能障碍其血浆再充盈率较低,每天多次静脉注射袢利尿剂应当谨慎,可考虑替换为持续静脉滴注方式,应经常性评估容量和利尿情况,以调整理想的利尿剂剂量[107]。此外,尿钠测定对于AHF患者调整利尿剂治疗可提供有益的参考[207]。

衰弱是老年常见综合征,其发生率随着增龄而增加[214]。最近的一项Meta分析[215]显示,在老年心衰患者中,衰弱的患病率为45%。衰弱明显增加心衰患者的死亡风险,需全面评估与管理老年衰弱患者,如运动锻炼、营养干预、多学科合作的医护模式、减少医疗伤害等。
高龄老年AHF患者行有创性诊疗措施需充分评估其获益与风险,谨慎使用[200]。
9.4 预后
老年AHF患者的死亡风险约为8%~10%,30天再住院风险达15%~30%[201,205, 216],均高于非老年患者,85岁以上患者1年的全因死亡风险是<65岁患者的3.5倍,是74~85岁患者的2倍。除增龄本身就是AHF患者死亡危险增加的一个变量外,患者的心率、高血压、LVEF、NYHA分级、pH值、贫血、肾功能不全(或使用透析/超滤)、高水平BNP、使用正性肌力药以及住ICU时长也是重要的预测住院病死率的独立危险因素[217-218]。

推荐意见推荐类别证据水平老年AHF的诊断与评估应特别注意多病共存、多药合用以及老年综合征如衰弱等因素的影响ⅠC老年AHF的管理应强调个体化,以控制症状和改善生活质量为主要目标ⅠB高龄老年AHF患者行有创性诊疗措施需充分评估其获益与风险,谨慎实施ⅡaC精简有潜在危险的或非必要用药可改善老年患者的临床照护以及提高生活质量ⅠA
10 妊娠与围生期AHF
妊娠合并心血管疾病是常见的妊娠合并症,其发生率为1%~4%,病死率约为5%[219],包括既往合并结构异常性心脏病(如先天性心脏病、瓣膜性心脏病和心肌病等)或非结构异常性的心律失常以及妊娠期间新发的心脏病如妊娠高血压综合征和围生期心肌病(peripartum cardiomyopathy, PPCM)等[220]。妊娠相关血流动力学变化主要包括心输出量增加、血容量增加,导致心脏负荷增加,以及血浆容量的增加大于红细胞容积的增加,导致“生理性贫血”。
围生期定义为妊娠28周至分娩后1周。围生期心衰通常发展迅速,如控制不当,极易发展为心源性休克。因此,围生期AHF的早期诊断和及时治疗是关键。
10.1 临床表现
劳力性气促和阵发性夜间呼吸困难常常是AHF的早期表现,但可能与正常的妊娠反应相混淆,正常妊娠女性也常表现有呼吸急促、易疲劳、运动耐量降低、肺底湿啰音(咳嗽或深呼吸时消失)及外周性水肿。因此,要重视早期心衰的临床表现,仔细甄别[221]。
10.2 诊断与评估
心脏超声是最重要的确诊手段,应在入院后24~48 h内完成。需要注意的是,晚期妊娠常见生理性多瓣膜返流,以右心瓣膜返流为主。NT-proBNP、BNP可诊断与鉴别AHF,并进行危险分层[222]。妊娠期可出现一些与疾病无关的心电图改变,如心脏向左旋转导致电轴左偏15°~20°、一过性ST-T改变、Ⅲ导联Q波和T波倒置、V1-2导联T波倒置等,需谨慎评估。
妊娠期心衰患者需行胎心监护,及时了解胎儿宫内情况[221]。
10.3 急诊管理
应制定急诊处理流程,建立多学科管理团队,对妊娠与围生期AHF患者做到快速诊断和及时干预。妊娠与围生期AHF的处理,除了前述一般性原则内容外,还应考虑到妊娠使心脏负担增大、药物对胎儿的影响以及必要时终止妊娠。
许多治疗AHF的药物具有致畸等作用,必须避免使用(包括ACEI、ARB、ARNI、MRA、伊伐布雷定和SGLT2抑制剂)。
有淤血表现的患者应尽早使用利尿剂,但由于影响胎盘血流量,使用时应进行胎儿监测。
血管扩张剂治疗可通过降低心脏前、后负荷而改善中至重度心衰患者的心输出量,并且降低所有阶段的心肌恶化速度,硝酸酯类+肼苯哒嗪是扩张血管的首选,硝普钠代谢产生的硫氰酸盐和氰化物在动物模型中会导致胎儿氰化物中毒,在妊娠期AHF使用需慎重[3]。
对于有室上性心律失常患者,谨慎应用β-受体阻滞剂。地高辛可经胎盘途径到达胎儿,已用于子宫内治疗胎儿快速性心律失常,所以在妊娠期AHF可用于心衰伴快心室率房颤的治疗,但由于妊娠期的生理需求增加,可能需增加剂量以达到治疗效果[223]。部分不能耐受β-受体阻滞剂者,可以在产后且无母乳喂养时使用伊伐布雷定[223]。
正性肌力药可用于“湿冷”型AHF患者,但PPCM患者应谨慎使用β-受体激动剂,因其对β-肾上腺素能受体激动剂的毒性作用高度敏感,有诱发室性心律失常的风险[224]。
对于射血分数非常低的孕妇或产后AHF患者,可以考虑抗凝治疗以预防血栓栓塞[223],低分子肝素或华法林均可使用。
欧洲心脏病学会(ESC)增加了关于在 PPCM 患者中使用溴隐亭的建议(Ⅱb 级,B级)。一般情况下,可考虑使用溴隐亭(2.5 mg,每日1次)1 周[225]。
所有心衰患者病情一旦控制,如果胎儿能够存活,应积极终止妊娠;若心衰难以控制,即使胎儿无法存活也应及时终止妊娠。大多数情况下,分娩将采用剖腹产,极少数情况也可阴道分娩。如果尝试阴道分娩,必须进行有效镇痛。无论哪种情况下,都应注意液体平衡,加强产后生命体征监护,继续使用抗心衰药物以及预防感染治疗,产后不宜哺乳。对于心源性休克患者,应尽早启动循环机械支持,同时急诊剖宫产终止妊娠[226]。

推荐意见推荐类别证据水平妊娠与围生期AHF发病凶险,应建立多学科团队协同诊治ⅠC应紧急行心脏超声检查以诊断与评价妊娠与围生期AHFⅠB妊娠期AHF患者需行胎心监护ⅠC妊娠期AHF的处理还应考虑到妊娠使心脏负担增大、药物对胎儿的影响、以及必要时终止妊娠ⅡaB避免使用具有致畸等不良作用的药物ⅢC
11 心衰单元建设
AHF在急诊科(室)的临床表现以及诊断和治疗有很大的“异质性”。有条件的二级以上医院可开展心衰单元建设,以形成心衰诊治网络体系,为心衰患者提供诊断、治疗、康复、护理等连续性诊疗服务(国家卫健委《心力衰竭分级诊疗技术方案》2019年5月)。心衰单元不仅是一个单纯的空间概念,也是一种医疗管理模式,涵盖院前(院外)的社区医疗服务中心和120急救中心以及院内以急诊科为主导的急诊科、心内科、呼吸科、ICU、心外科、血液透析室等多学科医护人员共同组成的心衰专业协作团队,为AHF患者提供包括快速诊断、急救、稳定期动态观察、出院判断、院外随访、指导宣教及患者管理的一种综合临床治疗策略,以及可支持实施该临床治疗策略、拥有最大化医疗和人力资源利用率、最高效救治流程和标准化的管理系统[227]。

推荐意见推荐类别证据水平有条件的二级及以上医院可开展心衰单元建设ⅡaC
本指南制定无任何利益冲突。
专家组指导专家
陈玉国(山东大学齐鲁医院),于学忠(北京协和医院),吕传柱(四川省医学科学院·四川省人民医院),赵晓东(解放军总医院第四医学中心),张国强(中日友好医院),张健(北京阜外医院·国家心血管病中心))
撰写专家
陈凤英(内蒙古医科大学附属医院),邓颖(哈尔滨医科大学第二附属医院),李燕(山西医科大学第二医院),米玉红(首都医科大学北京安贞医院),商德亚(山东第一医科大学附属省立医院),宋娟娟(哈尔滨医科大学第二附属医院),孙立超(吉林大学第一医院),王旭涛(北京医院),温伟(北京医院),邢吉红(吉林大学第一医院),张新超(统稿)(北京医院·国家老年医学中心),朱继红(北京大学人民医院)
审定专家
柴艳芬(天津医科大学总医院),曹钰(四川大学华西医院),陈锋(福建省立医院),陈杨(贵州中医药大学第一附属医院),董士民(河北医科大学第三医院),杜贤进(武汉大学人民医院),范西真(中国科技大学附属第一医院),郭树彬(首都医科大学北京朝阳医院),黄亮(南昌大学第一附属医院),蒋龙元(中山大学孙逸仙纪念医院),康健(大连医科大学附属第一医院),梁岩(北京阜外医院·国家心血管病中心),李湘民(中南大学湘雅第一医院),林绍彬(福州市立二院·福建中医药大学附属医院),刘先宝(浙江大学医学院第二附属医院),刘笑然(海南医学院),卢中秋(温州医科大学第一附属医院),吕瑞娟(山东大学齐鲁医院),马渝(重庆市急救医疗中心·重庆大学附属中心医院),马青变(北京大学第三医院),马岳峰(浙江大学医学院第二附属医院),毛恩强(上海交通大学医学院附属瑞金医院),聂时南(东部战区总医院),潘曙明(上海交通大学医学院附属新华医院),彭鹏(新疆医科大学附属医院),秦历杰(河南省人民医院),司君利(青岛大学附属青岛市立医院),田英平(河北医科大学第二医院),王宇新(哈尔滨工业大学附属哈尔滨市第一医院),魏捷(武汉大学人民医院),吴利东(南昌大学第二附属医院),谢苗荣(首都医科大学北京友谊医院),杨立山(宁夏医科大学总医院),杨蓉佳(甘肃省人民医院),姚咏明(解放军总医院医学创新研究部转化医学研究中心),尹文(空军军医大学第一附属医院),詹红(中山大学附属第一医院),张泓(安徽医科大学第一附属医院),张玮(昆明医科大学第一附属医院),赵敏(中国医科大学附属盛京医院),张剑峰(广西医科大学第二附属医院),张劲松(江苏省人民医院),曾红科(广东省人民医院),朱华栋(北京协和医院)

