黄酒发酵环境对黄曲霉生长的影响
王小壮,刘双平,孙海龙,韩 笑,毛 健*,应维茂
(1 粮食发酵工艺与技术国家工程实验室 江苏无锡 214122 2 江南大学生物工程学院 江苏无锡 214122 3 江南大学食品学院 江苏无锡 214122 4 国家黄酒工程技术研究中心 浙江绍兴 312000)
在黄酒酿造过程中,霉菌提供了丰富的酶系,是必不可少的酿造微生物[1]。在工业化黄酒生产中,以纯培养的黄曲霉SU-16 为主要糖化剂[2-4],其中黄曲霉在熟麦曲中占到真菌群落结构的75%以上,在接种的生麦曲中占到群落结构的32.72%,在黄酒发酵过程中的相对含量>1%[5-6],因此黄曲霉对黄酒的发酵至关重要。生物量是表征微生物生长情况的重要指标,快速、准确地测定生物量的变化,对于反映微生物的活性具有重要意义。然而,目前尚无对黄酒发酵过程中黄曲霉的动态变化的定量分析。qPCR 利用荧光信号累积对PCR产物进行标记跟踪,通过实时监测整个PCR 进程,准确定量样品中微生物的生物量,同时具有操作简便、专一性和灵敏度高、耗时短的优势,目前被广泛应用于环境、食品[7-9]等领域中微生物的定量检测。
黄酒发酵是一个复杂的发酵过程,发酵过程中微生物之间、环境与微生物之间存在着复杂的相互作用关系[10-11]。有研究指出pH 值、温度、乙醇以及弱酸等环境因子会通过影响真菌生长,进而影响其代谢活性来对发酵产生作用[12-15]。黄酒发酵采用间歇开耙的方式为微生物提供氧气,同时微生物的活动产生大量的乙醇和有机酸,发酵醪中乙醇和有机酸的积累可能对黄曲霉的生长有一定影响。毛青钟等[16]仅研究了黄酒发酵醪中抑制霉菌生长的因子,未深入研究黄曲霉的生长胁迫条件。
本研究基于qPCR 方法对黄酒发酵过程中黄曲霉的动态变化进行定量分析,解析发酵环境中主要代谢物质对其生长的影响,以期为研究黄曲霉对黄酒发酵的贡献提供基础数据,同时可为研究其它酿造微生物提供借鉴。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料
1)试验过程中所用菌株黄酒酵母HJ 和黄曲霉SU-16 均为黄酒生产工业菌株;黄酒酵母用YPD 培养基,黄曲霉SU-16 用马铃薯葡萄糖培养基进行菌种活化培养,培养基115 ℃高压灭菌20 min 备用。
2)生麦曲和熟麦曲 (黄曲霉SU-16 纯种麦曲)均取自绍兴某黄酒厂,大米购于当地超市。
3)所用菌株均为本实验室保藏。
1.1.2 试验试剂 无水乙醇、乳酸、乙酸、无水葡萄糖等试剂,国药集团化学试剂有限公司;蛋白胨、酵母膏、马铃薯葡萄糖培养基,北京索莱宝生物科技有限公司;PrimeSTAR HS DNA Polymerase、TB Green Mix、溶菌酶、溶壁酶和蛋白酶K,无锡博瑞康有限公司;试验所用引物由生工生物工程(上海)股份有限公司合成。
1.2 仪器与设备
Legend Micro 17R 冷冻高速离心机,美国赛默飞世尔科技公司;DM500 RH 生物显微镜,德国徕卡显微系统公司;Universal HoodⅡ凝胶成像仪,美国Bio-Rad 公司;Q5000 超微量紫外分光光度计,美国QUAWEⅡ公司;Qtower 3.0 荧光定量PCR 仪,德国耶拿分析仪器股份公司;KC/HWS-250PY 恒温恒湿培养箱,上海凯测实验设备有限公司。
1.3 方法
1.3.1 黄酒发酵与取样 参照黄酒发酵工艺[17]在实验室条件下模拟黄酒发酵。使用生麦曲、熟麦曲、酒母、米饭和水混合落料(按照表1配料添加),落料温度28 ℃,前酵温度30 ℃±2 ℃发酵120 h,每天开耙不少于1 次,头耙时间为8~10 h;后酵15 ℃±2 ℃发酵408 h。发酵试验在5 L 体系中进行,每个试验3 个平行。分别在发酵0,24,48,72,96,120,168,240,312,432,528 h 后充分搅拌混匀3 min,用无菌取样袋取样100 g。
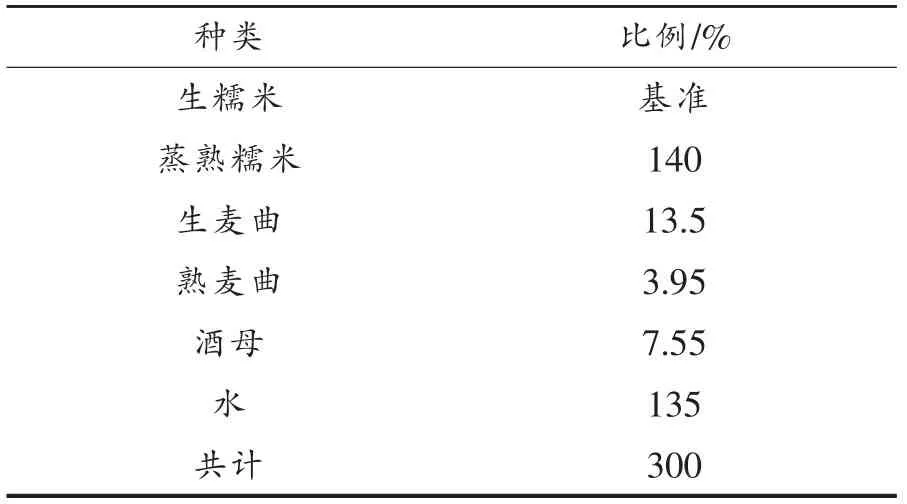
表1 黄酒模拟发酵体系Table 1 Huangjiu simulated brewing system
1.3.2 理化指标的检测 参照GB/T 13662-2018《黄酒》[18]进行总酸(以乳酸计)、氨基态氮和酒精度的测定,采用3,5-二硝基水杨酸比色法[19]测定还原糖的含量。
1.3.3 荧光定量PCR 测定黄曲霉的生物量
1)黄曲霉的引物筛选及特异性验证 真菌的ITS 区域和β-微管蛋白基因序列常被用于曲霉属微生物的鉴定[20]。通过文献查阅选择这2 个区域,针对黄曲霉的特异性引物(表2),通过NCBI提供的Primer-Blast 功能模拟比对,选出特异性高且扩增产物在100~200 bp 的引物。以黄酒生产中筛选到的14 种真菌为模板,对该引物进行PCR特异性试验验证。PCR 反应体系:2×PrimeSTAR HS DNA Polymerase 12.5 μL、上下游引物各10 mmoL、模板100 ng,补充ddH2O 至25 μL;PCR 反应程序:95 ℃30 s,95 ℃10 s,60 ℃15 s,72 ℃20 s 共30 个循环,72 ℃充分延伸5 min,16 ℃保存。PCR 扩增产物用1%琼脂糖凝胶电泳进行引物特异性验证。
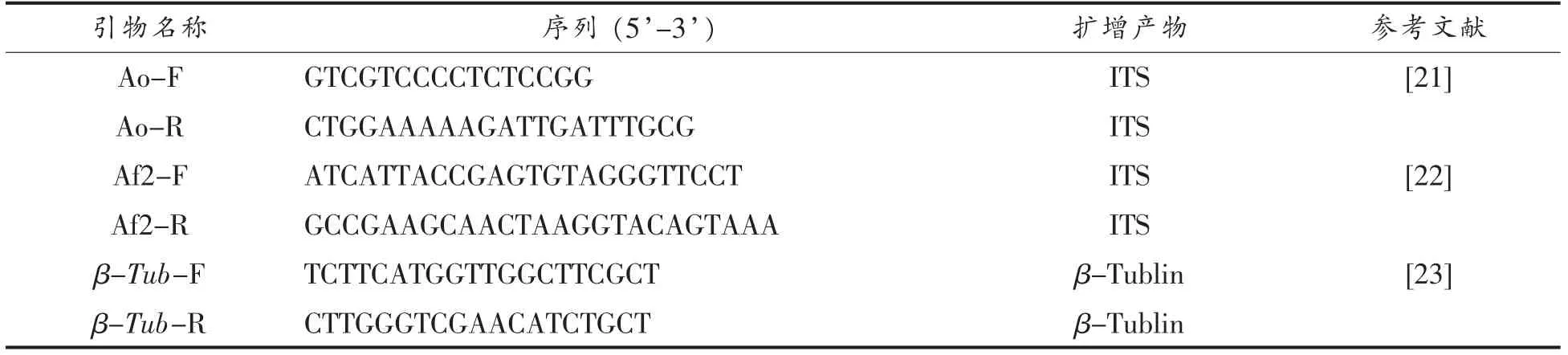
表2 黄酒酿造中黄曲霉的引物筛选Table 2 Screening of primers for A.flavus in Huangjiu brewing
2)标准曲线的建立 将黄曲霉接种于马铃薯葡萄糖琼脂培养基,28 ℃培养5~7 d,待长满孢子收集制成孢子悬浮液,参照文献[8]和[9]的方法以Ct 值(即每个反应管内的荧光信号达到设定的阈值时所经历的循环数)为横坐标,生物量(103~108)的对数值为纵坐标绘制标准曲线。通过扩增效率(Eff=10(-1/b)-1,95%~105%)和可信度(R2)来衡量标准曲线的可靠性,其中b 是标准曲线的斜率[24]。qPCR 反应体系:2×TB Green Mix 10 μL,上下游引物各10 mmoL,模板100 ng,补充ddH2O 至20 μL;qPCR 反应程序:95 ℃90 s,95 ℃15 s,60 ℃30 s,共40 个循环,然后从60 ℃升温至95 ℃,每隔1 ℃读1 次板,每次读板维持10 s,绘制熔解曲线。
3)DNA 的提取 称取5 g 发酵醪样品,液氮研磨后转入50 mL 离心管中,加入无菌水10 mL,混匀振荡30 min,超声5~10 min 后离心(1 000 r/min,4 ℃,10 min),取上清,洗涤2 次。将所得上清液高速离心(12 000 r/min 离心10 min)后向沉淀中加入5 mL 无菌水,采用SDS-CTAB 抽提法[25]提取黄酒发酵醪预处理样品的基因组。
4)样品测定 将样品DNA 浓度稀释到合适浓度后,分别使用黄曲霉特异性引物进行qPCR扩增,测定Ct 值,按照1.3.3(2)节中的标准曲线计算生物量。
1.3.4 通氧量对黄曲霉SU-16 生长的影响 取1 mL(约1.0×107spores/mL)黄曲霉SU-16 孢子悬浮液接种于100 mL 黄酒模拟液[26]培养基中,分别置于摇床(28 ℃,150 r/min)以及培养箱中,28 ℃培养120 h,培养箱中每隔12 h 摇匀3 min,每隔24 h取样按照1.2.3 节的方法测定黄曲霉SU-16 生物量的变化。
1.3.5 发酵因素对黄曲霉SU-16 生长的影响
1)乙醇对黄曲霉SU-16 生长的影响 将含有不同乙醇含量(1%,3%,5%,8%,12%vol)的马铃薯葡萄糖琼脂培养基倒平板,晾干平板。
2)乳酸对黄曲霉SU-16 生长的影响 将含有不同质量浓度乳酸(2,4,6,8 g/L)的马铃薯葡萄糖琼脂培养基倒平板,晾干平板。
3)乙酸对黄曲霉SU-16 生长的影响 将含有不同质量浓度乙酸(2,4,6,8 g/L)的马铃薯葡萄糖琼脂培养基倒平板,晾干平板。
在以上平板正中间放置1 个直径6 mm 的滤纸片,吸取3 μL (约1.0×107spores/mL) 黄曲霉SU-16 孢子悬浮液滴于滤纸片上,立即用封口膜密封,28 ℃培养120 h,每隔24 h 采用十字交叉法测量菌落直径,各3 个平行。
1.3.6 乙醇/乳酸/乙酸对黄曲霉SU-16 生物量的影响 分别配制不同浓度的乙醇 (1%,3%,5%,8%,12%vol)、乳酸(2,4,6,8 g/L)和乙酸(2,4,6,8 g/L) 黄酒模拟液,吸取1 mL (约1.0×107spores/mL)黄曲霉孢子悬浮液加入黄酒模拟液中恒温28℃培养,每隔12 h 摇匀3 min,每隔24 h 取样按照1.3.3 节的方法测量黄曲霉SU-16 生物量的动态变化,各3 个平行。
1.4 数据处理
采用GraphPad Prism 7、qPCRsoft(Version 4.0)和Excel(Version 2013)进行样品数据处理和分析。
2 结果与分析
2.1 黄酒发酵过程中理化指标和黄曲霉的动态变化
2.1.1 黄酒发酵过程中理化指标的动态变化 黄酒发酵过程中理化指标的变化如图1所示,随着发酵时间的延长,样品中的还原糖含量降低,酸度和乙醇升高,理化指标在前酵(28 ℃,0~120 h)过程中,尤其是0~48 h 变化较大,120 h 时发酵醪液中总酸含量为(3.51 ± 0.11)g/L,氨基态氮含量为(1.24±0.02)g/L,还原糖含量为(28.74±1.01)g/L,乙醇含量为15.27%±0.51%vol。由于原料在前酵过程中被充分利用,后酵(15 ℃,120~528 h)过程理化指标基本趋于稳定,发酵结束后(528 h),发酵醪液中总酸含量为(3.82 ± 0.33)g/L,氨基态氮含量为(1.83 ± 0.05)g/L,还原糖含量为(28.65 ±3.87)g/L,乙醇含量为16.03%±0.93%vol。
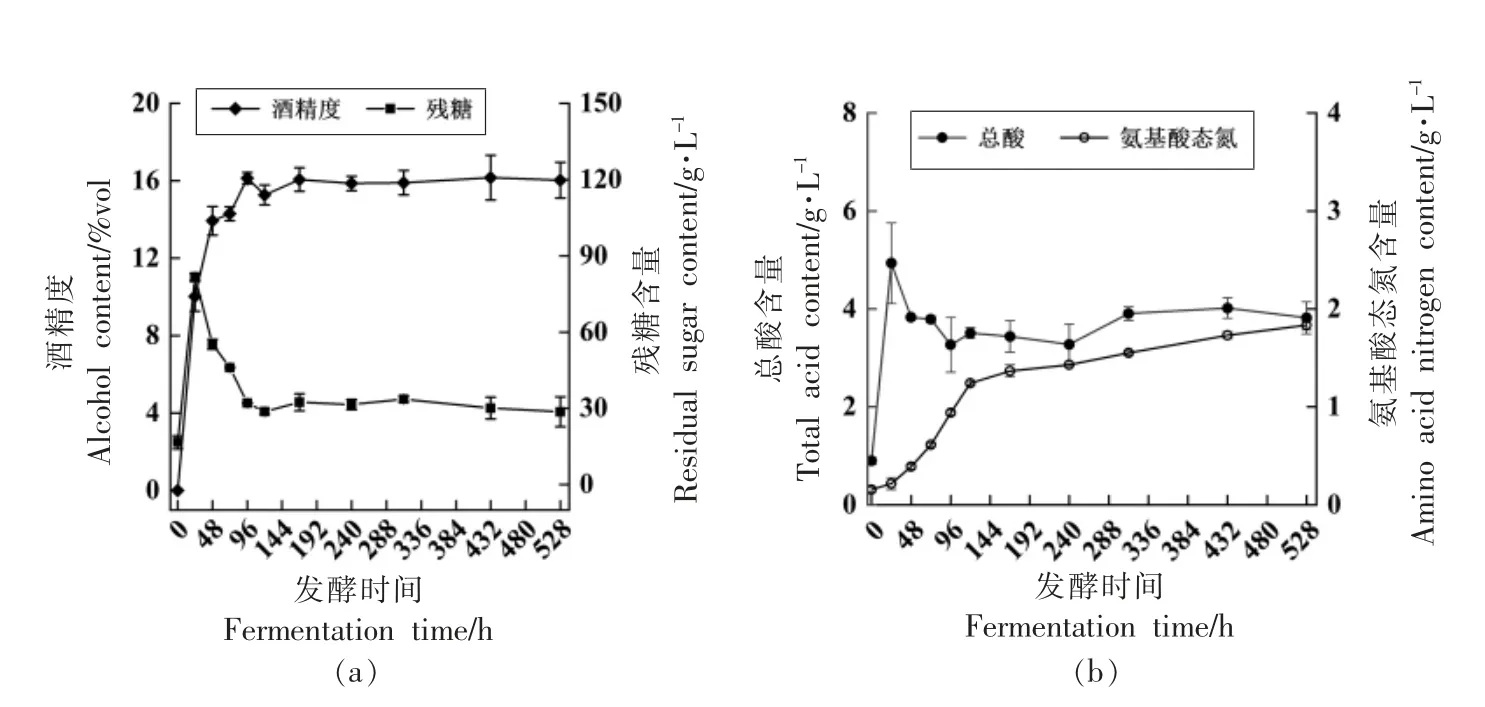
图1 黄酒发酵过程中理化指标的变化Fig.1 Changes of physicochemical indexes of Huangjiu brewing
陈青柳等[27]对机械化黄酒酿造发酵过程中的理化指标进行动态检测,发现理化指标在0~48 h变化最为迅速,后酵过程中理化指标变化缓慢趋于稳定,与本试验结果相符。周佳冰等[17]研究了不同黄酒酵母发酵过程理化指标的变化曲线,理化指标均在前酵过程中快速变化,后酵趋于稳定,说明理化指标的变化主要在前酵过程中。
2.1.2 黄酒发酵过程中黄曲霉生物量的变化 通过Primer-blast 模拟比对,排除特异性较差的引物β-Tub-F/R,引物Af-F/R 特异性高而扩增产物长度为73 bp,因此以黄酒生产中筛选到的14 种真菌为模板,对引物Ao-F/R 进行特异性验证,黄酒酿造中的真菌主要有酵母属、曲霉属以及笄霉属[6],米曲霉是由黄曲霉驯化而来,被认为是黄曲霉亚种,因此在定量黄曲霉过程中Ao-For/Rev 可以扩增黄曲霉和米曲霉,琼脂糖凝胶电泳扩增得到的产物长度与目的基因长度相符(图2)。生物量的测定参考路虎和陈笔等[8-9]建立的qPCR 方法,经qPCR 扩增反应熔解曲线呈现单一熔解峰(图3a),说明产物特异性良好,无非特异性扩增;然后以黄曲霉孢子浓度与Ct 值做标准曲线 (图3b),结果具有良好的线性关系,R2大于0.999,斜率为-0.3137,对应的扩增效率为105%,满足qPCR 的基本要求。经过适用性验证,回收率在86%以上,能够较准确的将添加的黄曲霉进行定量分析,说明该方法适用于黄酒体系中黄曲霉生物量的定量分析。
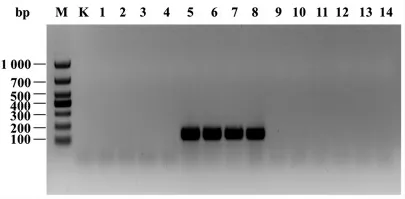
图2 引物扩增产物凝胶电泳图Fig.2 Gel electrophoresis of PCR products
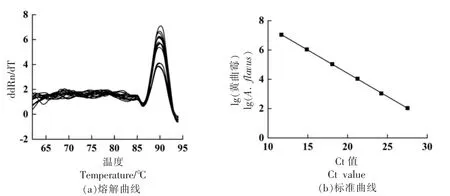
图3 黄曲霉的熔解曲线及标准曲线Fig.3 Melting curve and standard curve of A.flavus
采用qPCR 方法对黄酒发酵过程中黄曲霉的生物量进行跟踪检测。结果如图4所示,黄曲霉的生物量变化在0~24 h 变化最大,48 h 时增殖到105.87CFU/g,生物量达到最高,之后呈波动下降趋势,发酵结束后生物量降低至104.37CFU/g,低于初始接种量,黄曲霉在发酵过程中呈先增后降的变化趋势。路虎等[8]和Chen 等[9]的研究结果显示,塔宾曲霉和链霉菌均在制曲阶段微生物明显增加,在堆积/酒醅发酵过程中,随着发酵的进行生物量有所减少;蔡琪琪等[28]采用PCR-DGGE 结合qPCR 定量检测的方法发现红曲霉在酿酒过程中被抑制。黄曲霉的生物量增加发生在发酵初期(0~48 h),此阶段发酵环境发生变化,乙醇含量从0%vol 升高至10%vol 以上,总酸含量由(0.9±0.07)g/L 升高至(3.83±0.04)g/L,之后在一定的乙醇(>10%vol)和酸度(>4 g/L)的发酵环境中,黄曲霉的生物量开始下降。说明发酵环境的变化可能影响到了黄曲霉的生长。
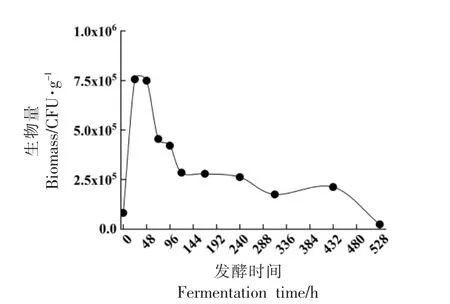
图4 黄酒发酵中黄曲霉生物量的变化Fig.4 Changes of A.flavus biomass during Huangjiu brewing
2.2 乙醇对黄曲霉SU-16 生长的影响
乙醇是黄酒发酵的重要代谢产物,占到发酵环境的0~17%vol,在前酵过程中乙醇快速增加,至120 h 乙醇可增加至10%vol 以上。乙醇的含量不仅影响黄酒的品质,还会对微生物有一定的抑制作用[28]。乙醇对黄曲霉SU-16 生长的影响如表3和图5所示,随着乙醇含量的增加,黄曲霉SU-16 的生长均呈下降趋势,与对照组(0%vol)相比,添加乙醇均对菌落生长产生显著影响 (P<0.05)(图5a),其中乙醇含量≥5%vol 时,严重影响到了孢子的萌发(表3)。乙醇含量为1%vol 时,对黄曲霉SU-16 生物量的影响差异不显著(P>0.05),而乙醇含量为3%vol 时,对黄曲霉SU-16 的生物量影响显著(P<0.01),当乙醇含量≥5%vol 时,黄曲霉SU-16 生物量变化呈下降趋势(图5b)。因此,可以确定黄酒发酵的代谢产物(乙醇) 对黄曲霉SU-16 的生长具有显著的影响,其中乙醇含量≥5%vol 时,严重影响到了孢子的萌发。

表3 乙醇对黄曲霉SU-16 生长的影响Table 3 Effects of ethanol on the growth of A.flavus SU-16
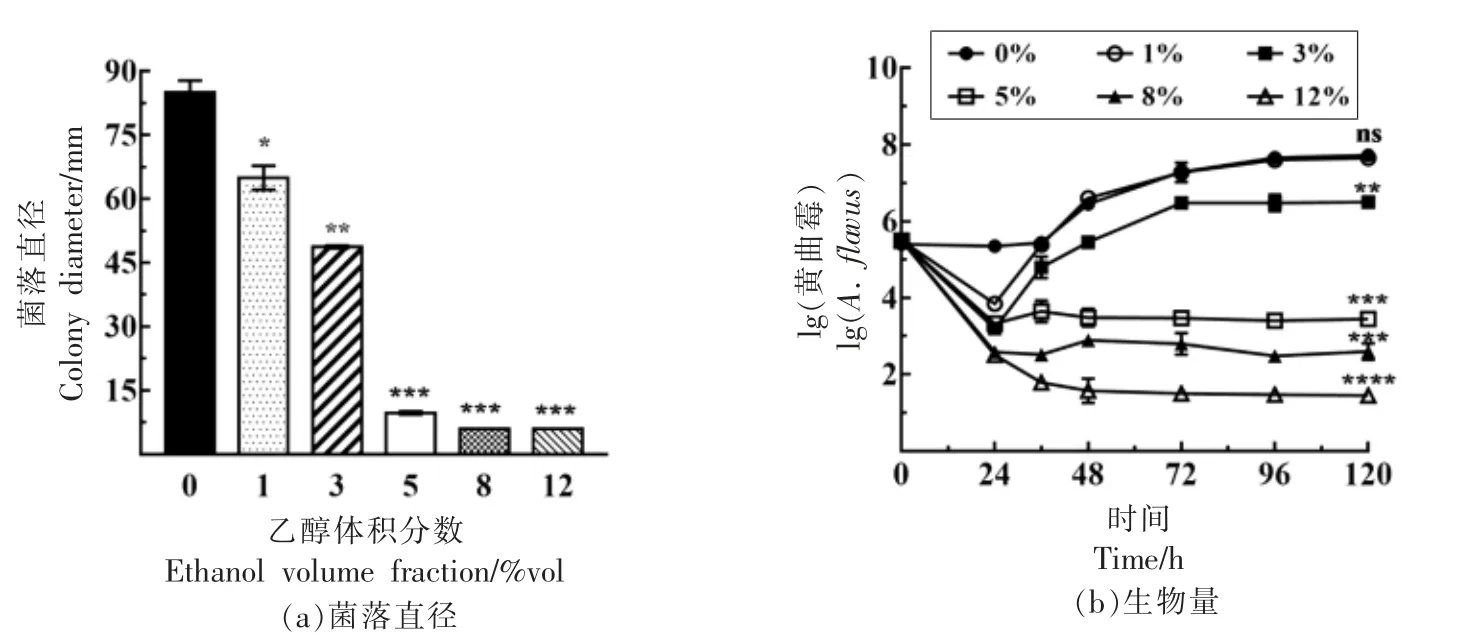
图5 乙醇对黄曲霉SU-16 生物量的影响Fig.5 Effects of ethanol contents on the growth of A.flavus SU-16
黄永光等[29]对酱香白酒中曲霉菌进行分离并研究Aspergillus hennebergii 酶分泌胁迫条件,结果显示乙醇含量>8%vol 时,对Aspergillus hennebergii 的生长和产酶存在抑制;蔡琪琪等[28]研究结果显示发酵初期的酒精度(<4%vol)对红曲霉无影响,而随着酒精度的增加,红曲霉的生长逐渐受到抑制;Vinayavekhin 等[14]对黑曲霉的乙醇耐受性进行研究,结果显示黑曲霉对乙醇的耐受浓度为5%vol。由此可见,不同菌株对乙醇的耐受性不同,黄曲霉SU-16 的乙醇耐受能力在5%vol 左右。然而黄曲霉对于乙醇胁迫的耐受机制尚不明确,这对其在黄酒酿造中生存和适应高乙醇环境至关重要。乙醇是一种小的二碳醇,易溶于水和脂类环境,可以通过增加膜的流动性而通过质膜进入细胞,这种膜流动性的增加导致膜完整性的丧失,从而增加渗透性,同时乙醇还会改变线粒体的结构,降低ATP 的水平和细胞呼吸频率,并促进乙醛和活性氧的生成,从而导致脂质过氧化、DNA 损伤和氧化应激,最终降低细胞活力[30]。马龙等[31]研究了米曲霉响应乙醇胁迫机制,结果表明乙醇可能引起了细胞内部的变化,如细胞核不规整和空泡的增加,对菌丝生长和分生孢子形成产生抑制作用,并且这种抑制作用随着乙醇含量的增加而显著增强。
2.3 有机酸对黄曲霉SU-16 生长的影响
有机酸是黄酒发酵过程中重要的呈味和呈香物质,同时具有一定的抑制杂菌的作用[15],总酸含量不断增加,其中含量最多的有机酸为乳酸和乙酸[32],乳酸占到总酸含量的75.30%,乙酸占到总酸的8.59%。乳酸和乙酸对黄曲霉SU-16 生长的影响如表4和图6所示,随着乳酸和乙酸浓度的增加,黄曲霉SU-16 的生长均呈下降趋势,与对照组(0 g/L)相比,添加乳酸和乙酸均对菌落生长和生物量产生显著影响(P<0.05),然而乳酸的添加不能完全抑制到孢子的萌发,当乙酸≥4 g/L 时,孢子不能萌发,生物量不断下降,因此,可以确定乳酸和乙酸的添加对黄曲霉SU-16 的生长具有显著影响,同时黄曲霉SU-16 对乳酸的耐受大于8 g/L,对乙酸的耐受界于2~4 g/L 之间。
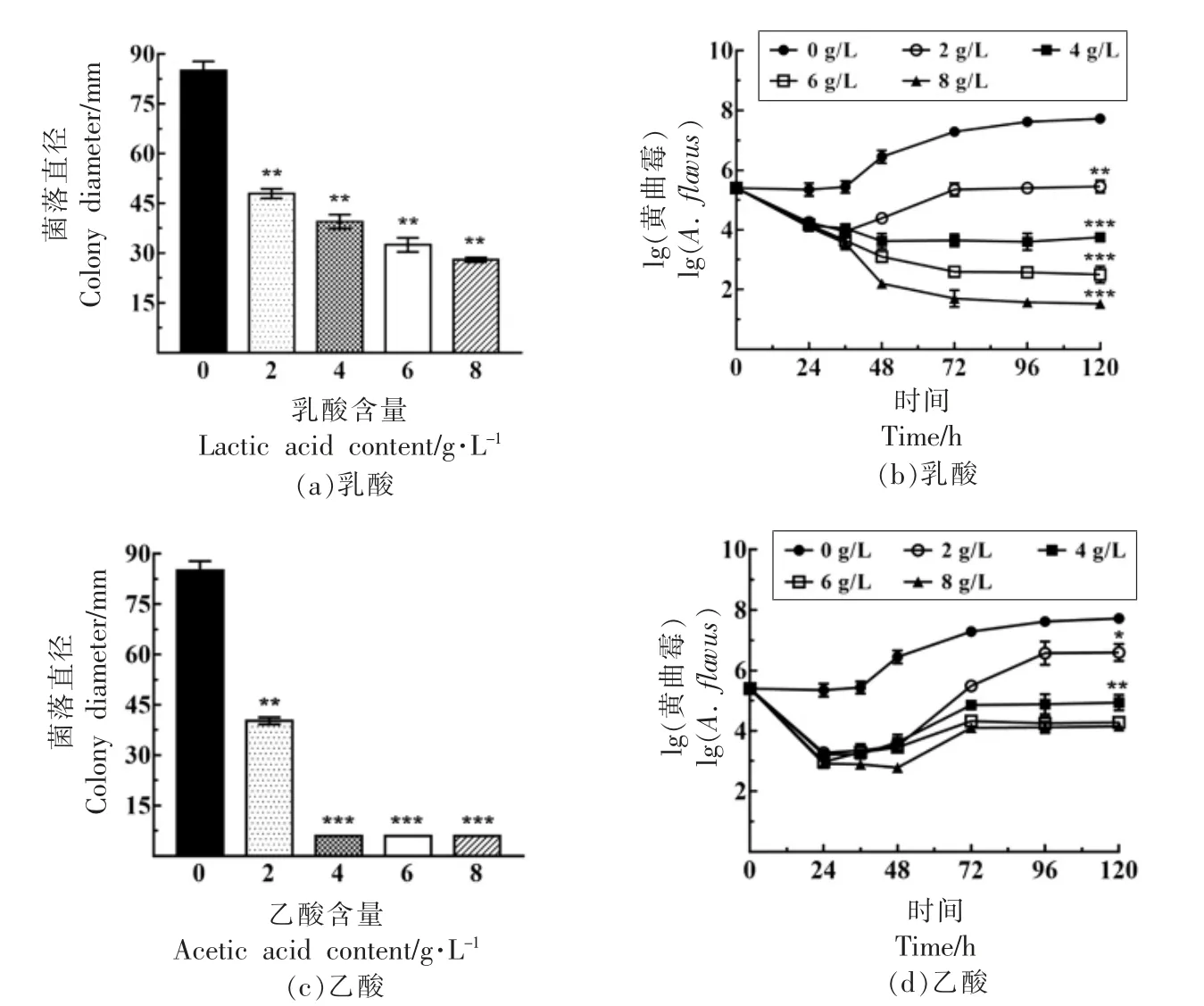
图6 有机酸对黄曲霉SU-16 生物量的影响Fig.6 Effects of organic acid on the growth of A.flavus SU-16

表4 有机酸对黄曲霉SU-16 生长的影响Table 4 Effects of organic acid on the growth of A.flavus SU-16
有机酸不同于强酸,以非解离形式存在,这种形态可以自由渗透到微生物质膜中,进而产生胞内酸化抑制微生物生长[33]。乙酸的毒性作用严重影响微生物生长与物质代谢过程,Casey 等[15]研究显示乙酸能够抑制酿酒酵母对葡萄糖与木糖的利用,从而抑制其生长;León 等[34]研究了不同浓度乙酸和乳酸对黄曲霉的影响,结果显示非产毒黄曲霉对乙酸的耐受浓度为41.6 mmol/L (约2.498 g/L),对乳酸耐受浓度为357.7 mmol/L(约32.222 g/L)[35],以上研究结果与黄曲霉SU-16 乙酸耐受性相似,而乳酸耐受性仍有待进一步探究;同时邓楠[35]研究了酿酒酵母的乳酸耐受机制,结果显示当乳酸质量浓度为40 g/L 时,严重影响到了酿酒酵母的产乙醇代谢特性[36],说明乙酸对菌株的毒害作用远远强于乳酸。
2.4 间歇通氧对黄曲霉SU-16 生长的影响
黄酒发酵过程中会通过间歇开耙来为微生物提供一定的氧气,因此采用摇瓶培养以及间歇摇瓶培养的方式探究通氧量对黄曲霉SU-16 生长的影响,如图7所示,在摇瓶培养条件下24~36 h时,黄曲霉SU-16 的生物量快速增加,之后缓慢增加。而在间歇摇瓶培养条件下36~48 h 时,孢子萌发开始产生大量菌丝,生物量快速增加。因此通氧量会影响到黄曲霉SU-16 孢子的萌发速率以及菌丝生长的速率,然而120 h 时2 种培养条件下黄曲霉SU-16 生物量差异不显著,由此可以推断黄酒发酵的微氧环境会对黄曲霉的生长速率产生一定影响,然而对最终生物量影响不显著(P>0.05),说明间歇通氧的方式可以满足黄曲霉生长所需氧气量。因此,通氧量不是影响黄酒发酵体系中黄曲霉生长的主要因素。蔡琪琪等[28]探究了溶氧量对红曲霉生长的影响,结果显示在封坛后发酵体系中残留的氧气仍可以满足红曲霉的生长,结果与本试验一致。因此可以确定发酵环境中的乙醇和有机酸类物质是影响黄曲霉生长的主要因素。
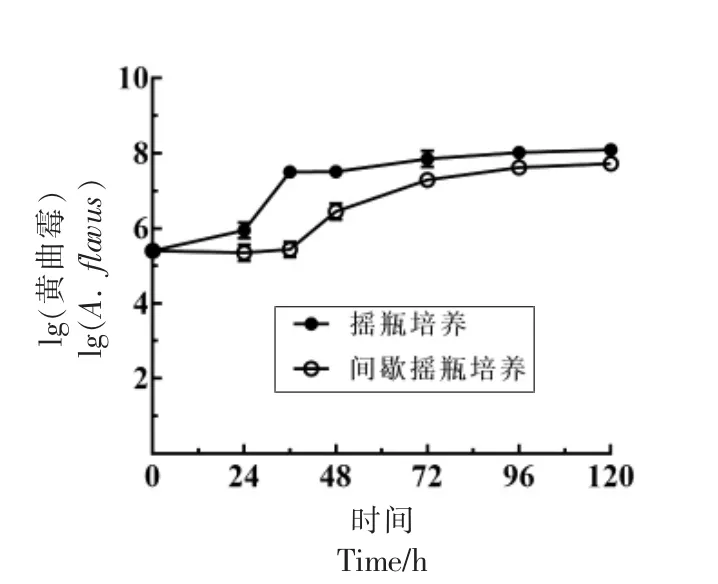
图7 通氧量对黄曲霉SU-16 生物量的影响Fig.7 Effect of oxygen supply on biomass of A.flavus SU-16
3 结论与讨论
黄曲霉被广泛应用于工业化生产过程中以加快发酵的进行,对黄酒的发酵至关重要。生物量是表征微生物生长情况的重要指标,运用qPCR 方法对黄酒发酵过程中黄曲霉进行定量分析,结果显示在0~24 h 这段时间内,黄曲霉生物量的变化最大,然而也只是增加了1 个数量级,随着发酵的进行,发酵醪液中乙醇和酸度含量上升(图1),严重抑制了黄曲霉的生长和代谢,使其开始趋于不断下降的趋势,因此制曲阶段是黄曲霉生长的必要阶段,而发酵阶段不利于黄曲霉的生长。基于包括DGGE、高通量测序、宏基因组测序等在内的免培法研究黄酒发酵环境中微生物种群结构的结果表明,黄曲霉是黄酒发酵过程中真菌群落结构组成中的优势物种[5-6],其在黄酒发酵过程中的生态学意义、功能信息已有大量报道[6,33],研究普遍发现,霉菌呈先减少后增加的变化趋势[6,37],其中曲霉属占到霉菌的94%~99%;然而,与以往的研究结果不同,基于qPCR 检测黄曲霉SU-16 的结果表明,黄酒发酵过程中黄曲霉的生物量一直处于较低水平,呈先增加后减少的趋势,这主要是由于高通量测序表示物种的相对丰度,受到整体微生物含量的影响(例如:黄酒发酵初期黄酒酵母快速增加,随着发酵时间的延长黄酒酵母急剧减少,对物种相对丰度影响较大),而qPCR 表示物种的绝对含量,不受其它物种的影响。同时,已有大量研究报道的白酒酿造微生物相关的研究也证明了这一点,基于扩增子测序和宏基因组测序报道的部分物种的丰度与其绝对定量结果存在明显差异[9,38]。因此,发酵环境中微生物的研究不能脱离微生物的生长情况,基于免培法的测序手段解析发酵过程中微生物物种组成、功能信息等的研究存在一定的缺陷[39-40]。
通过发酵间歇通氧以及发酵代谢产物(乙醇和有机酸) 对黄曲霉SU-16 的生长影响探究,结果表明黄酒发酵过程中间歇通氧可以满足黄曲霉SU-16 的生长耗氧需求,乙醇、乳酸和乙酸均对黄曲霉SU-16 的生长有影响,其中乙醇为3%vol,乳酸为2 g/L,以及乙酸为2 g/L 时即影响显著,主要表现为影响了孢子萌发和菌丝生长。微生物的胁迫作用一方面通过改变细胞膜结构或者线粒体活力[30],一方面通过渗透作用引起细胞死亡[33],随着发酵时间的延长,乙醇和有机酸不断积累,然而微生物耐受能力有限,黄曲霉SU-16 对于乙醇的耐受能力为5%vol,在发酵48 h,乙醇含量达到11.24% ± 0.74%vol,此时乙醇含量超过黄曲霉SU-16 的耐受能力,所以生物量开始不断下降;黄曲霉SU-16 对乳酸的耐受能力>8 g/L,对乙酸的耐受能力界于2~4 g/L,黄酒发酵过程中乳酸呈先快速增加后缓慢增加的趋势,发酵结束时达到(5.57 ± 0.20)g/L,乙酸呈先升后降的趋势,在120 h 时最高达到(0.56 ± 0.02)g/L,因此在发酵过程中乙醇起到主要抑制黄曲霉生长的作用。乙醇和弱酸对黄曲霉生长影响的分子机制仍有待进一步的研究,以上研究结果可为黄酒发酵的精准调控提供一定的指导,同时对其它微生物的相关研究具有借鉴意义。

