超高压处理对乳蛋白结构和致敏性的改善作用
吴相佚,刘泽朋,高婧昕,郭凯睿,毛学英
(中国农业大学食品科学与营养工程学院 教育部-北京市共建功能乳品重点实验室 北京 100083)
牛乳在膳食营养中占有重要地位,富含优质蛋白质、矿物质和维生素等。乳蛋白的必需氨基酸种类齐全,配比合理,营养价值高。乳蛋白主要包括酪蛋白和乳清蛋白,两者比例约为80∶20。牛乳蛋白,不易被婴幼儿消化吸收,易引发过敏反应,这与其自身的组成和结构特点密切相关。酪蛋白在婴幼儿胃内酸性环境下易形成乳凝块,消化缓慢[1-2]。另外,在牛乳乳清蛋白中β-乳球蛋白含量高,约为乳清蛋白总量的50%,而母乳不含β-乳球蛋白[3]。β-乳球蛋白中心形成疏水性结构,使其易于结合脂肪酸,导致β-乳球蛋白不易被胃肠道蛋白酶水解,在胃肠道停留时间长,从而引起消化不良且易发生过敏反应[4]。牛乳是八大过敏原之一,约有2%~3%的婴幼儿甚至1%的成年人,在摄入乳蛋白后会发生过敏反应[5]。牛乳蛋白过敏会出现腹泻、呕吐、拒奶等现象,影响婴幼儿的生长发育,症状严重时会引起过敏性休克,甚至死亡。建立适当的乳蛋白改性方法,以提高其消化性,降低致敏性具有重要意义。
目前,主要通过物理改性、化学改性和酶法改性等方法处理乳蛋白,改变蛋白质的理化性质和结构,以达到改善蛋白质功能特性的目的[6]。最常用的乳蛋白改性方法为热处理,然而,在热处理过程中,乳蛋白结构会发生不可逆改变,形成大分子聚合物,溶解度降低,从而影响产品质量[7]。过度加热还会产生异味和有害物质等[8]。超高压作为一种非热食品加工技术,通过作用于蛋白质的疏水键、氢键等非共价键改变其高级结构,从而改善蛋白质的功能特性[9]。超高压处理后蛋白质结构变得更加松散,暴露出更多的酶切位点,促进酶解反应[10-11]。经超高压处理后,乳清分离蛋白的体外消化率显著提高[12]。经400 MPa 处理后,乳清浓缩蛋白的酶解程度升高,且蛋白水解度随超高压处理时间的延长而增加[13]。400 MPa 处理30 min,能够显著提高乳清蛋白的消化率[14]。超高压通过改变蛋白结构,达到降低乳清分离蛋白致敏性的效果[15]。然而,目前关于超高压对乳蛋白消化性和致敏性影响的研究大多集中于单一乳蛋白,超高压处理对乳蛋白浓缩物的消化特性和致敏性的影响鲜有报道。乳品加工过程中蛋白质的相互作用也会影响蛋白质的结构和特性。本研究采用超高压处理乳蛋白浓缩物,探究其结构、可消化性和致敏性的变化,为乳蛋白浓缩物的应用提供理论基础。
1 材料与方法
1.1 材料与试剂
牛乳浓缩蛋白(Milk protein concentrate 80,MPC80):蛋白含量为80%,脂肪含量为4%,乳糖含量为6%,灰分含量为8%,恒天然;胃蛋白酶、胰蛋白酶,美国Sigma 公司;十二烷基硫酸钠、丙烯酰胺、三羟甲基氨基甲烷、甲叉丙烯酰胺、过硫酸铵、N,N,N,N'-四甲基乙二胺,美国Amresco 公司;甘氨酸,北京索莱宝有限公司。
1.2 仪器与设备
SHZ-88A 水浴恒温振荡器,北京天林恒泰科技有限公司;METTLER TOLEDO pH 计,梅特勒·托利仪器有限公司;酶标仪,伯乐生命医学产品(上海)有限公司;RF-6000 荧光分光光度计,岛津基团(香港)有限公司;MOS-500 圆二色谱仪,法国Bio-Logic 公司。
1.3 试验方法
1.3.1 样品的制备 称取一定量的MPC80,加入去离子水溶解,用磁力搅拌器在室温下搅拌2 h使其充分水合,配制成40 mg/mL 的蛋白溶液,分别于0.1,300,400,500 MPa 压力下保压10 min。冷冻干燥后用于下一步分析。
1.3.2 游离巯基含量的测定 采用Ellman's DTNB 法测定MPC 的游离巯基含量[16]。称取1.3.1节制备的蛋白样品,加入去离子溶解,使其质量浓度为2 mg/mL。取1 mL 蛋白溶液,依次加入4.0 mL Tris-Gly 缓 冲 液Ⅰ (0.086 mol/L Tris,0.09 mol/L Gly,5 mmol/L EDTA,pH 值为8.0) 和50 μL 的Ellman's 试剂,混合均匀后于37 ℃恒温培养箱反应15 min。反应后在412 nm 波长处测定体系的吸光值。采用公式(1)计算游离巯基含量:

式中,A412nm——为样品在412 nm 波长下的吸光值;D——稀释倍数;C——样品质量浓度(mg/mL)。
Ellman's 试剂配制:称取0.2 g DTNB,溶于50 mL Tris-Gly 缓冲液Ⅰ,避光4 ℃保存。
1.3.3 ANS 荧光探针法测定表面疏水性 采用ANS 荧光探针法[17]测定不同压力处理后MPC 的表面疏水性。将1.3.1 节制备的蛋白样品用0.01 mol/L PBS(pH 7.4)溶解为0.2,0.4,0.8 mg/mL 的溶液,在2 mL 蛋白溶液中加入10 μL 的ANS(8 mmol/L),充分混匀。在激发波长390 nm,发射波长470 nm,电压400 V,夹缝宽度5 nm 的条件下,测定荧光强度。绘制荧光强度随蛋白浓度变化曲线,曲线的初始段斜率即为样品表面疏水性。
1.3.4 乳蛋白二级结构测定 采用圆二色光谱(Circular dichroism,CD)[18]法测定MPC 的二级结构。称取适量1.3.1 节制备的蛋白样品,加入去离子水充分溶解,配制成0.2 mg/mL 的溶液。圆二色光谱仪的扫描范围为190~250 nm,样品池光程1 mm,环境温度25 ℃,扫描速度100 nm/min,谱带宽度1.0 nm。以去离子水为空白对照。
1.3.5 模拟胃肠消化 用去离子水溶解样品,制备40 mg/mL 的蛋白质溶液,进行模拟胃肠消化,具体操作方法如下:
1)将不同压力处理后的蛋白溶液的pH 值调节为2.0,按2%(质量分数)酶与底物比加入胃蛋白酶,置于恒温振荡器中酶解2 h,期间控制温度为37 ℃。其中一部分冷冻干燥待用,另一部分用于进一步酶解。
2)将上述用胃蛋白酶酶解2 h,蛋白溶液的pH 值调节为7.5,以2%(质量分数)酶与底物比加入胰蛋白酶,置于恒温振荡器中酶解2 h,期间控制温度37 ℃。酶解液冷冻干燥待用。
1.3.6 SDS-PAGE 电泳 根据Wang 等[19]的方法进行SDS-PAGE 电泳。称取1.3.1 节和1.3.5 节制备的消化前、后的样品,加入去离子水充分溶解,加入一定量的上样缓冲液,使其质量浓度为4 μg/μL,充分振荡混匀,在沸水中加热5 min。配制12%的分离胶和5%的浓缩胶。每孔上样量为5 μL,90 V 电泳待Marker 条带分开后,将电压调整为110 V。电泳结束后将胶置于考马斯亮蓝中染色2 h,之后用脱色液过夜脱色。
1.3.7 抗原性的测定 乳清蛋白中β-乳球蛋白是主要的过敏原,显著影响牛乳的过敏性[20],因此主要测定超高压处理后β-乳球蛋白的抗原性。β-乳球蛋白试剂盒操作步骤如下:每孔加100 μL 稀释的包被抗体;室温(20~25 ℃)孵育1 h;清洗平板5 次;每孔加入200 μL 封闭液;室温孵育30 min;清洗平板5 次;向孔中加入100 μL 标准品或样品;室温孵育1 h;清洗平板5 次;每孔加100 μL稀释的HRP 检测抗体;室温孵育1 h;清洗平板5次;每孔加入100 μL TMB 底物溶液;室温下避光静置15 min;每孔加入100 μL 反应终止液终止反应;450 nm 波长处检测吸光值。
1.3.8 数据分析 试验结果以3 次重复试验的“平均值±标准差”表示。采用SPSS 17.0 软件对所得数据进行统计。采用Independent samples Ttest 进行分析,比较2 组数据间是否具有显著差异,
采用单因素方差分析(One Way ANOVA)伴随Duncan's 多重比较,分析多组数据间是否具有显著差异,P<0.05 时认为差异显著。
2 结果与分析
2.1 超高压处理对MPC 蛋白聚合的影响
经不同超高压处理后MPC 的SDS-PAGE 图谱如图1所示。与对照组(泳道1)相比,经超高压处理后样品的β-乳球蛋白条带明显变浅,而不同压力处理后酪蛋白和α-乳白蛋白条带深浅无明显变化。观察还原型电泳以及非还原型电泳的图谱,可以看出非还原型电泳的胶孔处有聚集物,而该聚集物在还原型电泳的胶孔消失,提示经过超高压处理形成的β-乳球蛋白聚合物之间通过二硫键结合而成。100 MPa 以上的高压处理会引起β-乳球蛋白变性,其变性程度随压力增加而增加,而α-乳白蛋白对压力具有较强的耐受性,在高压下的稳定性高于β-乳球蛋白[21];这是因为β-乳球蛋白含有2 个二硫键和1 个游离巯基,对压力较敏感,而α-乳白蛋白不含有游离巯基[10]。Dimuthu等[22]通过SDS-PAGE 分析了不同高压处理后α-乳白蛋白的聚集程度,结果发现与对照组相比,α-乳白蛋白条带没有明显变化,表明α-乳白蛋白未发生明显聚集,与本研究结果一致。
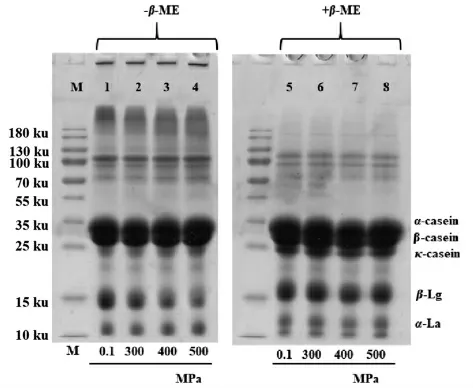
图1 不同压力处理后MPC 的SDS-PAGE 图谱Fig.1 SDS-PAGE of MPC treated with different high hydrostatic pressures
2.2 超高压处理对MPC 游离巯基含量的影响
经过超高压处理后MPC 的游离巯基含量变化如图2所示。随着处理压力升高,MPC 的游离巯基含量逐渐降低,在500 MPa 时达到最低。卫永华等[23]发现乳清分离蛋白中游离巯基的含量随超高压处理压力(0~500 MPa)的上升而下降,二硫键含量随超高压处理压力升高而增加。此外,Hu 等[24]采用超高压对α-酪蛋白进行处理,发现压力升高后游离巯基含量下降。以上结果与本研究变化趋势一致。说明超高压处理诱导MPC 中游离巯基和二硫键之间发生交换反应,从而形成新的二硫键[25]。

图2 不同压力处理后MPC 的游离巯基含量Fig.2 The free sulfhydryl content of MPC treated with different high hydrostatic pressures
2.3 超高压处理对MPC 表面疏水性的影响
经过超高压处理后MPC 的表面疏水性变化如图3所示。经过超高压处理后MPC 的表面疏水性升高,且随着超高压处理强度的增加而升高。蛋白质分子由氨基酸通过共价键连接,并由非共价键维持其高级结构,其中疏水相互作用在维持蛋白质高级结构中有重要地位[26]。蛋白质表面疏水性可表征蛋白质分子表面与极性环境的疏水基团数量,与其功能性质密切相关,且在稳定蛋白质的三级结构和四级结构中具有重要作用[27-28]。在水溶液中,ANS 与蛋白质疏水区域结合后荧光强度会剧烈增加,此特性已被广泛用作荧光探针测量蛋白质的表面疏水性[29]。超高压处理能使蛋白质分子的高级结构打开,包裹在蛋白质内部的疏水基团暴露,表面疏水性升高[30]。庞佳坤等[25]发现200 MPa 以上的压力能显著提高乳清分离蛋白的表面疏水性;Liu 等[31]研究表明乳清浓缩蛋白(WPC)经600 MPa 超高压处理2.5 min 后,其表面疏水性提高了1.4 倍。以上研究结果与本研究的变化趋势一致。
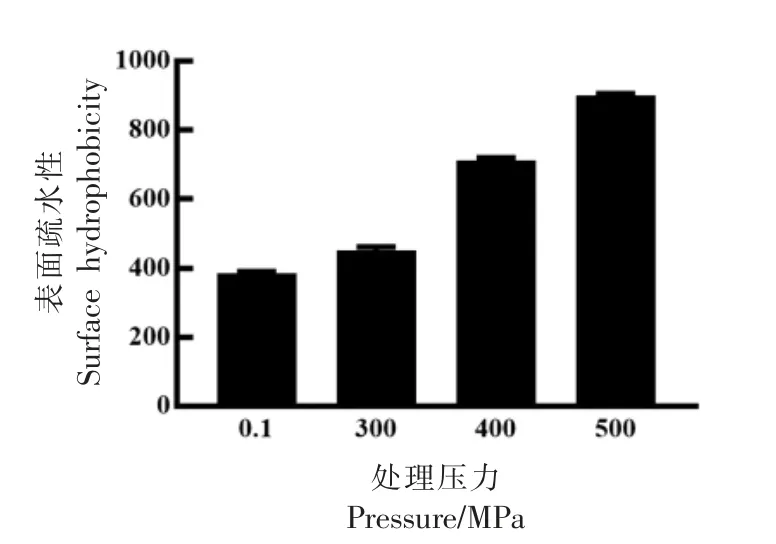
图3 不同压力处理后MPC 表面疏水性的变化Fig.3 Effect of different high hydrostatic pressures on the surface hydrophobicity of MPC
2.4 超高压处理对MPC 二级结构的影响
经超高压处理后MPC 的二级结构变化如图4所示,经不同压力处理后MPC 的圆二色图谱变化趋势相似(图4)。根据圆二色谱数据,通过k2d算法计算样品α-螺旋、β-折叠、β-转角以及无规则卷曲结构的含量[32],超高压处理对MPC 二级结构含量的影响如图5所示。由图5可知,未经处理的MPC 中二级结构以β-折叠和无规则卷曲为主,经过300 MPa 处理后,MPC 的二级结构无明显变化,而经过400 MPa 和500 MPa 处理后,MPC 的α-螺旋和β-转角含量逐渐降低,而β-折叠含量升高。

图4 不同压力处理后MPC 的圆二色谱Fig.4 Circular dichroism spectra of MPC treated with different high hydrostatic pressures

图5 不同压力处理对MPC 二级结构含量的影响Fig.5 Effect of different high hydrostatic pressures on the secondary structure content of MPC
2.5 超高压处理对MPC 消化特性的影响
为明确超高压处理对乳蛋白消化特性的影响,对经超高压(500 MPa)处理后MPC 进行胃肠模拟消化,胃肠模拟消化产物的SDS-PAGE 电泳分析图谱如图6所示。与未经胃肠模拟消化的MPC 相比,经胃消化后蛋白条带变浅,样品中完整蛋白含量减少(泳道2 与5),且在胃消化阶段酪蛋白的消化程度高于乳清蛋白。经过肠消化后(泳道3 与泳道6),0.1 MPa (即未经超高压处理的样品) 与500 MPa 处理样品的酪蛋白条带消失;超高压处理(500 MPa)MPC 的乳清蛋白条带变浅,表明乳清蛋白消化率经500 MPa 超高压处理后提高。Hu 等[24]等报道经超高压处理后α-酪蛋白的消化率升高,经200 MPa 处理5 min 其消化率从32.49%上升至48%。Iskandar 等[33]研究表明经550 MPa 处理1 min,乳清蛋白的消化率显著提高。这主要归因于超高压处理使蛋白结构变得松散,暴露出更多的酶切位点,从而增加其可消化性[34]。
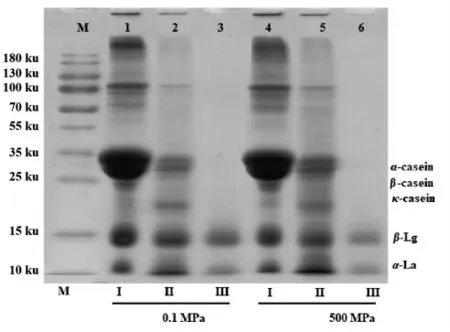
图6 超高压MPC 体外胃肠模拟消化物的SDS-PAGE 图谱Fig.6 SDS-PAGE of simulated gastrointestinal digested MPC after high hydrostatic pressure treatments
2.6 超高压处理对乳蛋白致敏性的影响
用β-乳球蛋白的抗原性反映其致敏性的强弱。经过超高压处理及胃肠消化前、后MPC 的抗原性如图7所示。与对照组相比,经过超高压处理后β-乳球蛋白致敏性显著降低,且经过胃肠模拟消化后,对照组和超高压处理MPC 的致敏性均显著下降,且超高压处理MPC 经过胃肠模拟消化后致敏性下降程度更显著。乳蛋白的致敏性与其线性表位和构象表位有关,适当强度的超高压处理引起的蛋白结构变化,会破坏构象表位,从而降低其致敏性[30]。Meng 等[20]发现β-乳球蛋白经过500 MPa 处理后,其致敏性显著降低,与本结果一致。本研究中,超高压处理不仅提高了β-乳球蛋白的消化率,还使得肠道中残留的β-乳球蛋白及β-乳球蛋白抗原表位含量降低,因此,超高压处理降低了乳蛋白致敏性。

图7 超高压处理对胃肠模拟消化前、后β-乳球蛋白抗原性的影响Fig.7 Effects of high hydrostatic pressure on the allergenicity of β-lactoglobulin before and after simulated gastrointestinal digestion
3 结论
经过不同强度超高压 (300 MPa/10 min,400 MPa/10 min 和500 MPa/10 min)处理后,乳蛋白浓缩物的蛋白聚合程度发生显著变化,主要表现为β-乳球蛋白发生共价结合,且超高压处理压力越高,其共价结合程度越高。乳蛋白的游离巯基含量随着处理压力的升高而逐渐降低,然而乳蛋白的表面疏水性显著升高。经过400 MPa/10 min 和500 MPa/10 min 处理后,乳蛋白的二级结构含量发生显著变化。经过500 MPa/10 min 处理后,蛋白质的可消化性显著升高,且500 MPa/10 min 处理能够显著降低乳蛋白的致敏性。因此,超高压处理能够改变乳蛋白的空间结构,从而提升其消化性并降低其致敏性。

