高镍三元正极材料镍钴铝的掺杂改性研究进展
侯顺丽,赵 段,周 庚,魏诗诗,李 健,王甲泰
(青海师范大学物理与电子信息工程学院,青海西宁 810000)
近年来,锂离子电池因具有较长循环寿命、可逆容量高和环境污染小等优点广泛应用于便携式电子设备和电动汽车等众多领域[1]。锂离子电池的充放电循环是Li+脱嵌的一个过程,充电时,Li+从LiCoO2正极材料脱出,经电解液嵌入碳负极,与此同时,Co3+被氧化,在外电路中,电子从正极运动到负极;放电则相反,Li+从负极脱出穿越隔膜及电解液嵌入正极,Co3+被还原,电子从外电路回到正极,其工作原理见图1,反应方程如(1)~(3)式(以层状钴酸锂、碳作正、负极材料为例)[2-3]。
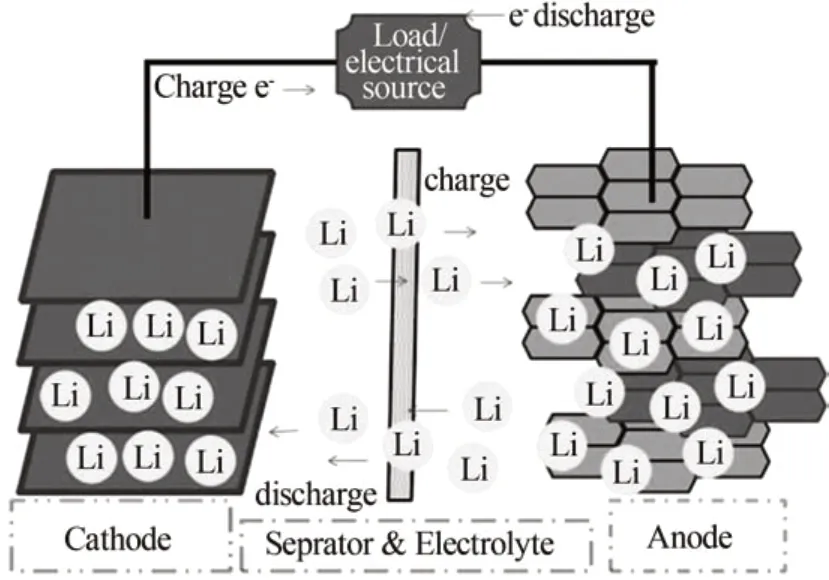
图1 锂离子电池工作原理[2]Fig.1 Working principle of Li-ion battery[2]
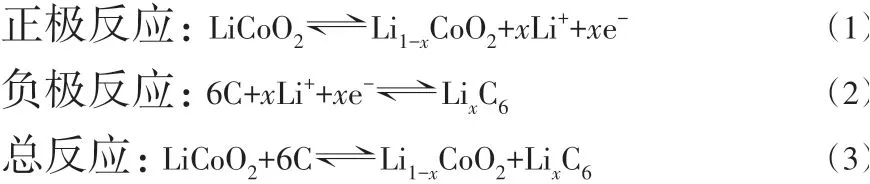
正极材料作为锂离子电池重要的组成部分,是影响电池性能的关键因素之一,在众多锂离子电池正极材料中,高镍三元镍钴铝(NCA)正极材料具有α-NaFeO2层状结构和R-3m空间点群,其中Li+位于3a位,过渡金属离子(M)位于3b位,O2-位于6c位,其晶体结构如图2所示[4]。NCA具有较高的能量密度,Al3+不变价且Al—O键能较高、结构较稳定,但因其循环性能及倍率性能较差难以满足社会更高需求。

图2 三元材料晶体结构[4]Fig.2 Crystal structure of ternary materials[4]
1 Li[NixCoyAl(1-x-y)]O2容量衰减机理
造成NCA 循环性能及倍率性能差的主要原因是正极表面层状结构向无序岩盐结构转变和正极颗粒出现破碎[5]。
由于Ni2+(0.069 nm)和Li+(0.076 nm)离子半径相近,易造成Li+/Ni2+混排,且NCA 正极材料进行充放电循环时存在能量起伏变化,相近过渡金属离子很容易克服迁移势垒,穿越氧层进入锂层并占据锂的位置,降低了Li+迁移速率,进而造成材料层状结构发生相变和放电比容量的衰减,Li+迁移速率减慢,严重影响材料倍率性能[6-8]。
Li+的可逆脱嵌性使NCA 晶体结构发生收缩与膨胀,产生局部应力,由于材料中各个颗粒存在各向异性,在充放电循环过程中,局部应力累积导致颗粒产生破裂,电解液渗透到材料中,过渡金属发生溶解,造成材料部分容量损失及不可逆衰变,循环性能下降[9-10]。
综上所述,三元锂离子电池在反复循环过程中,一是正极材料将从表面层状α-NaFeO2型向无序岩盐相转化,造成容量快速衰减;二是正极材料晶界处产生微裂纹,进一步促使电解液与材料发生副反应,造成活性材料失活,导致容量衰减。
2 Li[NixCoyAl(1-x-y)]O2改性研究
为解决上述问题,目前研究者主要通过体相掺杂和表面包覆两个方面对NCA 进行改性。表面包覆通过减小界面反应稳定材料结构;体相掺杂通过调整晶格参数,从材料内部提高结构稳定性。体相掺杂是指通过掺入与材料中离子半径相近的离子,使其进入晶格代替原材料中的部分离子,以提高材料晶格能,从而稳定材料晶体结构的一种技术,是目前提高NCA结构稳定性最有效的方法之一,掺杂机理如图3所示[11]。不同的离子掺杂在层状六方结构中取代的位置不同,通常分为锂位(Li)掺杂、过渡金属位(M)掺杂、氧位(O)掺杂及复合共掺杂。
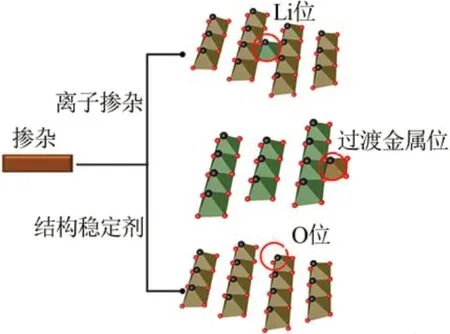
图3 离子掺杂机理示意图[11]Fig.3 Schematic diagram of ion doping mechanism[11]
2.1 Li位掺杂
在NCA 正极材料中,Li+主要沿着(003)晶面脱出和嵌入,其中Li+的迁移速率是影响材料电化学性能的重要因素[12-13]。因此,通过掺杂来改变锂层(003)晶面间距,对于提高正极材料的电化学性能具有重要作用,其掺杂机理如图4所示。由图4可知,较大半径的掺杂离子通过取代锂位降低Li+/Ni2+混排,扩展锂层间距与Li+运输通道,从而改善了材料的电性能[14]。
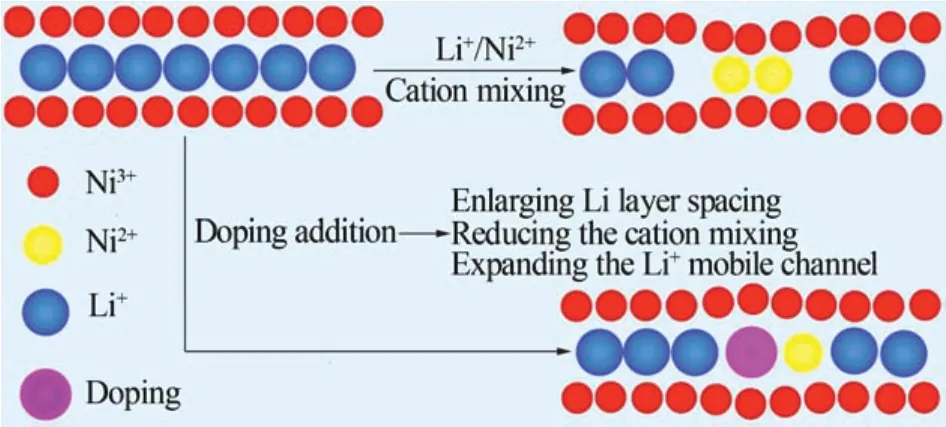
图4 Li位掺杂机理[14]Fig.4 Doping mechanism of Li site[14]
DONG等[15]采用纳米研磨辅助固态方法合成了Rb+掺杂的正极材料RbxLi1-xNi0.8Co0.15Al0.05O2(RNCA)。研究结果表明,具有较大离子半径的Rb+(0.151 nm)取代Li位,增大了锂层间距,提高了Li+脱嵌速率,随着Rb+浓度的增加,MO6八面体的板厚减小,增加了M—O键能,从而增强了材料的晶体结构稳定性,掺杂1%Rb+(掺杂量均为物质的量分数,下同)材料的电化学性能最优。2C 倍率、100 次循环后,NCA、RNCA1的放电比容量分别为89.9、143.9 mA·h/g,容量保持率分别为64.12%、91.31%,循环、倍率性能如图5所示。
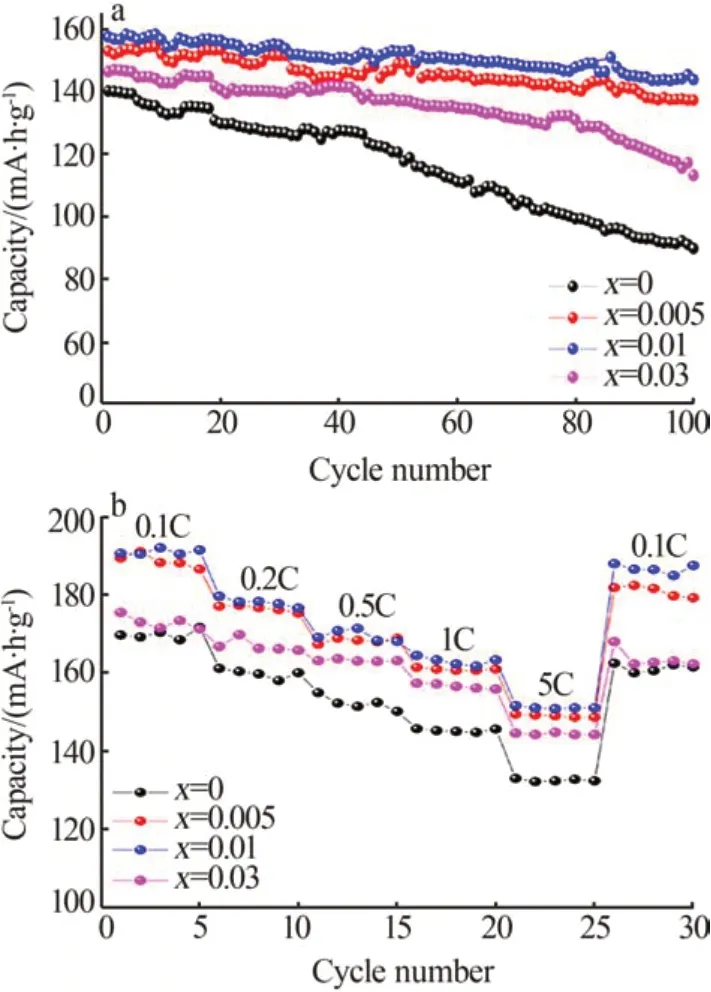
图5 2C放电速率下的循环性能测试图(a);倍率性能测试图(b)[15]Fig.5 Cyclic performance test chart at discharge rate of 2C(a);Rate performance test chart(b)[15]
XIE 等[16]研 究 了 掺 杂 Na+正 极 材 料LiNi0.8Co0.15Al0.05O2(Na-NCA)的结构和电化学性能。研究表明,Na+(0.102 nm)取代了Li位,增大了c轴和c/a的值,加快了Li+扩散速率,抑制了阳离子混排和H2→H3 相变,稳定了材料的晶体结构。在1C 倍率下、200次循环后,其中Na+掺杂量为1%时循环性能最佳,容量保持率高达90.71%,而未掺的仅为80.46%;循环性能及倍率性能改善明显。ZHAO等[17]研究了K+掺杂对LiNi0.8Co0.15Al0.05O2(K-NCA)正极材料微观形貌及电化学性能的影响。离子半径较大的K+(0.138 nm)取代Li 位,没有改变正极材料的球形形貌,而是抑制了阳离子混排,增加了锂板(LiO2)厚度,加快了Li+扩散速率,提高了材料的结构稳定性。在1C 倍率下、150 次循环后,NCA 容量保持率为66.3%,而K-NCA高达87.4%。
WANG 等[18]也研究了Na+取代Li 位,以上这些研究结果表明,通过较大粒径离子取代Li 位,扩展了锂层(003)晶面间距、Li+迁移速率加快、相变得到抑制,有效改善了材料的循环和倍率性能。但大多数掺杂离子由于本身的电化学惰性,造成了材料首次放电比容量的损失,因此选择何种离子进行掺杂,还需要更多的研究。
2.2 过渡金属(M)位掺杂
M 位是指NCA 晶体结构中过渡金属(Ni、Co、Al)所在的位置,它位于氧密集堆积的八面体间隙中,过渡金属离子通过氧化还原反应来得失电子。在充放电过程中,过渡金属离子会向锂层迁移,导致正极材料晶体结构由层状结构向尖晶石结构转变,影响材料的循环稳定性[19]。因此,选择合适的掺杂离子取代M 位,抑制相变,对改善NCA 材料的电化学性能具有很大的帮助[20-26]。
QIU 等[20]研 究 了Ti4+掺 杂 对 正 极 材 料LiNi0.8Co0.15Al0.05O2(Ti-CAT)电化学性能的影响。研究表明,Ti4+取代了Ni(3b)在过渡金属层中的作用,使过渡金属的价态维持在+3 价左右,阻碍了Ni2+在锂位的形成与扩散,有效降低锂镍混排,扩展了锂离子输运通道同时抑制了高阻抗岩盐相NiO 的形成,从而稳定了材料结构。掺杂0.01%Ti4+的NCA 在0.1C的放电速率下,初始放电比容量为178.2 mA·h/g,经100 次循环后,容量保持率高达86.9%,由此显著提高了材料的循环性能。
BAI等[21]用固态反应合成了Mg2+掺杂的正极材料LiNi0.85Co0.10Al0.05O2(Mg-NCA)。Mg2+(0.072 nm)取代Ni2+(0.069 nm),致使晶格参数c/a值、晶胞体积及Li 层间距均略有增加,Li+迁移速率被提高,倍率性能得到改善,且抑制H2→H3相变,使材料结构更加稳定,循环性能更好。在0.5C、100 次循环后,掺杂0.005 mol 的Mg2+正极材料保持率为84.9%,未掺杂仅为63.2%。LIU等[22]通过固态法合成了Y3+掺杂的正极材料LiNi0.8Co0.15Al0.05O2(Y-NCA)。研究表明,Y3+(0.090 nm)取代Ni 位,扩展了过渡金属层间距,且形成了键能更强的Y—O(1 816.65 kJ/mol),有效抑制过渡金属离子向锂层的迁移,进一步抑制H2→H3 相变及电极极化,使材料电极可逆性提高,稳定了材料结构。掺杂0.2%Y3+的NCA 在1C 放电速率下、200次循环后,容量保持率高达95.5%,而纯的仅有85.1%,因此适量Y3+掺杂可以提高正极材料的循环稳定性。
还有很多科研工作者探究了其他离子取代过渡金属位,如Zr4+、Fe2+、Fe3+、Gd3+等[23-26]。这些研究结果表明,取代M 位,抑制过渡金属离子向锂层的迁移,增大过渡金属层中(003)晶面间距,加快Li+迁移速率,抑制相变,稳定了材料结构,最终有效提升材料的电化学性能,但部分离子掺杂会损失初始放电比容量。
2.3 O位掺杂
O2-(6b)在富锂层状氧化物材料中起着晶格骨架的作用。当充电电压过高时,O2-提供电子以平衡Li+脱出造成的电荷失衡,同时在层状正极材料表面形成一层氧空位,由于脱出的氧很难再次回到晶格中,从而影响材料的库伦效率及循环、倍率等性能[27]。因此,在O2-位置进行掺杂,对于抑制表面氧空位的形成、稳定晶体结构、改善材料电化学性具有重要意义[28-31]。
HE等[28]将Br-(0.196 nm)掺入LiNi0.815Co0.15Al0.035O2的氧位,形成了键能更强的化学键M(Ni、Co、Al)—Br,降低了镍离子价态、提高了Li+扩散速率、降低电极极化和抑制初级颗粒生长。0.5C、100 次循环后,掺杂0.2% Br-的NCA 容量保持率高达73.7%,而未掺的NCA 库伦效率只有63.7%,尤其在高温55 ℃、100 次循环后,掺杂0.2% Br-的NCA 容量保持率达到75.7%,明显高于未掺杂的41.5%。Br-掺入NCA晶格后,循环性能和倍率性能明显改善。
LI 等[29]合 成 了 掺 杂 F-的 正 极 材 料LiNi0.80Co0.15Al0.05O2。研究表明随着氟掺杂浓度的增加,阳离子的混排程度增加,但F-成功取代晶格中的O2-,形成键能更强的Li—F化学键,降低了表面镍离子的平均价态。在2C、100次循环后,NCA容量保持率仅为85.6%,而掺杂6%F-的NCA容量保持率高达97.1%。氟掺杂抑制了循环过程中的极化且降低阻抗值,有效提高了材料的电化学性能。XIE 等[30]通过溶胶凝胶法合成了S2-掺杂的LiNi0.80Co0.15Al0.05O2(S-NCA)正极材料。研究表明,S2-(0.184 nm)取代O2-(0.132 nm),减少了Ni2+形成、降低了锂镍混排,与此同时,在流动氧及煅烧条件下少许S2-被氧化成SO42-,在材料表面形成一层薄薄的Li2SO4,从而减少了材料表面残余锂盐的形成,使材料结构更加稳定。在1C、1 100次循环后,纯NCA容量保持率仅为33.9%,而S-NCA 容量保持率高达70.4%,由此,S2-掺杂大大提高了NCA的循环性能。
通过取代O位,形成了Li—F、M(Ni、Co、Al)—Br、B—O 等键能更强的化学键[31],键能更高,阻止过渡金属离子向锂层的迁移,提高锂离子迁移速率;所掺离子与O2-化合价不等价,产生的多余电子能提高材料倍率性能。但掺杂量也是影响电化学性能的重要因素,掺杂量过大,易造成更严重的阳离子混排。
2.4 复合共掺杂
除单离子单个位点掺杂外,双离子进行复合位掺杂能同时发挥两种离子掺杂作用,不仅结合了单位点掺杂抑制锂镍混排和降低极化的双重优点,而且弥补了单离子掺杂改性的不足,有力改善了NCA的电化学性能[32-37]。
QIU 等[32]采用高温固相法合成了Zr4+和F-共掺的Li(Ni0.8Co0.15Al0.05)1-xZrxO2-yFy(Zr-F-NCA)。研 究结果表明,F-占据氧位,形成F—O 替代O—O,Zr4+(0.072 nm)占据过渡金属位,形成键能更强的Zr—O替代M(过渡金属)—O,且降低了F-掺杂引入的阳离子混排度。Zr4+和F-共取代,可以降低材料极化和减小阻抗,稳定了材料的晶体结构,提高了材料的循环性能。在1C、200次循环后,NCA容量保持率仅为75.8%,而Zr-F-NCA 保持率高达90.5%,循环性能和倍率性能改善效果十分显著,其循环、倍率性能测试如图6所示。
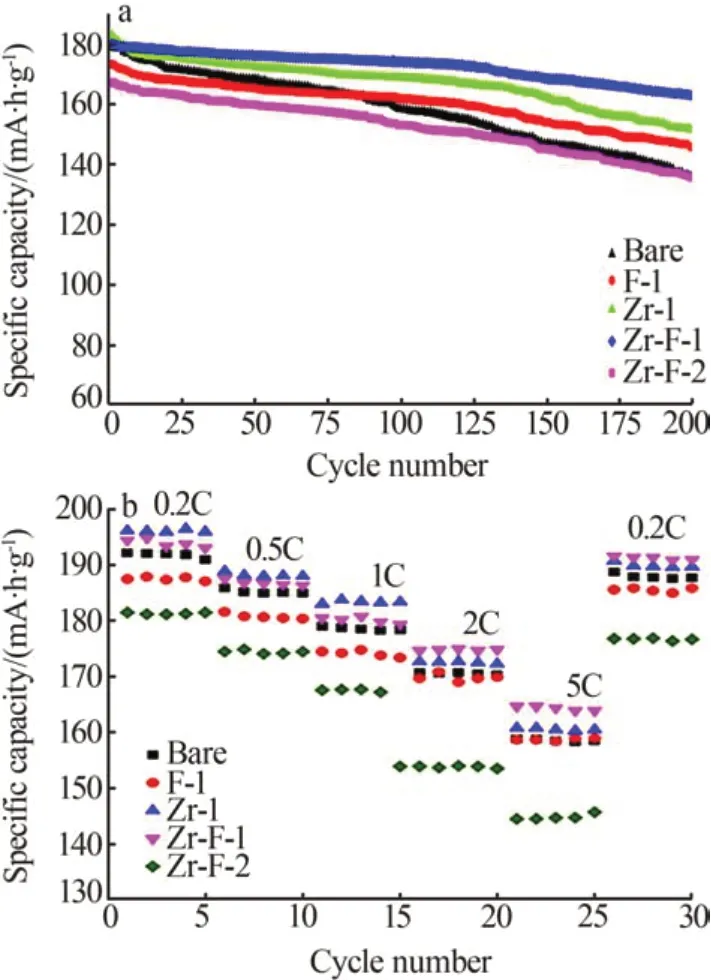
图6 1C放电速率下的循环性能测试图(a);倍率性能测试图(b)[32]Fig.6 Cyclic performance test chart at discharge rate of 1C(a);Rate performance test chart(b)[32]
HE 等[33]采用纳米铣削辅助固态工艺合成了Na+和Nb5+共掺的正极材料LiNi0.85Co0.1Al0.05O2(Na-Nb-NCA)。研究表明,Na+(0.102 nm)取代Li 位,促进了Li+迁移,提高了材料的初始放电比容量,而Nb5+(0.069 nm)取代O 位,Nb—O 键能更高,提高了材料的循环稳定性。Na+和Nb5+共掺抑制了材料的锂镍混排和延迟了有害相变,降低极化并促进电荷转移,使材料稳定性更好。在0.5C放电速率下,Na-Nb-NCA 初始放电比容量为202.3 mA·h/g,100 次循环后,共掺材料的容量保持率为94.3%,纯NCA仅为78.2%。YANG 等[34]采用固相法合成了Na+和Br-共掺的正极材料LiNi0.8Co0.15Al0.05O2(Na-Br-NCA)并研究了其电化学性能。研究表明,Na+和Br-共掺通过取代Li 位和O 位减小了锂镍混排,增大了晶格间距,形成的Li—Br 提高了Li+的可逆脱嵌性,使材料结构更加稳定。在2C、100次循环后Na-Br-NCA 容量保持率是91.5%,倍率性能测试中,在大放电速率5C 时,放电比容量高达160.2 mA·h/g,而未掺杂的NCA容量保持率仅为77.7%和148.6 mA·h/g。
还有研究者进行了B3+和Ga3+[35]、W6+和掺杂,复合共掺弥补了单离子掺杂的缺陷,一方面解决了电化学惰性的单离子掺杂引起的初始放电比容量的损失;另一方面抑制了部分单离子掺杂引入的更严重的阳离子混排。两种离子的协同作用不仅提高了Li+扩散速率,保持了正极材料的初始放电比容量,而且抑制材料阳离子混排、相变及极化,有效提升了材料的循环与倍率性能。
各离子掺杂数据如表1 所示。分析表1 中各项数据可知,从离子半径角度分析,对于不同位置替代,较大粒径离子掺入会增加过渡金属层中(003)晶面间距或Li 层(003)晶面间距,从而提高Li+迁移速率,提高材料的倍率性能;从化合价角度分析,所掺离子与替代离子化合价不等价,价态相差越大引入的离子空位越多,Li+与电子迁移速率加快,有助于倍率性能的改善;从循环性能改善程度角度分析,由于离子共混的协同作用,循环性能较单离子掺杂改善程度更明显,容量保持率更好。由各离子掺杂数据表明,采用复合共掺杂,NCA 正极材料循环性能改善效果更优。
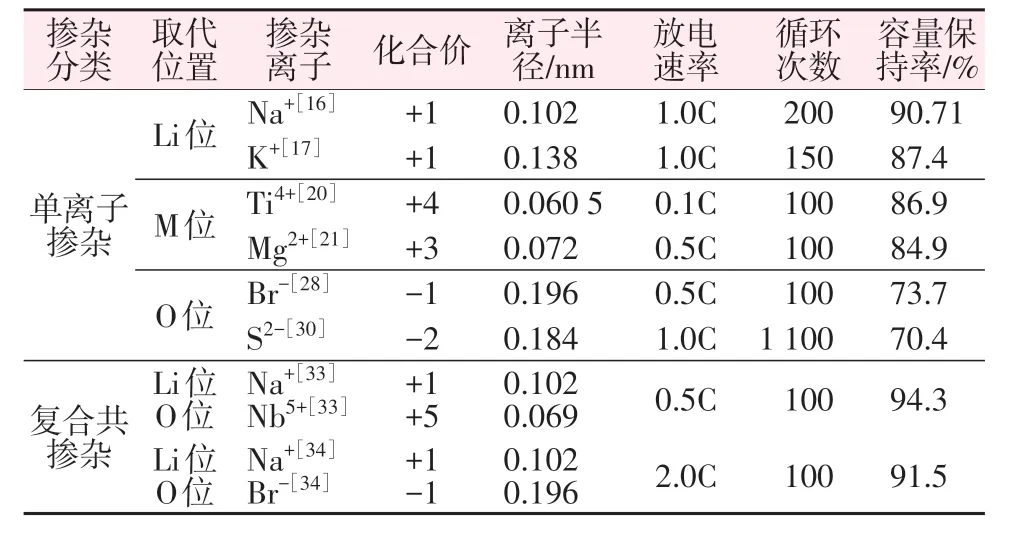
表1 不同离子掺杂性能对比Table 1 Comparison of doping properties of different ions
目前Li 位掺杂离子主要有Na+、K+等;M 位掺杂离子主要有Ti4+、Mg2+、Y3+、Zr4+、Fe2+、Fe3+、Gd3+等;O位掺杂主要有Br-、F-、S2-等。对于以上位置各离子取代在正极材料分布均匀情况,主要通过扫描电镜能量色散谱(EDS)元素映射分析;在材料中所占的化学成分含量主要通过电感耦合等离子谱(ICP)进行分析;对于各个替代位置所采用的表征手段主要是通过X射线衍射分析(XRD)结合里特维尔德(Rietveld)精修结果(晶格参数、原子位点参数等)、ICP、X 射线光电子能谱分析(XPS)进行综合分析。锂位取代,Na+半径大于Li+半径,对应XRD 谱图中(003)和(104)峰向低角度偏移,晶格参数表明c轴扩展,由此可预见取代锂位;扫描透射电子显微图像(ABF-STEM)表明Li 层中原子列强度曲线较高,而原子列强度与元素平均原子数成比例,当Na+占据Li+空位时导致Li层中平均原子数增加,由此证实了原子数相对较高的Na+占据了锂位[38]。过渡金属位取代(Mg2+取代Ni2+),基于ICP 得到的化学成分假设掺杂原子位点占据情况,建立结构模型[Li1-yNiy-zMgz]3a[LiyNi0.6-x-y+zCo0.2Mn0.2Mgx-z]3bO2,再进行XRD 测试将Rietveld 精修结果进行了改进,晶格参数、原子位点参数结果表明结构模型建立正确,Mg2+取代Ni 位[39]。氧位取代(F-取代O2-),经XPS 测试,比较所有氧键与M—O 的比率(RM—O)、所有过渡金属键与M—F的比率(RM—F)、以及所有镍键与阴极样品的Ni—F 的比率(RNi—F),经公式计算,当F 的掺杂浓度增加时,RM—O值降低、RM—F和RNi—F值增加,表明正极材料样品中的氧被氟取代[40]。综上所述,对掺杂位点判断可采用上述方法,但目前对于掺杂离子位点的表征技术研究较少,大多数研究者通过先假定取代位置再结合XRD、XPS、ICP 测试结果综合进行分析验证,因此掺杂位点精确确定需待进一步研究。
3 结论与展望
本文从Li 位、M位、O 位掺杂及复合共掺杂4个方面对NCA 掺杂改性进行了综述。Li 位和M 位掺杂能够减小Li+/Ni2+混排、抑制岩盐NiO相的形成,从而稳定了材料结构,但由于离子本身的电化学惰性,Li 位和M 位取代会造成材料首次放电比容量的损失;O位掺杂能够减小材料极化和降低阻抗,从而有效改善了NCA正极材料的电化学性能,但易造成材料更严重的阳离子混排;复合共掺杂综合了单离子掺杂优点且弥补了单位点掺杂的不足,发挥了两种离子的协同作用,能在抑制相变、微裂纹形成的同时降低阳离子混排,保持材料初始容量,具有更优的改性效果。上述掺杂中除掺杂离子及掺杂位点选择外,掺杂量也是影响材料电性能的重要因素,需要研究者进一步探索。因此,通过离子掺杂并采用复合共掺方式对NCA 正极材料进行改性具有十分广阔的发展前景。

