内镜下高频电切术与圈套器冷切术治疗胃息肉的临床对照研究
林华强 黎卓江
(江门市新会区人民医院消化内科 江门 529100)
胃息肉是由于胃黏膜异常增生而形成的乳头状突起,是消化内科常见疾病。目前,随着人口老龄化及医疗设备技术的不断提高,无痛胃镜检查愈发受到欢迎,胃息肉的发现率也逐年增高,根据病理类型大体上可分为胃底腺息肉、腺瘤性息肉、增生性息肉和炎性息肉,大部分患者在早期或无其他并发症时无明显症状,部分患者因合并胃炎、幽门螺杆菌感染、胆汁反流等,会出现上腹隐痛、腹胀、恶心等症状[1-2]。其中胃息肉恶变率与其病理类型相关,增生性息肉及胃底腺息肉恶变可能性较低,而腺瘤性息肉的恶变率则可高达45%[3]。并且临床普遍认为通过有效方式切除胃息肉可预防胃癌的发生,其中内镜下高频电切术(HFE)、圈套器冷切除术(CSP)均是临床常用的治疗手段。故本研究对比两种术式治疗胃息肉的临床疗效,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年1月-2020年12月在我院接收治疗的160例胃息肉患者为研究对象,按照随机数字表电脑抽取方式分为对照组和观察组各80例。两组一般资料无统计学差异(P>0.05),具有可比性,见表1。

表1 两组一般资料比较
1.2 纳入与排除标准
纳入标准:(1)符合《实用消化内镜治疗技术》[4]中关于胃息肉的诊断标准;(2)均经电子胃镜确诊为胃息肉,且具备手术指征;(3)18岁≤年龄≤70岁,单个息肉直径≤10mm;(4)术前3个月内未有H2受体拮抗剂、质子泵抑制剂、抑酸药、抗生素等用药史;(5)均签署知情同意书。排除标准:(1)恶性息肉,或胃息肉合并糜烂、溃疡,胃癌等恶性肿瘤者;(2)凝血功能障碍,或术前1周内曾服用抗血小板药(阿司匹林等)或抗凝药(华法林等)者;(3)严重的肝肾功能障碍者;(4)手术不耐受者;(5)既往胃部手术史者;(6)哺乳期或妊娠期妇女。
1.3 方法
两组均术前禁食8h,均给予丙泊酚注射液,静脉输注给药,采用日本olympus奥林巴斯图像处理系统(CV-290)主机,配备电子胃镜,将息肉暴露于视野正中,使用1∶10 000肾上腺素生理盐水进行息肉处黏膜下注射,当侧缘清晰可见确定息肉抬举阳性后。对照组行HFE,通过胃镜上的孔道插入一次性使用电圈套器,钢丝圈套入息肉,应用顺套法/迭套法,套住部位以高出周围基底部黏膜2~3mm为宜,待息肉蒂部转变为暗红色,采用德国ERBE爱尔博ICC200电外科高频电刀工作站切除息肉,设置功率为30W,每次持续通电时间为3~5s,直至息肉根部被切断。观察组行CSP,通过胃镜上的孔道插入一次性使用冷圈套器,待冷圈套器套取息肉后,快速收紧圈套器直至机械性勒除。两组取出的息肉通过圈套器取出送检,镜下冲水观察息肉有无残留,若有残留应采取同样的方法进行进一步切除,息肉切除后观察创面30s,创面无活动性出血术毕,若持续渗血则使用金属夹夹闭创面止血。
1.4 观察指标
1.4.1手术指标
包括息肉切除时间(以圈套器伸出钳道到收集完切除息肉所需时间)、治疗费用、术中金属夹使用率和息肉完全切除率。其中术后1个月进行胃镜复查,病灶边缘与切缘相距超过2mm为完全切除,有残留病灶则为残留切除。
1.4.2临床疗效
依据《消化道良性隆起病灶内镜诊断标准及评价》[5]判定,显效:息肉无残留,病灶被新生黏膜上皮肉芽组织覆盖,瘢痕不明显;有效:息肉无残留,部分病灶被新生黏膜上皮肉芽组织覆盖,存在轻微瘢痕;无效:未达到上述标准。
1.4.3术后并发症发生情况
包括术中出血(术中切除息肉后,创面发生无法自行凝固并需内镜干预的出血)、术后穿孔、术后出血(术后1周内发生需内镜干预的延迟性出血)。
1.5 统计学方法
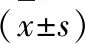
2 结果
2.1 手术指标
观察组的息肉切除时间与治疗费用均较对照组明显更低(P<0.05);两组的术中金属夹使用率与息肉完全切除率比较无统计学差异(P>0.05),见表2-3。
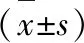
表2 两组切除时间和治疗费用比较
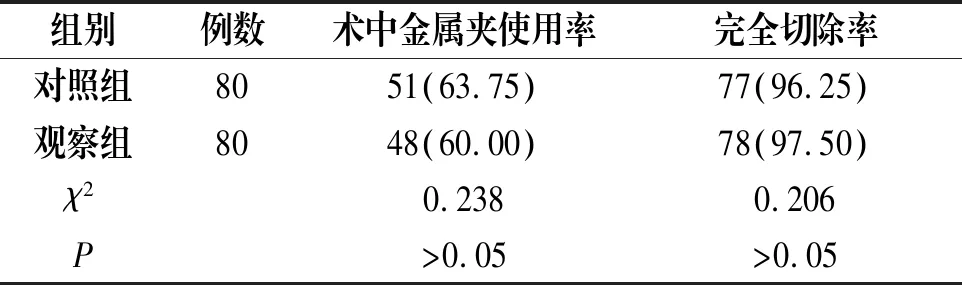
表3 两组术中金属夹使用率、完全切除率比较[n(%)]
2.2 临床疗效
两组总有效率无显著差异(P>0.05),见表4。

表4 两组临床疗效比较[n(%)]
2.3 并发症发生率
两组的并发症总发生率比较均无统计学差异(P>0.05),见表5。

表5 两组并发症发生率比较[n(%)]
3 讨论
胃息肉的发生与多种因素有关,包括胃黏膜的长期慢性炎症刺激、长期服用质子泵抑制剂、遗传因素、不良的生活习惯等[6]。传统开腹切除术的手术创伤大、并发症发生率高、风险较大,目前临床已较少使用。随着内镜技术日益发展成熟,内镜下切除术在消化内科中广泛开展,其中内镜下HFE与CSP均为常用的内镜下息肉切除方法[7]。
本研究结果显示,观察组的息肉切除时间与治疗费用优于对照组,两组均在术后1个月进行胃镜复查,对照组存在残留病灶者3例,观察组存在残留病灶者2例,两种术式的息肉完全切除率和总有效率无显著差异。提示内镜下HFE与CSP均有确切的临床效果,而CSP具有操作便捷性及经济性的优势。
术中出血是息肉切除最常见的并发症,通常使用金属夹将类似于残端蒂的根部夹闭。同时,穿孔是息肉切除的一种罕见并发症,发生率为0.3%~0.5%,若处理不及时易可加重病情,严重影响患者生活质量[8]。有研究显示,CSP术后并发症发生风险高于内镜下HFE,分析原因为:(1)CSP发生出血的原因可能是因为切除速度较慢,造成黏膜下组织大量的损伤和随后不必要的出血;(2)内镜下HFE的原理是通过高频电流使圈套器灼烧组织迅速切断息肉,CSP圈套器则通过机械切割组织,其与内镜下HFE的最大区别是不采用高频电,故可有效避免高频电引发的术后穿孔、术后出血、电损伤等并发症[9]。而本研究中,观察组发生术中出血8例和术后出血2例,对照组则发生术中出血9例和术后出血3例,两组均未出现胃穿孔,两组的术中金属夹使用率和并发症总发生率无统计学差异,说明内镜下HFE与CSP的安全性相当。分析可能是因为手术医师的技术操作水平专业、严谨,有效规避了部分并发症风险。
同时术后护理也尤为重要,患者术后应禁食24h,待麻醉完全清醒及无腹痛后,可进食全流质1d,如仍无腹痛及便血情况,可过渡到半流少渣饮食3d,注意休息,不要进行剧烈运动,避免伤口撕裂、钛夹脱落导致大出血。此外,本研究尚有不足,缺少对两种术式术后远期治疗效果的比较,且研究病例较少,在今后研究中需扩大样本量,并加强对患者术后随访结果的收集。
综上所述,内镜下HFE与CSP治疗胃息肉均有较好的临床效果,且安全性相当,但CSP的息肉切除时间更短、治疗费用更低,适合在基层医院推广应用。