安罗替尼联合肝动脉化疗栓塞术治疗晚期肝癌的疗效及对血清肿瘤相关因子的影响
郭稳稳,程昌盛,吴燕,林学祥,赖辉强
(广西壮族自治区桂东人民医院肝病科,广西 梧州 543000)
肝细胞肝癌(hepatocellular carcinoma,HCC)是世界范围内有着高发病率的恶性肿瘤,70 %~85 %患者确诊时已为中晚期,错失理想的手术机会[1-2]。肝动脉化疗栓塞术(hepatic artery chemoembolization,TACE)是目前首选用于中晚期HCC的局部介入治疗手段,能有效阻断肿瘤组织血供,控制肿瘤恶化,延长患者生存期[3]。但TACE作为姑息性治疗手段,无法造成肿瘤彻底坏死,极易复发[4]。因此,如何提高中晚期HCC的疗效是临床致力于研究的方向。研究[5]表明,肿瘤的增殖与新生血管紧密关联,通过对肿瘤血管新生产生抑制作用,进而阻止肿瘤生长。安罗替尼是一种新型的小分子酪氨酸激酶抑制剂(TKI),能有效抑制血管内皮生长因子(VEGF)、血小板衍生生长因子(PDGF)等多种受体活性,有抑制肿瘤血管新生和抗肿瘤生长的作用。目前,安罗替尼在胃癌、乳腺癌及肺癌等多种恶性肿瘤中,均显示出较好的抗肿瘤活性[6-7],但关于其在晚期HCC治疗中的应用报道尚少。本研究旨在探讨安罗替尼对晚期HCC患者TACE治疗的增效作用及对血清肿瘤标志物和VEGF、PDGF等指标的影响。
1 资料与方法
1.1 一般资料
选取2019年1月至2020年12月广西壮族自治区桂东人民医院治疗的50例晚期HCC患者为研究对象,根据治疗方式不同分为观察组和对照组,每组各25例。本研究经院伦理委员会审核批准,两组患者一般资料比较,差异无统计学意义(P>0.05)。见表1。纳入标准:(1)原发性HCC;(2)巴塞罗那临床肝癌(BCLC)分期属于B、C期;(3)Child-Pugh肝功能分级为A或B级;(4)预计生存期>3个月;(5)美国东部肿瘤协作组(ECOG)评分为0~2分。排除标准:(1)合并重要脏器功能不全;(2)严重凝血功能异常者;(3)接受射频消融术或应用其他抗肿瘤药物等其他治疗者;(4)合并其他类型恶性肿瘤者;(5)有化疗禁忌症者。
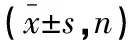
表1 两组患者一般资料比较
1.2 方法
(1)对照组患者行TACE治疗,具体方法如下:行局部浸润麻醉后,行股动脉穿刺插管(采用Seldinger技术),予以选择性肝动脉造影,确定导管位置良好后,予以洛铂40 mg+氟尿嘧啶1.0 g灌注,然后将药物混合乳剂(由表柔比星10 mg加入罂粟乙碘化油15 mL混合并充分乳化而成)注入到肿瘤病灶,最后予以聚乙烯醇微球1 g实施巩固栓塞处理。(2)观察组患者在上述治疗基础上予以盐酸安罗替尼胶囊(正大天晴药业集团)治疗,12 mg/d,于早餐前口服,连续用药14 d后休息7 d。疗程均为21 d。治疗期间进行血压、心电图、肝肾功能、血常规等密切监测,记录不良反应。
1.3 观察指标
(1)临床疗效:TACE术后1个月,参照实体瘤疗效评价标准(RECIST 1.1)[7]进行近期客观疗效评价,分完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD),疾病控制率(DCR)=(CR+PR+SD)例数/总例数×100%;客观缓解率(ORR)=(CR+PR)例数/总例数×100%。(2)肿瘤标志物水平:于治疗前和治疗后(TACE术后1个月),采集患者空腹静脉血5 mL,3 000 rpm离心进行血清分离,测定AFP、糖链抗原199(CA199)和癌胚抗原(CEA)水平。(3)血清VEGF、PDGF和谷氨酰胺转肽酶(GGT)水平: VEGF、PDGF采用酶联免疫吸附法;GGT的测定采用化学发光微粒子法,检测操作严格按试剂盒说明书进行。(4)不良反应参照常见不良事件评价标准(CTCAE4.0)进行评价。
1.4 统计学分析
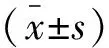
2 结果
2.1 两组患者临床疗效比较
术后1个月,观察组患者DCR高于对照组,差异有统计学意义(P<0.05);两组患者ORR比较,差异无统计学意义(P>0.05)。见表2。
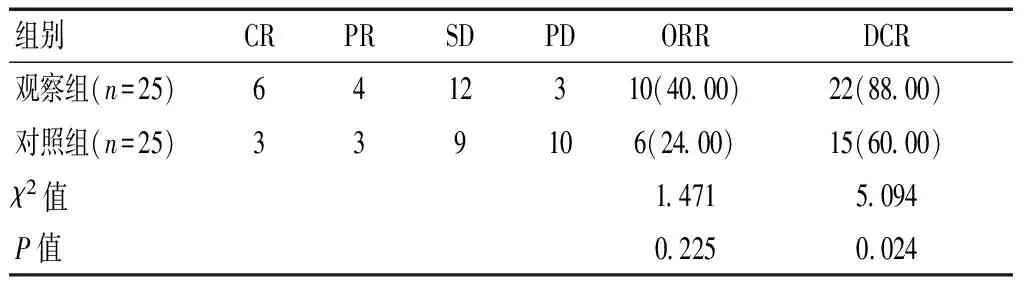
表2 两组患者临床疗效比较[n(%)]
2.2 两组患者血清肿瘤标志物水平比较
治疗前,两组患者血清AFP、CA199、CEA水平比较,差异无统计学意义(P>0.05)。术后1个月,两组患者 AFP、CA199、CEA水平均降低(P<0.05),且观察组低于对照组(P<0.05)。见表3。
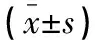
表3 两组患者血清肿瘤标志物比较
2.3 两组患者血清VEGF、PDGF、GGT水平比较
治疗前,两组患者血清VEGF、PDGF、GGT水平比较,差异无统计学意义(P>0.05)。术后1个月,两组患者VEGF、PDGF、GGT水平均降低(P<0.05),且观察组低于对照组(P<0.05)。见表4。
表4 两组患者血清VEGF、PDGF、GGT水平比较
2.4 两组患者不良反应发生情况比较
不良反应主要包括白细胞降低、血小板计数降低、血红蛋白降低、中性粒细胞降低等,以1~2级反应为主。两组患者不良反应情况比较,差异无统计学意义(P>0.05)。见表5。
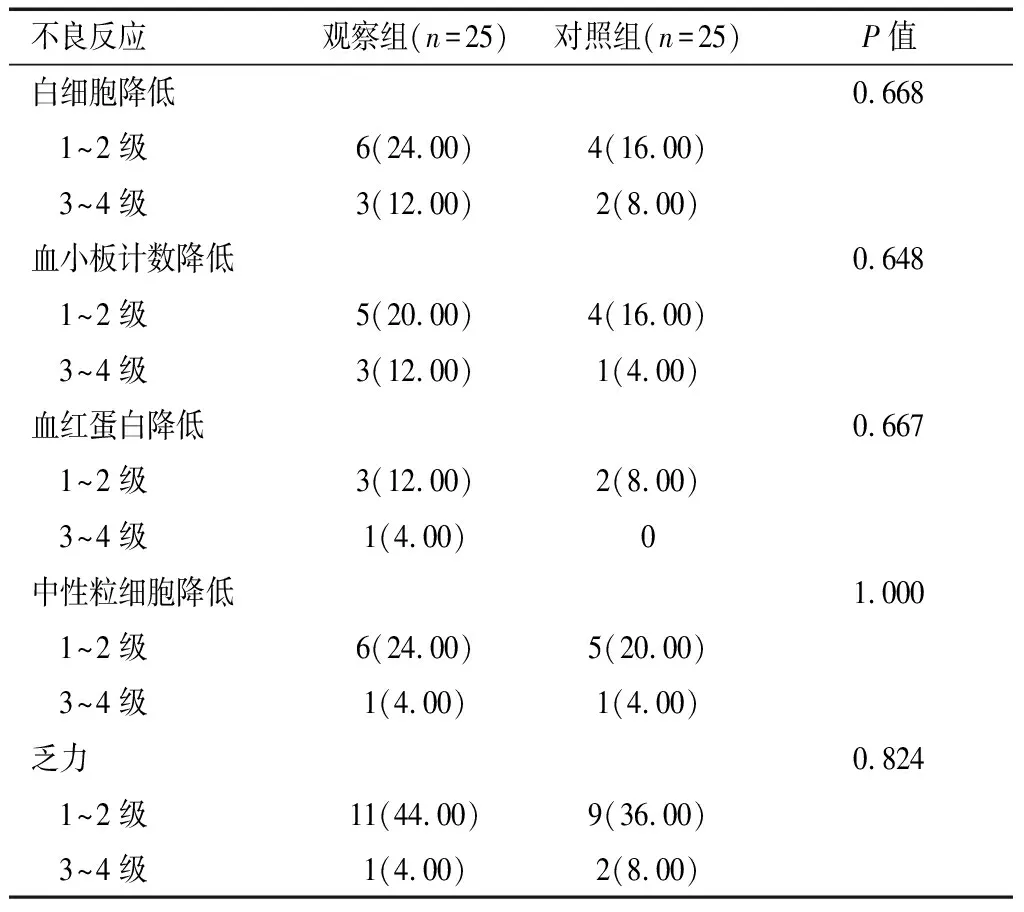
表5 两组患者不良反应发生情况比较[n(%)]
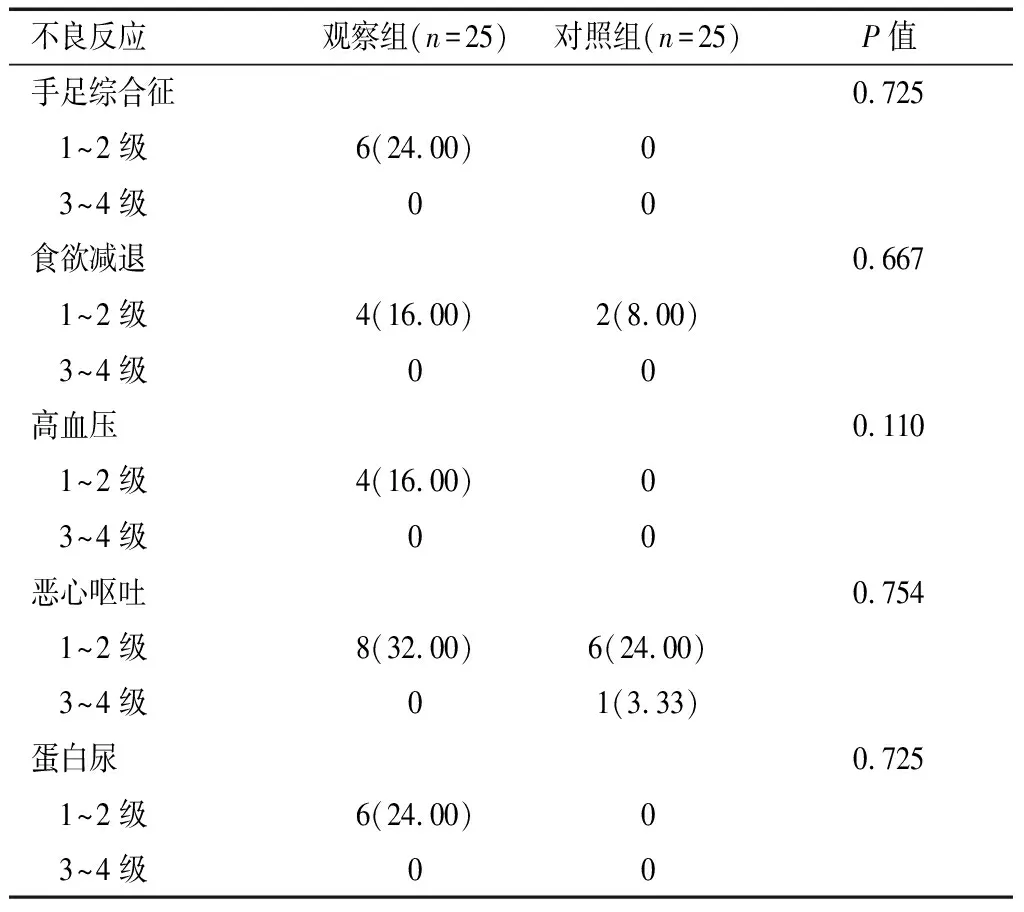
续表5
3 讨论
TACE是目前首选的HCC非手术治疗手段,通过对血管实施机械性栓塞处理并予以化药注入,可有效对肿瘤血供产生破坏作用,使肿瘤细胞发生坏死、缩小,有效杀伤癌细胞[8],但TACE术后易出现复发。有研究[9]发现,TACE术后造成的肿瘤缺血缺氧环境,会引起VEGF表达上调,诱导血管新生,进而致使肿瘤复发、转移。研究[10]表明,抗血管生成药物索拉菲尼联合TACE能够有效抑制肿瘤新生血管生成,从而抑制肿瘤复发。安罗替尼是基于索拉菲尼改造而来,不仅能够对肿瘤生长产生直接抑制作用,还能够对肿瘤新生血管生成发挥阻断作用,为联合治疗提供了依据。
本研究结果显示,观察组患者DCR高于对照组(P<0.05);血清AFP、CA199、CEA低于对照组(P<0.05),表明安罗替尼联合TACE治疗晚期HCC能下调肿瘤标志物表达,提高疗效。安罗替尼作为一种新型小分子TKI,对VEGFR1~3、PDGF等多个靶点有着强效抑制作用,进而发挥影响血管新生、抗肿瘤生长的作用。目前,安罗替尼已获批用于晚期肺癌的三线治疗和软组织肉瘤的二线治疗[11]。关于胃癌、肺癌、食管癌等实体瘤的II/III期临床试验[12-13],已经显示安罗替尼的良好抗肿瘤效应。研究[14]表明,安罗替尼能够有效抑制肝内胆管细胞癌细胞HCCC-9810的增殖、转移,且相比索莱菲尼,其与HCCC-9810有着更高的亲和力。安罗替尼对HCC的生长可能有抑制作用,但其临床疗效仍有待进一步证实。
血管新生是肿瘤增殖、转移的重要途径[15]。在HCC发生发展过程中,VEGF、PDGF等血管生成因子产生增多,促进肿瘤相关血管新生,为肿瘤增殖、分化和转移创造良好的血管微环境。研究[16]显示,在肝癌中,血清VEGF表达上调,且可作为病情发展和预后评估指标。GGT源于肝脏组织,参与着生物转化、核酸代谢等多种生物过程,研究[17]表明,GGT水平增高与HCC患者术后预后不良有关。本研究结果显示,观察组患者血清VEGF、PDGF和GGT水平低于对照组(P<0.05),提示安罗替尼联合TACE治疗HCC能够下调VEGF、PDGF和GGT水平,从而提高抗肿瘤效应。本研究还显示,安罗替尼主要不良反应包括手足综合征(24.00%)、蛋白尿(24.00%)、高血压(16.00%),均属于1~2级不良反应,并且相比对照组未明显增加不良反应,说明安罗替尼安全性较好。本研究存在局限性,首先样本量小,统计分析难免存在偏倚,其结论有待进一步验证;其次,由于该药在本院应用时间尚短,患者随访时间也较短,未能进行远期生存分析,有待继续随访患者生存期以充分评价安罗替尼的抗HCC疗效。
综上,安罗替尼联合TACE治疗晚期HCC,能够降低血清肿瘤相关因子水平,疗效显著,并且不良反应可耐受,安全性较高。

