Nrf2抑制剂ML-385腹腔注射对小鼠乳腺癌骨转移的抑制作用及其与骨桥蛋白的关系
殷玉琨,陈佳阳,刘丽星,江正龙,常金圆,李杰,冯利
国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院
北京协和医学院肿瘤医院中医科,北京 100021
乳腺癌在女性恶性肿瘤中的发病率位居第一,晚期乳腺癌患者多发生远处转移,骨骼是其最常转移的部位,约75%的Ⅳ期乳腺癌患者会发生骨转移[1-2]。乳腺癌患者一旦发生骨转移,会继发疼痛、骨折等[3]。目前乳腺癌骨转移的主要治疗方法是双膦酸盐、放疗等,但效果不够满意,因此临床亟需寻求新的针对乳腺癌骨转移的治疗手段及药物[4]。研究显示,乳腺癌转移灶细胞质及细胞核中的核因子红细胞相关因子2(Nrf2)表达高于原发灶,尤其以脑转移灶表达最高,但其在骨转移病灶中的表达鲜见报道[5]。骨桥蛋白(OPN)高表达与乳腺癌骨转移相关,敲低乳腺癌细胞OPN 表达可产生较强的抗细胞迁徙及抗克隆形成作用[6]。研究显示,Nrf2 与OPN表达呈正相关关系[7-8]。但是,目前关于Nrf2 在乳腺癌骨转移组织中的表达变化及其是否通过OPN 发挥干预骨转移的作用尚未可知。2020年1月—2021年6 月,本研究观察了Nrf2 抑制剂ML-385 对乳腺癌小鼠骨转移及OPN 表达的抑制作用,以期为乳腺癌骨转移的治疗提供新思路。现报告如下。
1 材料与方法
1.1 材料 实验动物:雌性BABL/c 小鼠40 只,5周龄,体质量16~18 g,购自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2019-0008,动物质量合格证编号:1103222011006754,在SPF 环境下饲养。肿瘤细胞株:小鼠亲骨性乳腺癌高转移细胞株4T1.2 购自北京端点医药细胞库,使用含10%胎牛血清及青—链霉素(各50 U/mL)的MEM 培养基进行培养,细胞培养环境为37 ℃、5% CO2。药物:ML385购自美国APExBIO公司。
1.2 动物分组及处理方法 将40只雌性BABL/c小鼠随机分为空白组、假手术组、模型组、治疗组,每组10只。分组处理前两周复苏4T1.2细胞,适应性传代培养两代后,进行细胞扩增培养;两周后将对数生长期的4T1.2细胞用胰酶消化,获取细胞沉淀,用生理盐水将细胞沉淀重悬,1 000 r/min离心5 min,弃去上清;重复清洗操作3遍后,调整细胞密度为3.4×105/mL;取1 mL细胞悬液置于1.5 mL无菌细胞管,冰盒中保存,吸取使用时颠倒混匀。模型组、治疗组采用胫骨种植4T1.2细胞的方法制备乳腺癌骨转移模型[8]。假手术组仅打孔,不注射4T1.2细胞悬液;空白对照组正常饲养。建模后第1天治疗组腹腔注射溶于DMSO的ML385 20 mg/kg,空白组、假手术组、模型组腹腔注射等量生理盐水,1次/天,连续注射28 d。
1.3 成瘤情况及胫骨瘤重观察 将各组小鼠处死,记录模型组和治疗组的成瘤情况,并称取胫骨瘤重。
1.4 胫骨组织骨质改变情况观察 采用Micro-CT检查。取各组双侧胫骨,使用Micro-CT 进行扫描,SkyScan NRecon software 软件重建成三维结构,观察骨质改变情况。采用SkyScan CT-Analyser(CTAn)软件分析骨质相关指标,包括松质骨及皮质骨的骨体积分数(BV/TV)、骨小梁厚度(Tb.Th)、骨小梁数目(Tb.N)及骨小梁间隙(Tb.Sp)。
1.5 胫骨组织病理观察 采用HE 染色。取各组小鼠的部分胫骨组织,经固定、脱钙处理后,石蜡包埋、切片。脱蜡至水,将切片加入苏木素染液染色3~5 min,自来水洗,分化液分化,自来水冲洗,返蓝液返蓝,流水冲洗。切片依次加入85%、95%的梯度乙醇脱水各5 min,加入伊红染液中染色5 min。脱水封片,显微镜下观察胫骨组织病理改变。
1.6 胫骨组织Nrf2、OPN 表达检测 采用免疫组化法。将各组小鼠的胫骨组织石蜡切片置于30%乙醇中,抗原修复后,3%过氧化氢封闭液封闭15 min,PBS 清洗,滴加一抗,4 ℃孵育过夜。次日切片复温20~30 min,PBS 清洗,滴加二抗;置于湿盒内,室温孵育20 min,PBS 清洗,DAB 染色后再清洗;苏木素轻度复染30~50 s,去离子水洗3 次,盐酸乙醇中浸泡后自来水冲洗30 min。乙醇脱水,中性树脂胶封片。Nrf2 表达于细胞质、细胞核,OPN表达于细胞膜、细胞质及细胞外基质,棕色颗粒为表达阳性。使用组织切片数字扫描仪及成像系统采集免疫组化切片上的扫描图像,利用图像分析系统自动读取组织测量区域,分析测量区域内阳性细胞数、总细胞数,计算阳性率。阳性率=阳性细胞数/总细胞数×100%。
1.7 统计学方法 采用SPSS17.0 统计软件。计量资料采用S-W 正态性检验,呈正态分布以±s表示,多组间比较采用单因素方差分析,两组间比较采用t检验,重复测量数据采用重复测量的方差分析;非正态分布以M(P25,P75)表示,组间比较采用秩和检验。P<0.05为差异有统计学意义。
2 结果
空白组、假手术组无小鼠死亡,模型组及治疗组均有1只小鼠死亡。
2.1 模型组与治疗组小鼠胫骨成瘤情况及瘤重比较 模型组及治疗组小鼠胫骨成瘤率均为100%,胫骨瘤重分别为(0.921 0 ± 0.358 2)、(0.575 1 ±0.2283)g,两组比较P<0.05。
2.2 各组小鼠胫骨组织骨质变化比较 Micro-CT三维重建结果显示,空白组及假手术组骨质无明显改变,模型组存在明显骨质破坏,治疗组骨质破坏程度较模型组减轻,见OSID 码图1。各组小鼠胫骨组织骨质相关指标比较见表1。
表1 各组小鼠胫骨组织BV/TV、Tb.Th、Tb.N及Tb.Sp比较(±s)
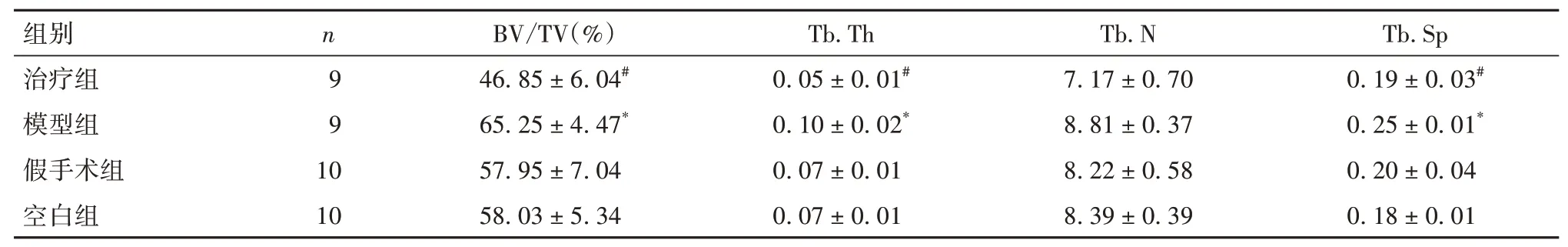
表1 各组小鼠胫骨组织BV/TV、Tb.Th、Tb.N及Tb.Sp比较(±s)
注:与假手术组和空白组比较,*P<0.05;与模型组比较,#P<0.05。
?
2.3 各组小鼠胫骨组织病理学变化比较 空白组与假手术组小鼠胫骨组织未见明显异常。模型组小鼠胫骨骨髓腔内可见大量核大、深染、核仁明显的细胞,细胞质空,附近可见坏死区,伴出血,骨皮质见编织骨大量形成;治疗组小鼠上述胫骨组织病理学改变较模型组减轻。见OSID码图2。
2.4 各组小鼠胫骨组织Nrf2 及OPN 阳性率比较 见表2、OSID码图3。
表2 各组小鼠胫骨组织Nrf2及OPN阳性率比较(%,±s)
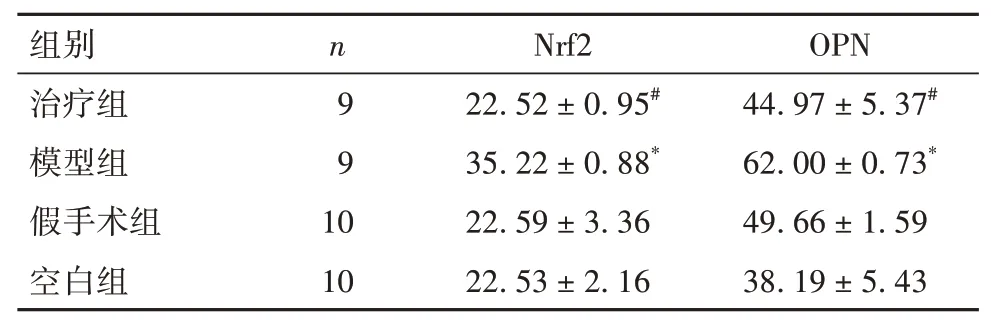
表2 各组小鼠胫骨组织Nrf2及OPN阳性率比较(%,±s)
注:与假手术组和空白组比较,*P<0.05;与模型组比较,#P<0.05。
?
3 讨论
肿瘤细胞多数处于氧化应激状态,内源性Nrf2/ARE 信号通路与肿瘤的发生密切相关[9]。研究显示,肿瘤的活性氧(ROS)水平明显高于正常细胞,其机制可能与遗传分子生物学改变、肿瘤细胞较高的代谢率、炎症因子的参与及抗肿瘤药物的使用有关,这些ROS 可通过脂质过氧化、DNA 损伤和蛋白质破坏而参与肿瘤的形成[10]。过量的ROS 可导致肿瘤细胞氧化应激水平升高。Nrf2/ARE 是机体内重要的抗氧化信号通路,当其被激活时可调控下游抗氧化蛋白表达,从而保持机体免受ROS 的侵害[9]。多项研究显示,乳腺癌、肺癌等肿瘤组织Nrf2 表达明显升高,并提示患者预后不良[9,11]。研究证实,与Nrf2 竞争性拮抗Keap1 可导致细胞核内Nrf2 表达升高,从而抑制肿瘤细胞凋亡,促进肿瘤生长及转移[12]。有研究显示,蛹虫草菌素可通过调控Nrf2 的表达,而发挥放疗增敏的效果[13]。以上研究提示,Nrf2参与介导的氧化应激反应可能是治疗肿瘤转移的新切入点。
OPN 在乳腺癌骨转移组织中高表达,而高表达的OPN 不仅可以促进骨吸收,还能够促进癌症发展和肿瘤骨转移[14]。OPN 高表达的晚期乳腺癌患者预后更差,与健康志愿者相比,骨转移的乳腺癌患者血浆OPN 水平明显升高,并且与患者生存时间缩短相关[15]。研究显示,OPN 高表达的乳腺癌患者生存时间较OPN 低表达患者短约21 个月[16]。有研究采用qRT-PCR 法检测显示,三种易发生骨转移的乳腺癌 细 胞系MDA-231-BoM-1833 细胞、4T1.2 细 胞和Py8119 细胞中的OPN mRNA 表达显著高于其亲本细胞系中的mRNA 表达[17]。还有研究表明,部分敲除OPN 可通过囊泡形成引起全基因组表达变化,虽然抗细胞增殖作用不是很明显,但具有明显的抗细胞迁移和抗细胞克隆作用,并可以部分或完全缓解软组织和溶骨性病变,从而抑制乳腺癌骨转移的发生[18]。因 此,OPN 在 乳腺癌骨转移中 具有关键作用。
本研究结果显示,模型组及治疗组小鼠胫骨种植亲骨乳腺癌细胞后均形成骨转移瘤,但治疗组瘤重较小,且HE 染色显示骨组织破坏程度较模型组相对减轻,提示抑制Nrf2 表达可有效抑制乳腺癌骨转移。BV/TV 反映骨组织容量,Tb.Th 反映骨小梁厚度,Tb. N 反映骨小梁数目,Tb. Sp 反映骨小梁间隙。本研究结果显示,模型组BV/TV 较假手术组升高,为肿瘤体积增大所致,而治疗组较模型组降低,考虑肿瘤内部骨组织成分相对较少;各组Tb.N比较无统计学差异,说明肿瘤对骨小梁数目影响不大;模型组Tb.Sp、Tb.Th 较假手术组升高,考虑与瘤体膨出导致整体体积增大有关,而治疗组Tb. Sp 及Tb.Th 均较模型组降低,考虑为瘤体较小的结果。由此可见,Nrf2抑制剂ML-385可降低乳腺癌骨转移小鼠的骨质破坏。本研究免疫组化结果显示,模型组小鼠胫骨组织Nrf2 及OPN 阳性率较假手术组和空白组升高,而治疗组均较模型组降低,提示ML-385 可能是通过抑制OPN 表达而抑制乳腺癌小鼠骨转移的。
综上所述,Nrf2抑制剂ML-385可抑制乳腺癌小鼠的骨转移,下调OPN 表达是其可能的作用机制。本研究从氧化应激角度提出了治疗乳腺癌骨转移的新方向,未来需进一步从人群、体内、体外多角度深入研究其可能的机制。

