热解温度对染色污泥特性的影响
张鸣艳,李 正
(1.苏州市职业大学,江苏苏州 215104;2.苏州大学,江苏苏州 215123)
染色污泥是指染色后产生的废水经过处理后沉淀分离出的污浊物质。在环保标准日益提高的现代社会,污泥处理已经逐渐成为一个重要的课题和研究领域。对污泥进行资源化处理迫切要求研究人员对此展开进一步研究。无害化、资源化的污泥处理成为近几年来国内外科技研究的热点。污泥热处理技术具有污染少、减容减量程度大并可以同时以热源或者气源形式部分回收污泥中能量的特点,因而被认为是对污泥处理最有效的途径之一。因此,加大对污泥热处理的理论和实验研究,特别是工业污泥的热解、燃烧及其动力学特性研究,为污泥的燃烧技术开发奠定相关的理论基础,具有重要的工程应用价值以及学术意义。
1 实验
1.1 材料
染色污泥(TDS)(浙江省某印染工厂)[1]。
1.2 染色污泥预处理
将湿TDS 样品在干燥箱中105 ℃干燥24 h 去除水分,碾碎,筛分至细粒度(粒径为0.043~0.150 mm),并保存在干燥器中。
1.3 TDS 的热解
在自制的热解和炭化装置(包括一个高压气体源、一个带电加热炉的水平石英管、一个用于气体吸收的丙酮阱)中进行:将20.0 g 烘干的TDS 插入石英管,热解前用纯度为99.99%的氩气置换氧气60 min(整个热解过程中保持氩气流速100 mL/min);热解过程中,温度以10 ℃/min 从室温升高到目标温度后保持60 min。合成的生物炭标记为BC-X,其中BC 表示由TDS 产生的生物炭,X表示热解温度。所有热解实验均重复3 次,将每次实验获得的样品均匀混合后保存在干燥器中备用。
1.4 生物炭表征
根据原料质量计算生物炭产率。
参考GB/T 12496.3—1999《木质活性炭试验方法灰分含量的测定》测定TDS及其生物炭的灰分含量。
采用Denver UB-7 pH 测量仪测量pH,质量体积比为1∶20[2]。
采用元素分析仪分析表面元素组成。
采用微观ASAP2020 全自动比表面和孔径分析仪测量样品的BET 表面积(在77 K 下绘制N2吸附-解吸等温线)。
将干燥的样品与溴化钾以1∶100 混合后压成微球,采用傅里叶变换红外光谱仪分析样品的表面官能团[3],光谱范围400~4 000 cm-1,分辨率4 cm-1。
1.5 重金属分析
采用3 步BCR 顺序提取法提取TDS 及其生物炭中的重金属[4]。将0.50 g 干燥的样品加入50 mL 聚丙烯离心管中,按照以下步骤进行提取:F1(交换性/酸溶性部分),用20 mL 0.1 mol/L 乙酸于25 ℃提取16 h;F2(还原部分),用20 mL、pH 为2 的0.1 mol/L 羟胺于25 ℃提取16 h;F3(可氧化部分),首先用5 mL 30%过氧化氢于25 ℃提取1 h,然后用5 mL 30%过氧化氢于85 ℃干燥1 h(在水浴中干燥),最后用25 mL 1 mol/L 醋酸铵于25 ℃干燥1 h。对于F1~F3,提取的液体用浓酸(双氧水与硝酸体积比为1∶1)在100 ℃热板上消化去除溶解的有机物,然后用2%硝酸稀释至恒定体积(50 mL)后进行分析。未处理的样品和提取的固体残留物用浓酸混合物[V(HNO3)∶V(HClO4)∶V(HF)=5∶5∶2]进行微波酶切。根据以往研究,本实验提出以生物炭中重金属的残余率作为确定热解过程中重金属富集程度的参数[5],按照下式进行计算:
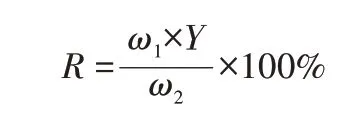
式中:R表示生物炭中重金属的残余率,%;ω1表示生物炭中重金属的质量分数,mg/kg;ω2表示染色污泥中重金属的质量分数,mg/kg;Y表示生物炭产率,%。
重金属在TDS 及其生物炭中的可浸出性与其可用性和毒性直接相关,并且可以通过USEPA 推荐的毒性特征浸出程序(TCLP)进行评估[6]。浸出实验在聚乙烯离心管中进行,在摇动培养箱中以200 r/min振荡18 h进行提取,离心分离,上清液先用H2O2/HNO3消化,再用0.22 μm 膜过滤,最后进行重金属分析。
利用哈坎森提出的基于重金属总质量分数、数量、毒性和敏感性的潜在生态风险指数(RI)对TDS及其生物炭中重金属污染的潜在风险程度进行评价:

式中:Cf为单个重金属的污染系数;Cm和Cn分别为重金属的潜在流动分数和稳定分数;Er为单个重金属的潜在生态危险因素;Tr为单个重金属的毒性因素,Zn、Cu、Cr、Ni、Cd、Mn 的值分别为1、5、2、6、30、1;RI为整体污染的潜在生态风险指数。
2 结果与讨论
2.1 TDS及其生物炭的特性
由表1 可以看出,随着热解温度从300 ℃升高到700 ℃,由于热解过程中TDS 中的有机物分解,TDS生物炭产率从80.85%显著下降到60.96%[7]。其他研究人员也报告了类似的结果,表明在热解过程中,污泥中的大部分无机成分在生物炭中富集[8]。TDS 的pH 接近于中性,在热解过程中,TDS 中的碱、盐释放出来,在较高的热解温度下,随着含氧官能团的分解而减少,随着热解温度的升高,生物炭的pH 逐渐从中性增加到碱性。在高热解温度下,TDS 产生的生物炭碱性性质表明,TDS 衍生的生物炭作为对酸性污染土壤的修正剂,将产生额外的有益作用。

表1 TDS 及其生物炭的特征
TDS 的热解降低了合成生物炭中C、H、N、O 的质量分数,在较高温度下热解后,生物炭中的C、H、N、O质量分数降低。造成这一结果的主要原因是在热解过程中,TDS 中的挥发性物质持续分解[9]。BC-700 中剩余C、H、N 和O 的质量分数分别仅为12.28%、0.42%、0.12%和1.92%。可以看出,由于去甲基化和脱羧反应,H/C 和O/C 物质的量比随着热解温度升高而降低,意味着TDS 衍生生物炭炭化能力更强、芳香缩合更高[10],这种芳香度较高的生物炭可以在土壤中抵抗分解多年。生物炭的比表面积主要与热解温度密切相关[11];TDS 及其生物炭的比表面积分别为6.44、23.83、21.99、27.13、31.44 和65.56 m2/g,表明随着热解温度的升高,炭化程度加重,生物炭的比表面积显著增大。
2.2 FTIR 光谱
TDS 及其生物炭的FTIR 光谱见图1。
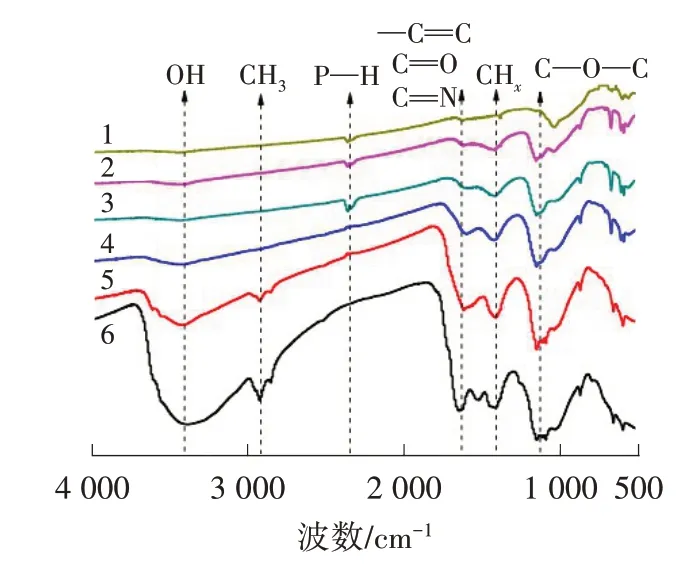
图1 TDS 及其生物炭的FTIR 光谱
由图1 可看出,在3 405~3 443 cm-1处的峰对应与水、醇和羧酸相关的—OH 伸缩振动。随着热解温度的升高,生物炭的—OH 吸收峰强度逐渐降低,说明在热解过程中,TDS 中的大量羟基被分解。在约2 923 cm-1处的峰对应C—H 的不对称和对称伸缩振动,显示TDS 中脂肪族结构的存在。这一结果表明,在TDS热解过程中,当温度达到400 ℃时,几乎所有的脂肪族C—H 都被分解为二氧化碳、甲烷等气体或者转化为芳香族结构[12]。BC-500、BC-600和BC-700中,2 360 cm-1处的吸收峰可能是P—H 磷酸盐。在1 601~1 647 cm-1处的吸收峰对应芳香环(CC 伸缩振动)和酰胺键(CO 和—CONH—伸缩振动),由TDS 中蛋白质的酸、醛和酯引起;随着热解温度的升高,峰强度略有降低,说明生物炭具有很高的芳香性。与脂肪链相对应的1 417~1 420 cm-1处的峰,包括甲基和烯基,并没有随着热解温度的升高而消失,原因是C—H 非常强。在1 152~1 154 cm-1处的强吸收峰对应C—O—C脂肪族醚的伸缩振动,随着热解温度的升高,吸收峰有轻微的变化,原因是不同形式的污泥转化为碳链与单键形式的碳氧。约873 cm-1处的吸收峰对应芳香族环和杂环芳香族化合物。芳香环可以提供π 电子,并且具有强键合重金属阳离子的潜力。600 cm-1以下的吸收峰对应样品中的卤素的伸缩振动。
2.3 TDS及其生物炭中的重金属
2.3.1 质量分数
生物炭中的重金属分布如图2所示。

图2 生物炭中的重金属分布
由图2 可以看出,生物炭中的Zn、Cu、Cr、Ni、Mn残余率分别超过了91.19%、97.49%、91.81%、94.82%和93.96%,说明热解后大部分重金属(Cd 除外)主要积累在生物炭中。随着热解温度从300 ℃升高到700 ℃,生物炭中的Zn、Cu、Cr、Ni、Mn 质量分数增加,这是由于热解过程中重金属的损失低于有机化合物的损失。对于Cd,当热解温度达到600 ℃时,分布在生物炭中的部分开始减少,特别是BC-700 中的Cd 只有12.92%。
由表2 可以看出,重金属质量分数高低顺序为Zn、Mn、Cu、Cr、Ni、Cd。在TDS 的重金属中,锌质量分数最高(8 930 mg/kg),这可能与中国污水处理厂使用的镀锌管有关。在300~700 ℃热解过程中,重金属主要分布在生物炭(固体渣)和生物油(液相)中。
从表2 还可以看出,随着热解温度从300 ℃升高到500 ℃,生物炭中的Cd 质量分数逐渐增加,当热解温度持续升高至600 ℃时,Cd质量分数突然下降。这是因为Cd 主要以碳酸盐的形式存在于原污泥中,当热解温度升高到600 ℃时,很容易通过脱气挥发和转移。
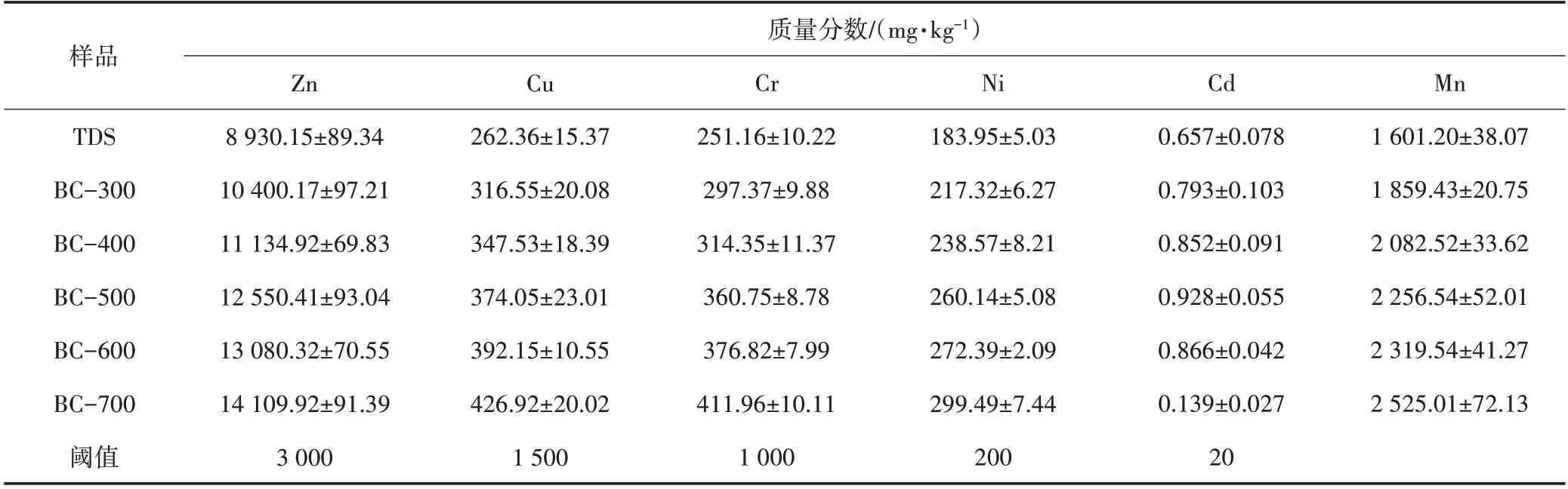
表2 中国处置标准样品中重金属质量分数及其阈值
2.3.2 物种形成
图3 显示了TDS 及其生物炭中4 种BCR 组分中重金属的质量分数。
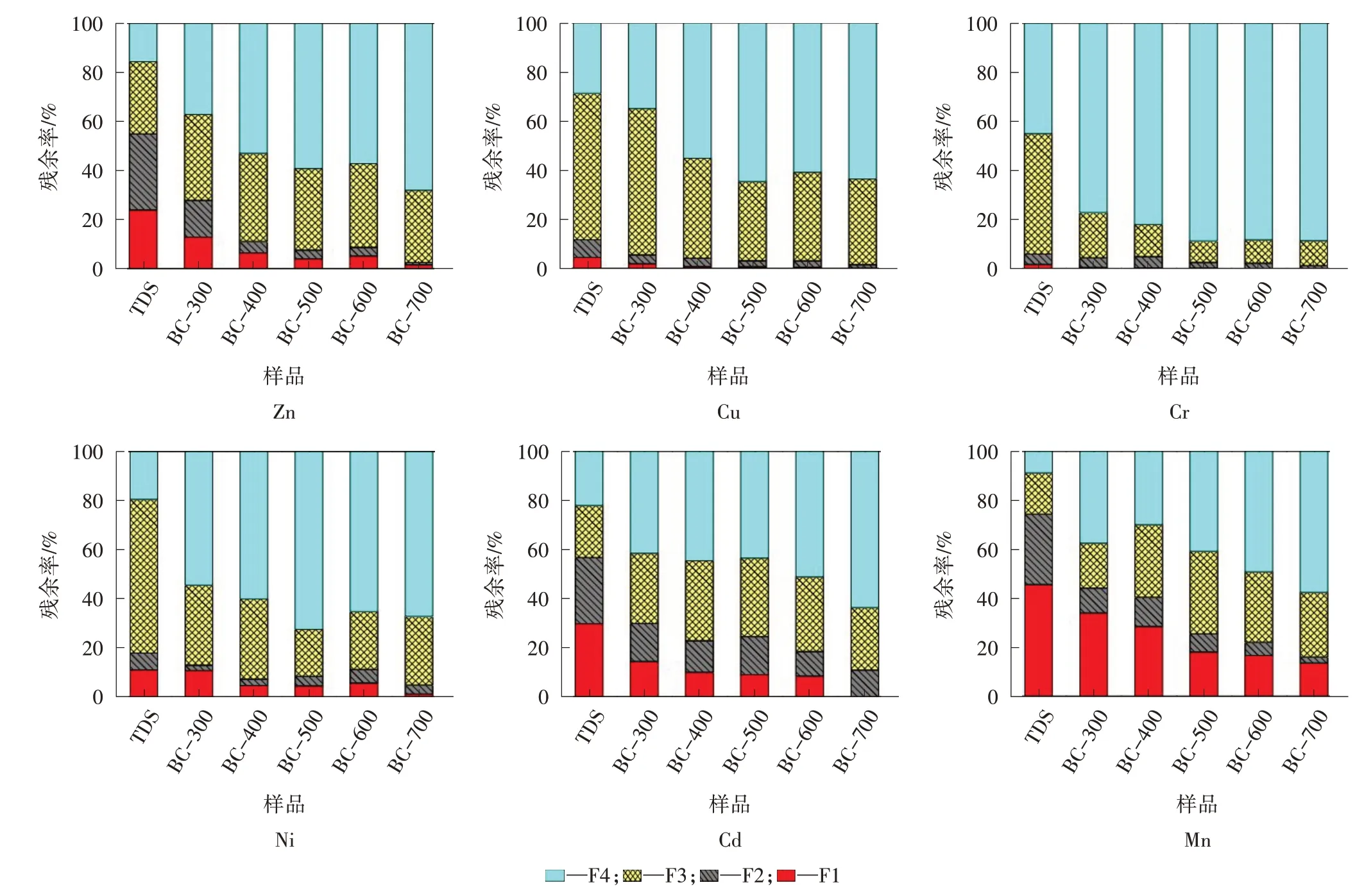
图3 TDS 及其生物炭中6 类重金属的质量分数
由图3 可以看出,TDS 中,高环境风险的Zn、Cd、Mn F1+F2+F3 分别为84.27%、77.88%和91.88%;经过热解实验后,生物炭中的Zn 质量分数显著下降,Cd 和Mn 的F1 和F2 被转换,剩余残渣(F4)逐步增加。热解可以将大部分不稳定组分(F1+F2)转化为更稳定的F4 组分,将重金属Zn、Cd 和Mn 固定在TDS中。具体而言,TDS 中的Cu、Cr 和Ni 主要以F3(分别为59.54%、45.03%和63.73%)和F4(分别为28.70%、54.97%和17.91%)的形式存在于生物炭中。随着热解温度的升高,热解促进了可氧化物(F3)转化为残渣(F4),F1、F2质量分数略低。
2.3.3 浸出特性
TDS 中重金属Cu、Zn、Cr、Ni、Mn、Cd 的浸出量分别为1 559.510、10.360、4.770、21.880、0.186 和715.920 mg/kg。TDS 及其生物炭中重金属的浸出速率如图4所示。除TDS 中的Cr 和Cu 外,渗滤液中所含重金属的质量分数均超过了USEPA 的阈值。因此,TDS 中的这些重金属具有很高的潜在环境风险,可以根据USEPA 被确定为危险废物。虽然锌的浸出量仍超过了阈值,但是生物炭中的锌质量分数明显下降。
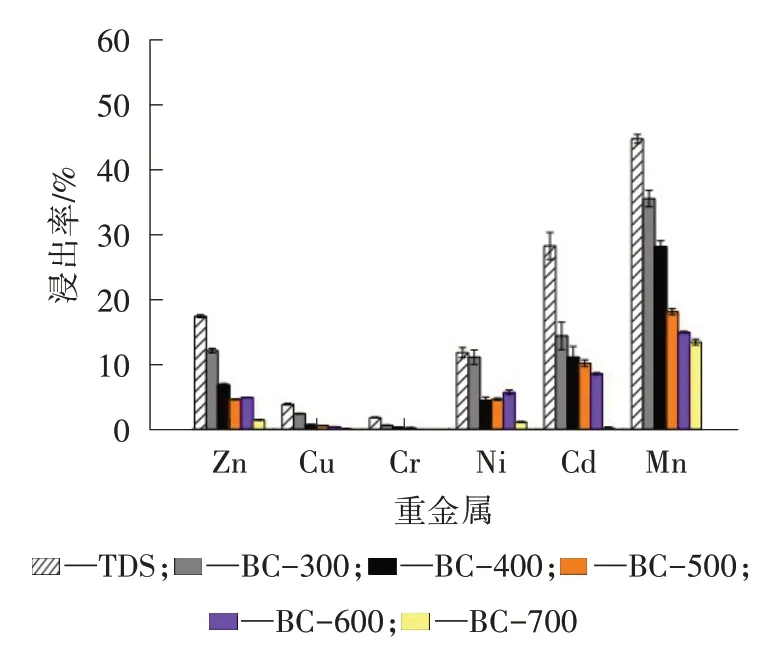
图4 TDS 及其生物炭中重金属的浸出率
3 结论
(1)TDS 在不同温度(300~700 ℃)下的热解有利于改善比表面积,有利于TDS 结构芳香化,促进大部分重金属在生物炭基质中的固定。此外,积累的重金属从生物可利用性组分迁移到更稳定的组分,显著降低生物炭中重金属的生物可利用性和浸出潜力。
(2)热解温度对化学官能团的类别和强度有显著影响,说明热解技术对TDS 中的重金属固定化有积极影响,热解温度是生物炭中重金属固定化的重要影响因素。
(3)随着热解温度的升高,生物炭中6 种重金属的浸出速率显著降低,表明热解过程后浸出重金属的毒性降低。
(4)热解显著抑制了重金属在生物炭中的浸出潜力,经过热解过程后,从生物炭中浸出的重金属质量分数显著下降。
(5)环境风险评价表明,较高的热解温度促进了生态毒性从TDS 的较大风险向生物炭的低风险转变,从而降低了TDS生物炭的环境风险。

