LiMn2O4/ZnO材料的电化学性能研究
李哲宇,李广宇
(沈阳理工大学 环境与化学工程学院,辽宁 沈阳 100159)
随着工业发展,传统的电池譬如镍镉电池与铅酸电池逐渐不能满足人类的需求,而可充电的锂离子电池逐渐步入人类的视线,也使得二次电池飞速发展[1]。
虽然锂离子电池已经步入人们的视野并受到广泛关注,但是它的发展还是存在许多问题,比如成本很高、安全性差、需要保护电路控制,会影响并制约着锂离子电池的产业化发展[2-3]。所以正极材料的研究是很重要的环节,目前常见的正极材料如LiCoO2、LiFePO4等,但是因为钴的资源很有限并且成本比较高,且对环境还有较大污染,而LiFePO4的导电性能比较差,无法满足高电压的需求。相对来说,尖晶石型的LiMnO4价格较便宜,且对环境并无很大污染,所以成为目前研究焦点[4-6]。
尖晶石型的LiMn2O4是三维隧道结构可以为锂离子的嵌入和脱出提供路径并与碳负极互补形成体积效应[7]。而由于其形貌致使Mn2O4的骨架形成一个四面体与八面体共面的三维结构,对锂离子扩散很有利。但是Mn的溶解会对锰酸锂的性能形成非常大的影响,首先是电池在充放电的高电压条件下正极材料的Mn会溶解,导致LiMn2O4中的阳离子混排度增大致使其尖晶石的结构发生了紊乱,并且活性物质会产生不可逆损失[8]。
然后电池在充放电过程中会产生Jahn-Teller效应,使原来的LiMn2O4立方晶系变成四方晶系,导致一部分锰离子替代了锂离子,也会造成尖晶石中阳离子的混排度增大,并且造成锂离子嵌入-脱出的不可逆损失、尖晶石不稳定且会出现缝隙,使电解液接触到的Mn3+变多加速其溶解[9]。
目前,锂离子电池的应用范围越来越广阔,从手机、相机乃至笔记本电脑、汽车以及航空航天等设备[10-11],但由于LiMn2O4本身循环稳定性能太差,同时Jahn-Teller效应,会导致材料发生不可逆的晶格变化从而形成结构坍塌现象,而包覆改性则能够有效改善锰酸锂的性能、抑制Jahn-Teller效应。我们可以通过利用ZnO的包覆改性可以有效改善其性能[12]。
通常采用湿化学法来对 LiMn2O4进行表面包覆,包括溶胶-凝胶法[13]、溶液沉淀法[14]等。但研究过程中发现这些方法很难在材料表面获得均匀的包覆层。因为包覆物前驱体与活性材料在溶液中搅拌混匀、随后干燥烧结的整个过程中,前驱体材料都是随机地粘附到活性材料表面,分布极不均匀。为了解决这一问题,本文通过沉淀法制备LiMn2O4材料,在沉淀的过程中加入添加剂聚乙烯吡咯烷酮K30(PVP)以达到获取均一前驱体的目的。采用最常见的研磨法对前驱体进行表面包覆改性,通过包覆等量的不同氧化物的方法来研究氧化物包覆对LiMn2O4循环性能的影响,以制备循环性能更为优异的LiMn2O4正极材料。
1 实验工艺
1.1 试剂
乙酸锰,草酸,PVP,氢氧化锂,氧化锌,无水乙醇,PVDF,乙炔黑。
1.2 实验仪器
电子分析天平(奥豪斯国际贸易(上海)有限公司),真空干燥箱(北京中兴伟业仪器有限公司),磁力加热搅拌器(常州荣华仪器制造有限公司),鼓风干燥箱(绍兴市苏珀仪器有限公司),马弗炉(合肥科晶材料技术有限公司),手套箱(德国Mbraun有限公司),液压封口机(深圳市精科机电设备有限公司),冲片机(深圳市铭锐祥自动化设备有限公司),压片机(深圳市铭锐祥自动化设备有限公司),X-射线衍射仪(日本岛津公司),扫描电子显微镜(捷克Tescan公司),充放电测试仪(深圳市新威尔电子有限公司),电化学工作站(上海辰华仪器有限公司)。
1.3 实验方法
称取4.9 g C4H6MnO4·4H2O溶于100 mL蒸馏水中,向其加入0.1 g PVP。称取2.5 g C2H2O4·2H2O溶于50 mL蒸馏水中,放入滴瓶中以每秒钟2滴的速度加入到配制好的乙酸锰溶液中,磁力搅拌2 h。后经沉化6 h、抽滤、洗涤、干燥得到粉体。向粉体中加入0.4 g LiOH·H2O研磨后,以5℃·min-1升温到500 ℃,保温5 h,得到前驱体分成2份。称取0.1 g的C4H6O4Zn·2H2O加入到一份前驱体中研磨,再以5 ℃·min-1升温到700 ℃,保温12 h,得到 LiMn2O4(记为LMO)、LiMn2O4/ZnO (记为LMO/Z)材料。最后,经涂覆、冲片、干燥后放入手套箱中组装电池,放置24 h取出,进行电化学测试。
2 实验结果与讨论
2.1 组成成分分析
图1为未改性的LMO材料和与氧化锌包覆后的LMO材料的XRD衍射图谱。对比两条曲线可知,LMO/Zn在2θ=30~35°时发现ZnO的衍射峰。除此之外,无任何杂峰,证实了样品的高纯度。
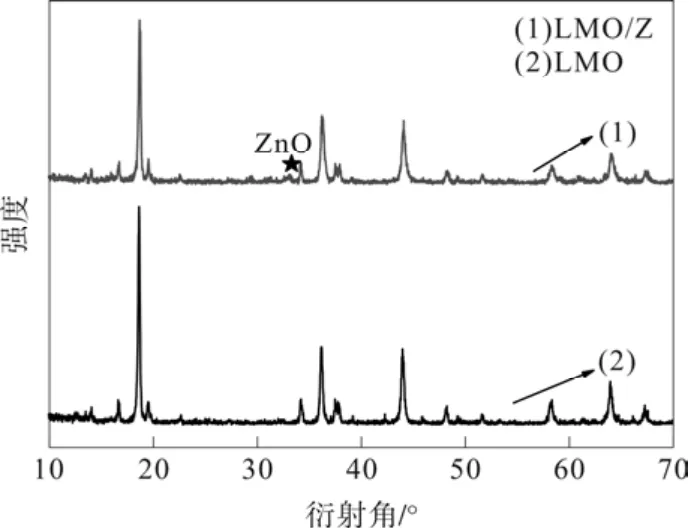
图1 ZnO包覆前后的XRD图
2.2 微观形貌分析
图2为包覆ZnO前后的SEM图,可以看出种氧化锌均匀包覆在材料LMO的颗粒上面,没有看到团聚的氧化物。分析认为,对于前驱体进行氧化物的包覆,可有效地减缓氧化物聚集的情况,并且成核过程的高温使得氧化物与材料有良好的结合力。包覆纳米级氧化物后没有对材料形貌造成破坏,这有利于材料性能的发挥。
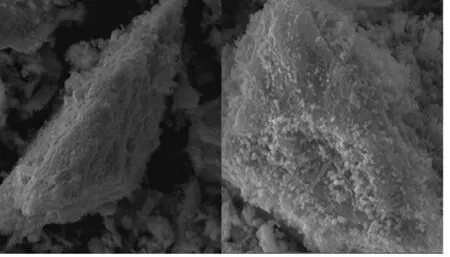
图2 包覆ZnO前后的SEM图
2.3 循环性能测试
图3为LMO和LMO/Z两种材料在0.2C的条件下50次循环性能图。由图已知,LMO和LMO/Z在50次循环后的放电容量分别为85.9和96.3 mAh·g-1,容量保持率分别为76.2%和93.1%。从数据可以看出,LMO/Z的循环性能较优于LMO,这说明包覆ZnO可以提高LMO的循环性能。
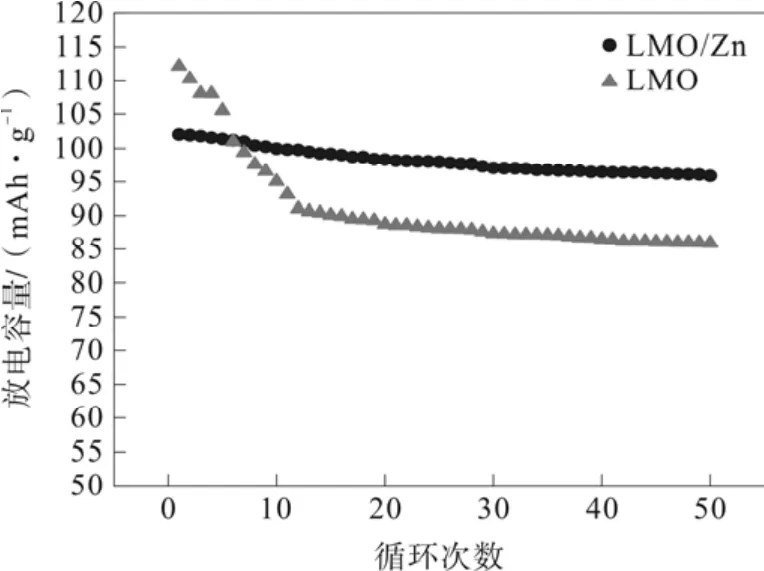
图3 循环性能图
2.4 循环伏安测试
图4显示两种样品50次循环后的循环伏安曲线。每条曲线都具有两对氧化还原峰,所对应的是充放电过程中的两个电压平台。氧化还原峰之间的峰值电位差(ΔEP)的大小反映了电池的极化程度。表1显示了样品的循环伏安曲线的峰值参数。与LMO相比,LMO/Zn的ΔEp较小,表明锂离子的嵌入和脱出情况最好,反映了纳米氧化物的包覆可提高电化学性能,这与图3中的循环实验结果一致。
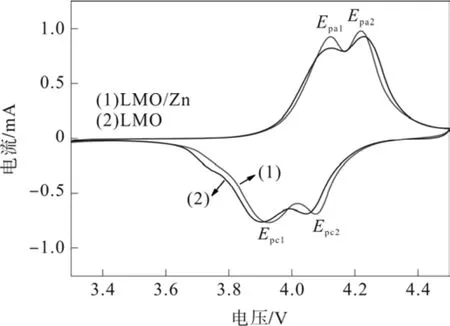
图4 两种样品的CV曲线
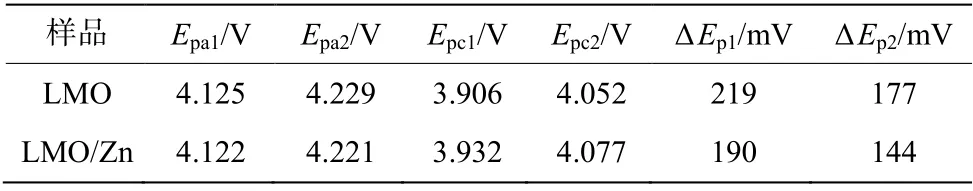
表1 样品CV曲线的峰值参数
2.5 阻抗分析
图5是LMO和LMO/Zn两种样品的奈奎斯特曲线图。可以看出,2个样品的交流阻抗谱图中都包含高频区域的半圆和低频区与实轴成夹角的一条直线,分别代表了相应电极与法拉第反应有关的电荷传递阻抗(Rct1 andRct2)和Li+在LMO内部的扩散,其中圆弧的直径越小表示电荷传递阻抗越低。所以,LMO/Zn的阻抗略大于LMO。
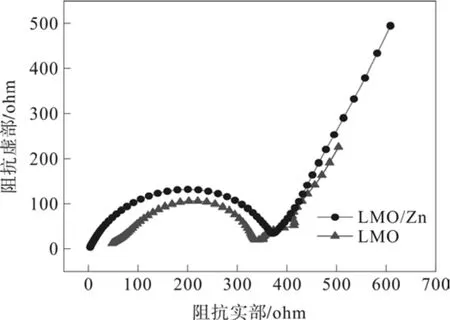
图5 两种样品的奈奎斯特曲线图
3 结 论
LiMn2O4具有良好的放电能力和较高的速率能力和循环性。其中,在0.2 C下,LiMn2O4/ZnO的初始放电容量为102.0 mAh·g-1。50次循环后,LiMn2O4/ZnO的容量保留率为93.1%,高于LiMn2O476.2 %。电化学性能的提高可能是由于纳米级氧化物阻碍了电解液与电极的反应,有效地改善了材料在大电流充放电时的稳定性,这将有助于电子的转移和Li+在复合材料中的插入/提取。

