油菜秸秆高效降解菌的筛选及其双功能纤维素酶性质研究
李凌波,许欢欢,夏燕维,郭传旭,杨明珠,马磊,缪有志,刘东阳,张瑞福
(南京农业大学江苏省固体有机废弃物资源化研究重点实验室,江苏 南京 210095)
农作物秸秆是自然界中丰富且廉价的生物质资源,相较于煤炭、石油、天然气等化石能源具有可再生性。我国是一个农业大国,秸秆资源丰富,全国秸秆总年产量高达10亿t左右,占世界秸秆总年产量的20%~30%。因此,秸秆资源的高效利用在缓解能源危机、提高土壤肥力、实现农业绿色发展等方面具有重要意义[1]。
纤维素作为农作物秸秆的重要组成部分,物质结构复杂,其由成千上万个D-吡喃型葡萄糖残基通过β-1,4-糖苷键连接而成,是一种不溶于水的天然高分子多糖类聚合物[2]。相较物理、化学等处理方法而言,利用微生物分泌纤维素酶降解纤维素类生物质具有反应条件温和、成本低、污染小、可重复利用等优点[3],已被广泛应用于农业、饲料加工、纺织工业等领域。其中,真菌产纤维素酶多为胞外酶,菌丝可穿过细胞壁插入胞内,由内而外降解纤维素,较细菌和放线菌更具降解优势[4]。纤维素酶是一个多酶体系,通过协同作用将天然纤维素水解生成低聚糖并最终转化成葡萄糖。按照其催化模式以及不同的结构特征,将纤维素酶系中的酶组分分为3类,分别是内切葡聚糖酶(endo-β-1,4-glucanase,EC 3.2.1.4),又称Cx酶或CMC酶;外切葡聚糖酶(exo-β-1,4-glucanase,EC 3.2.1.91)又称C1酶;以及β-葡萄糖苷酶(β-glucosidases,EC 3.2.1.21),又称CB酶[5]。目前,纤维素酶过高的生产成本严重制约了生物质的经济转化及其增值产品的生产。与融合酶、多酶混合物相比,双功能酶不仅克服了在生产过程中可能会出现的部分人工连接效应、结构域意外错误折叠、蛋白产量低等局限性,而且有效降低了酶生产、纯化以及装载的成本,大幅提高了木质纤维素生物质的降解速率及行业经济效益[6-8]。因此,克隆表达出具有双功能或多功能的纤维素酶将有助于推动木质纤维素生物质工业的发展[9]。
油菜居我国五大油料作物之首,我国油菜生产面积和产量常年位居世界首位[10],而油菜秸秆本身过高的木质纤维素含量使秸秆内各组分通过不同的结合力而紧密交联,导致油菜秸秆的利用效率远不及水稻、小麦、玉米等主要粮食作物秸秆[11]。同时,由于油菜秸秆“体积大、重量轻”的特点以及收获后抢种水稻等原因,其在农村的主要处置方式仍为直接废弃或露天焚烧,这不仅造成了资源的大量浪费,同时引发严重的环境污染问题[12]。本研究从腐烂油菜秸秆田土样中分离筛选出1株可以高效降解油菜秸秆的真菌绿色木霉(Trichodermaviride)A15,研究菌株A15对油菜秸秆的降解特性,并对其双功能纤维素酶基因进行克隆和异源表达,旨在为油菜秸秆的高效利用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 样品采集与处理在南京市江宁区世凹桃园油菜田采集腐烂油菜秸秆及其土壤样品以供菌株筛选。用自来水反复冲洗新鲜油菜秸秆以去除其表面的泥土与杂质,烘干并用粉碎机粉碎后,将样品置于阴凉干燥处保存备用。
1.1.2 菌株、质粒及培养基大肠杆菌(Escherichiacoli)DH5α、表达宿主毕赤酵母(Pichiapastoris)X33、载体pPICZαA均由本实验室保藏。
PDA培养基:200 g·L-1马铃薯,20 g·L-1葡萄糖。LB培养基:3 g·L-1NaCl,5 g·L-1酵母粉,10 g·L-1蛋白胨。富集培养基:在250 mL锥形瓶中加入5 g油菜秸秆粉,0.9 g·L-1NaCl,0.3 g·L-1(NH4)2SO4,0.1 mol·L-1PBS缓冲液(pH7.4)90 mL。羧甲基纤维素钠(CMC-Na)培养基:1 g·L-1KH2PO4,1 g·L-1NH4NO3,0.5 g·L-1MgSO4·7H2O,15 g·L-1CMC-Na,1 g·L-1酵母粉。无机盐培养基:18 g·L-1KH2PO4,5.9 g·L-1(NH4)2SO4,0.5 g·L-1MgSO4·7H2O,0.8 g·L-1CaC12,5 mg·L-1FeSO4·7H2O,1.6 mg·L-1MnSO4·H2O,1.4 mg·L-1ZnSO4·7H2O,2 mg·L-1CoC12·6H2O。秸秆固体发酵培养基:在50 mL锥形瓶中加入2.0 g油菜秸秆粉,5 mL无机盐培养基,灭菌后加入1 mL 1.0×107CFU·mL-1菌株孢子悬液,调节其含水率为75%。秸秆液体发酵培养基:在250 mL锥形瓶中加入1.0 g油菜秸秆粉,100 mL无机盐培养基。YPDS培养基:20 g·L-1葡萄糖,10 g·L-1酵母粉,20 g·L-1蛋白胨,182 g·L-1山梨醇。BMGY培养基:10 g·L-1甘油,10 g·L-1酵母粉,20 g·L-1蛋白胨,13.4 g·L-1YNB,11.81 g·L-1KH2PO4,3.01 g·L-1K2HPO4。
1.2 菌株的富集、分离与筛选
称取10 g采集的土样置于250 mL锥形瓶中,加入90 mL无菌水,在28 ℃、170 r·min-1条件下振荡 60 min,吸取5 mL悬浊液转接至新鲜的富集培养基中,28 ℃、170 r·min-1条件下培养48 h,如此重复转接3次。采用稀释涂布平板法,将富集液分别进行10-4、10-5、10-6梯度稀释,分别取100 μL稀释液涂布到PDA平板上,每个浓度梯度设置3个重复,28 ℃培养7 d。观察平板中菌落的生长情况,挑取不同形态的单菌落进行纯培养。通过刚果红-透明圈试验对纯化后的菌株进行初筛[13]。观察透明圈直径(D)与菌落直径(d)的比值(D/d)来初步判断该菌株降解纤维素的能力。添加1 mL 1.0×107CFU·mL-1菌株孢子悬液于秸秆固体发酵培养基中,28 ℃静置发酵7 d后进行破坏性取样。取1 g发酵后的秸秆样品于锥形瓶中,加入10 mL去离子水,在28 ℃、170 r·min-1条件下振荡60 min。4 ℃、10 000 r·min-1离心10 min,上清液即为粗酶液。采用3,5-二硝基水杨酸比色法测定菌株滤纸酶(FPA)活性及纤维素内切酶(CMC)活性[14],每个样品重复测定3次。酶活性定义:在50 ℃条件下,1 min内产生1 μmol葡萄糖所需酶量为1个酶活性单位(U)。
1.3 菌株形态学观察及分子生物学鉴定
将菌株接种于PDA平板中央,周围插放盖玻片使菌丝能够向盖玻片上生长,28 ℃培养3 d后,用无菌镊子夹取布满菌丝的盖玻片,置于载玻片上,在显微镜下观察菌株菌落特征、菌丝、分生孢子梗和分生孢子。将不同时期的固体发酵油菜秸秆样品取出,浸泡在新配制的2.5%戊二醛溶液中,4 ℃固定8 h以上。经PBS清洗、乙醇梯度脱水、叔丁醇置换、冷冻干燥后,将样品用双面胶粘贴至样品观察台上,进行镀膜,随后利用扫描电镜对秸秆样品的微观结构进行观察。
使用DNeasy Power Soil Pro Kit(QIAGEN公司)提取菌株DNA,以基因组DNA为模板,采用ITS通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增[13]。PCR扩增体系(50 μL):GreenTaqMix 25 μL,ITS1引物2 μL,ITS4引物2 μL,DNA模板4 μL,无菌水17 μL。扩增程序:94 ℃ 5 min;94 ℃ 30 s、52 ℃ 30 s、72 ℃ 45 s(32个循环);72 ℃ 10 min。将扩增产物送至生工生物工程(上海)股份有限公司进行测序分析,并将ITS测序结果在NCBI上进行相似性比对分析,最后用软件MEGA7.0构建系统发育树。
1.4 常规化学指标的测定
添加1 mL 1.0×107CFU·mL-1菌株A15孢子悬液于油菜秸秆固体发酵培养基中,置于28 ℃培养箱内静置培养,分别于培养1、3、7、14、21和28 d后进行破坏性取样。利用差重法计算秸秆失重率,采用改进后的范式洗涤法(Van Soest)测定油菜秸秆中的纤维素、半纤维素、木质素含量,使用总有机碳/总氮分析仪测定水溶性碳、水溶性氮含量,利用碳氮元素分析仪测定总碳、总氮含量[15]。每个样品均重复测定3次。
1.5 模拟秸秆还田盆栽试验
于2021年6—7月在南京农业大学校园进行盆栽试验,试验期间室外温度为20~35 ℃,供试土壤采集于南京农业大学白马教学科研基地当季收获后的油菜田土壤。每个盆栽装置装3 kg土样,用150 μm尼龙网带装入4 g油菜秸秆(长度约为2~3 cm)后埋入土内约3 cm处。设置处理组(秸秆与1.0×107CFU·mL-1菌株A15孢子悬液的质量体积比为1∶1混匀)以及对照组(秸秆与等量无菌水充分混匀),试验过程中不断补充水分,以保证含水率为60%~80%。分别于培养10、20和30 d后取样,测定秸秆的失重率,各时期样品均重复测定3次。
1.6 纤维素酶酶谱分析及质谱鉴定
添加1 mL 1.0×107CFU·mL-1菌株A15孢子悬液于油菜秸秆液体发酵培养基中,28 ℃、170 r·min-1条件培养7 d,4 ℃、10 000 r·min-1离心10 min,上清液即为粗酶液。选用生工生物工程(上海)股份有限公司的Precast-Glgel 12%非变性电泳Hepes预制胶,将15 μL粗酶液与15 μL 2×非变性蛋白上样缓冲液均匀混合后上样,以100 V电压低温电泳5 h。电泳结束后,将一半凝胶进行活性染色,一半凝胶进行普通考染[16]。将目的胶条切下送至杭州景杰生物科技股份有限公司进行LC-MS/MS质谱检测。
1.7 目的基因的克隆与重组表达载体的构建
利用RNeasy Plant Mini Kit(QIAGEN公司)提取菌株RNA,以菌株总RNA作为模板,利用HiScript Ⅱ Q RT SuperMix for qPCR试剂盒(南京诺唯赞生物科技股份有限公司)进行逆转录,合成cDNA。通过质谱鉴定结果可以得到celI基因序列,对其酶切位点进行分析,同时结合基因本身的信号肽序列,设计出用于毕赤酵母异源表达的特异性引物。
以菌株cDNA作为模板,使用Phanta Max Super-Fidelity DNA Polymerase(南京诺唯赞生物科技股份有限公司)对目的基因片段进行扩增。PCR扩增体系(50 μL):2×Phanta Max Buffer 25 μL,dNTP Mix 1 μL,Phanta Max Super-Fidelity DNA Polymerase 1 μL,Primer F(5′-GGAATTCCAGCAGCCTGGAACTAGCAC-3′)2 μL,Primer R(5′-GCTCTAGACAGTCATTGTT GTACTGGCA-3′)2 μL,cDNA模板1 μL,无菌水18 μL。扩增程序:95 ℃ 3 min;95 ℃ 15 s,55 ℃ 15 s,72 ℃ 2 min(32个循环);72 ℃ 5 min。利用10 g·L-1琼脂糖凝胶对目的基因片段的PCR扩增产物进行电泳检测,采用FastPure Gel DNA Extraction Mini Kit(南京诺唯赞生物科技股份有限公司)对目的片段进行凝胶回收。
用限制性内切酶EcoRⅠ、XbaⅠ对目的基因及表达载体pPICZαA进行双酶切。双酶切体系:EcoRⅠ10 μL,XbaⅠ10 μL,10×M Buffer 10 μL,目的基因/表达载体质粒30 μL,无菌水40 μL。置于37 ℃恒温酶切20 h后,清洁回收酶切产物,采用T4连接酶进行酶连。酶连体系:10×T4DNA Ligase Buffer 2 μL,T4DNA Ligase 1 μL,双酶切pPICZαA载体0.5 μL,双酶切目的基因2 μL,无菌水14.5 μL。16 ℃酶连过夜,再利用热激法将其转入大肠杆菌DH5α感受态细胞中[17]。
1.8 纤维素酶CelI在毕赤酵母中的异源表达及纯化
采用FastPure Plasmid Mini Kit(南京诺唯赞生物科技股份有限公司)提取重组质粒。限制性内切酶MssⅠ酶切重组质粒。反应体系:MssⅠ 5 μL,10×Buffer B 10 μL,重组质粒10 μg,无菌水补足至100 μL。37 ℃酶切过夜,利用10 g·L-1琼脂糖凝胶进行电泳检测。
将线性化后的重组质粒清洁回收,电转入毕赤酵母X33感受态[17]。随机挑取酵母重组转化子,在装有20 μL Lysis Buffer for Microorganism to Direct PCR的八连管中充分搅动,于85 ℃加热15 min,作为菌落PCR反应的模板。PCR扩增体系(50 μL):2×TaqSuper Mix 25 μL,Primer F 2 μL,Primer R 2 μL,模板DNA 2 μL,无菌水19 μL。扩增程序:94 ℃ 3 min;94 ℃ 30 s、55 ℃ 30 s、72 ℃ 2 min(32个循环);72 ℃ 5 min。10 g·L-1琼脂糖凝胶进行PCR电泳检测,将验证正确的转化子接种于BMGY液体培养基内,30 ℃、170 r·min-1培养24 h后,于每日同一时间添加1%(体积分数)甲醇诱导目的蛋白的表达。
采用硫酸铵沉淀法浓缩发酵液中的酶蛋白,利用Nuvia IMAC Ni-Charged镍柱(Bio-Rad公司)纯化目的蛋白。将蛋白样品与5×蛋白上样缓冲液按相应比例混合,100 ℃反应5 min使蛋白变性,随后进行聚丙烯酰胺凝胶电泳。电泳结束后,对PAGE胶进行考马斯亮蓝染色、分析[17]。
1.9 纤维素酶CelI酶学特性分析
采用3,5-二硝基水杨酸比色法测定纯化蛋白的内切葡聚糖酶活性,采用对硝基苯纤维二糖苷(pNPC)法测定纯化蛋白的外切葡聚糖酶活性[14],以1 μmol·L-1酶溶液1 h内产生的葡萄糖(或对硝基酚)定义为1个酶活性单位U。探究CelI最适反应温度时,设置反应温度梯度为30、40、50、60、70和80 ℃;探究CelI温度稳定性时,将纯化蛋白分别在40、45、50、55和60 ℃条件下分别温育0.5、1、2、4、6和8 h;探究CelI最适pH值时,分别加入pH值为3.0、4.0、5.0、6.0和7.0的0.05 mol·L-1醋酸-醋酸钠缓冲液;探究不同金属离子对CelI的影响时,分别加入100 μL 0.05 mol·L-1的ZnCl2、MnCl2、FeCl3、CaCl2、NaCl、CoCl2溶液。
2 结果与分析
2.1 油菜秸秆高效降解菌的分离筛选
从腐烂的油菜秸秆土样中共分离纯化出8株真菌,刚果红透明圈筛选试验显示不同菌株之间的透明圈差异较大,其中菌株A15的D/d值最大,为3.0。将初筛得到的8株真菌接种于以油菜秸秆为唯一碳源的固体发酵培养基中,测定其发酵7 d后的滤纸酶(FPA)活性和纤维素内切酶(CMC)活性。从图1可知:菌株A15的滤纸酶活性和内切酶活性均显著高于其他菌株,分别达16.13和8.16 U·g-1。综合初筛以及复筛试验结果,最终获得油菜秸秆高效降解菌株A15。
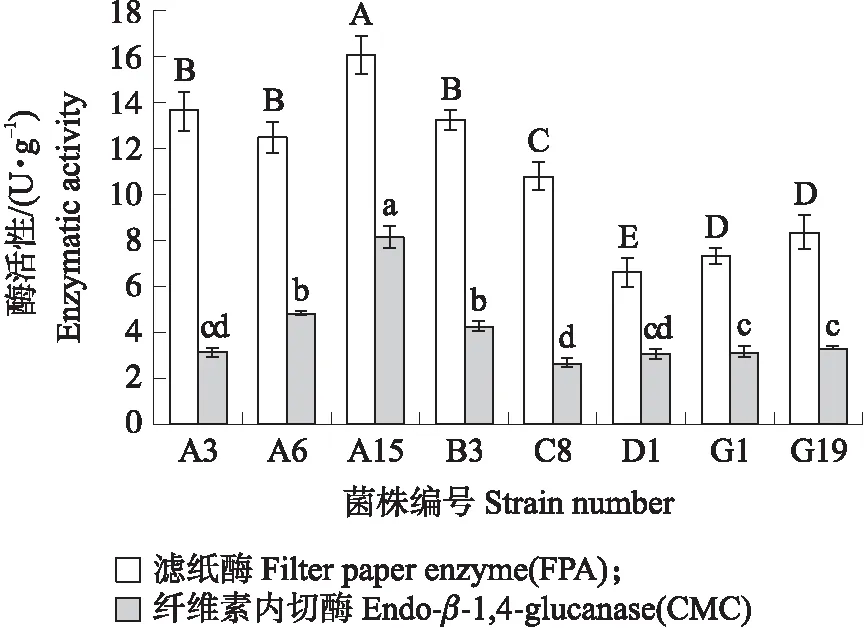
图1 不同菌株的纤维素酶活性Fig.1 Cellulase activity of different strains 不同大、小字母表示不同样本间在0.05水平差异显著。Different capital and lowercase letters indicate that there is significant difference between different samples at the level of 0.05.
2.2 菌株A15的鉴定
将菌株A15接种在PDA平板上,28 ℃培养7 d,观察其形态特征。菌株生长迅速,初期产生絮状白色菌丝体,3~4 d后表面变绿,产生孢子。在显微镜下进一步观察,可以明显看到菌丝内部有隔,可形成二级、三级分枝,分枝末端形成瓶状小梗,小梗顶端簇生分生孢子,孢子多为椭圆形,无色或绿色(图2)。依据文献[18],可初步判定菌株A15为木霉属真菌。提取菌株DNA,以DNA为模板,使用ITS通用引物进行PCR扩增。将菌株A15的ITS序列在NCBI上进行BLAST比对分析(图3),结果表明菌株A15与绿色木霉发育距离最近,其在同一分支内。结合菌株的形态学特征和ITS序列比对分析,鉴定菌株A15为绿色木霉。

图2 菌株A15的菌落特征及刚果红透明圈示意图Fig.2 Colony characteristics and schematic diagram of Congo red transparent circle of strain A15 A.菌落正面形态;B.菌落反面形态;C.孢子及菌丝形态;D.菌株在刚果红平板上的透明圈。A. Positive morphology of colony;B. Negative morphology of colony;C. Morphology of spores and hyphae;D. Transparent circle of strain on Congo red plate.

图3 菌株A15的系统发育分析Fig.3 Phylogenetic analysis of strain A15 参与比对序列的GenBank登录号已列出。分支处标注有自展值,0.005代表2个核苷的遗传距离。The GenBank login number participating in the alignment sequence is listed. The branch is marked with a self-expanding value,0.005 represents the genetic distance of two nucleosides.
2.3 菌株A15降解油菜秸秆过程中组分变化分析
随着菌株A15发酵油菜秸秆的时间增加,秸秆的失重率不断增加,28 d时可达29.17%,且在发酵初期秸秆的降解速率明显高于发酵后期。同时,秸秆的纤维素含量和半纤维素含量分别下降至29.41%和17.18%,而木质素的相对含量则略微上升至15.47%,表明菌株A15对纤维素及半纤维素均有良好的分解能力。伴随着发酵过程的持续,秸秆中总碳及水溶性氮的含量不断下降,至发酵结束时,总碳含量下降至456.16 g·kg-1,水溶性氮的含量下降至62.17 mg·L-1。而秸秆中总氮及水溶性碳的含量则先下降后上升,总氮含量在发酵7 d时达到最小值,为37.17 g·kg-1,发酵28 d时为40.91 g·kg-1,而水溶性碳含量在发酵7 d时达到最小值(460.89 mg·L-1),发酵28 d时增加至473.25 mg·L-1(表1)。
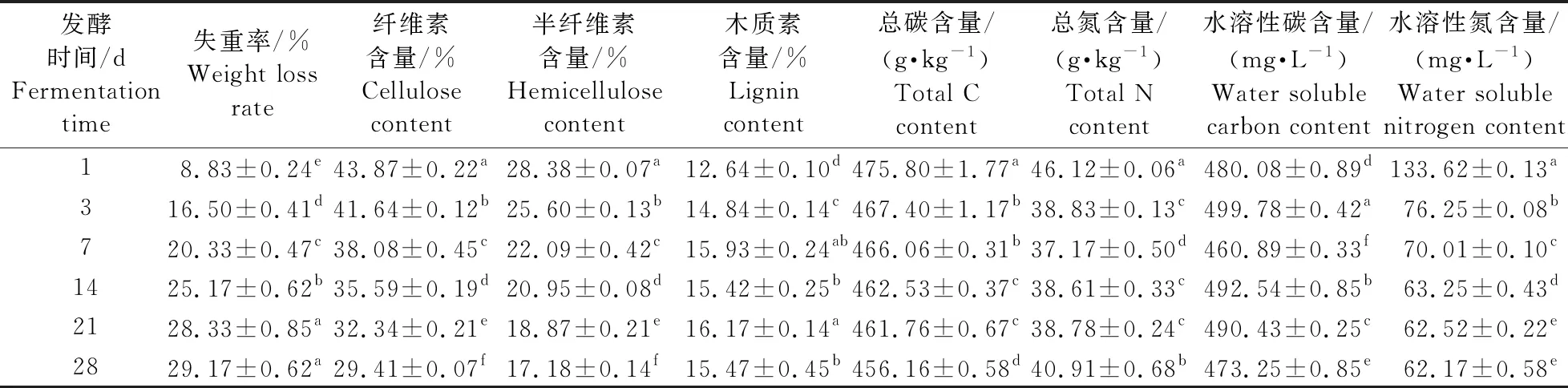
表1 菌株A15降解油菜秸秆过程中的组分变化Table 1 Changes of components during solid fermentation of rape straw by strain A15
2.4 菌株A15降解油菜秸秆过程中表面结构的变化
从图4可知:发酵1 d时,秸秆木质纤维结构完整,表面平滑,仅出现少许细小圆形孔洞,菌丝开始附着在秸秆表面(图4-B)。当发酵14 d时,秸秆表层结构出现明显破裂,由初始的完整平滑状态裂解为无定形松散状态,并伴随出现大量不规则孔洞(图4-C)。当发酵28 d时,秸秆结构被严重破坏,整体呈现出断裂状的碎片状态且秸秆结构变得更加纤细化,出现大量条状裂纹,菌丝体侵入秸秆内部,通过其分泌的水解酶系来有效降解秸秆的木质纤维素结构(图4-D)。

图4 菌株A15固体发酵油菜秸秆扫描电镜图Fig.4 Scanning electron microscopy of solid fermentation of strain A15 A.菌株A15的菌丝及孢子囊;B、C、D分别为固体发酵1、14、28 d的油菜秸秆扫描电镜图像。A. Mycelium and sporangia of strain A15;B,C and D represent the scanning electron microscope image of rape straw on the 1,14 and 28 d of solid fermentation.
2.5 菌株A15盆栽模拟秸秆还田试验结果分析
分别于培养10、20和30 d取样,油菜秸秆的形态变化如图5所示。随着菌株A15降解油菜秸秆的时间增加,秸秆的腐解程度不断加剧。在初始状态下,秸秆呈现亮黄色,质地坚硬,光泽度良好;伴随包埋时间的推移,秸秆的颜色发生明显变化,颜色由起初的亮黄色,不断变深变黑逐渐失去光泽,同时,秸秆的体积不断缩小,硬度也持续下降,变得松散柔软易碎;至30 d时秸秆失重率达57.50%,显著高于不接菌对照组(43.88%)(表2)。表明菌株A15可有效降解油菜秸秆,具有良好的应用前景。
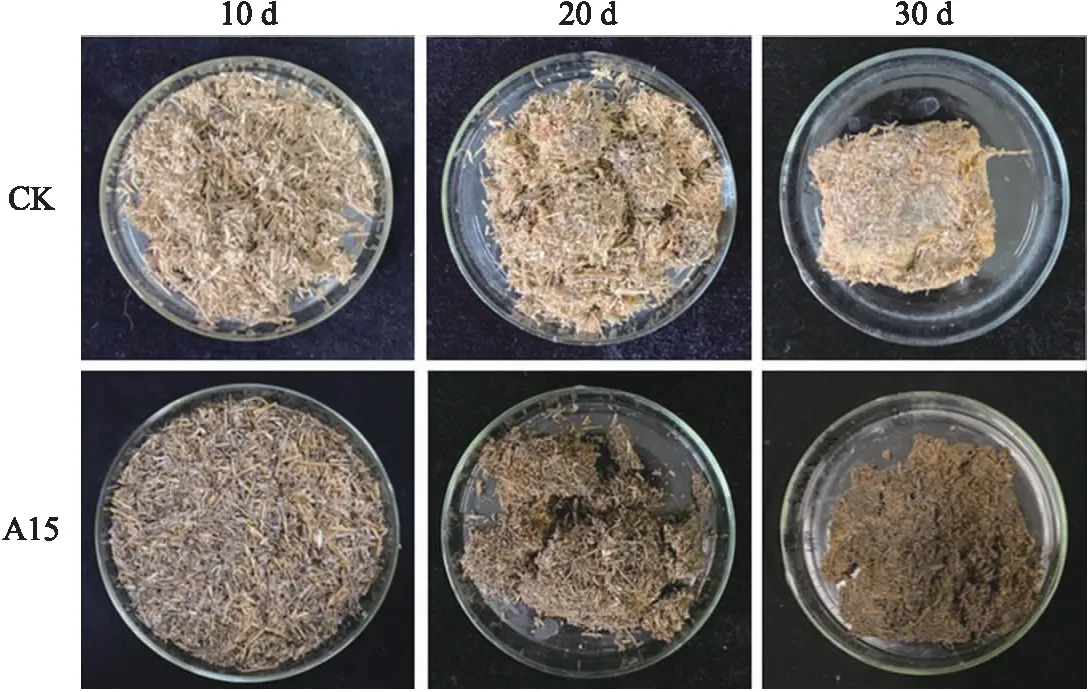
图5 盆栽模拟秸秆还田过程中油菜秸秆形态变化Fig.5 Morphological changes of rape straw during simulated straw returning in pot
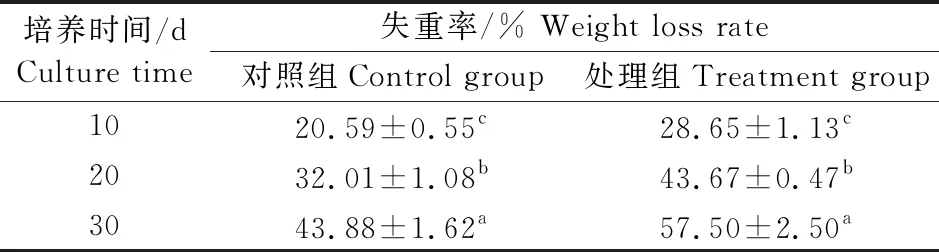
表2 盆栽模拟秸秆还田过程中油菜秸秆的失重率Table 2 The weight loss rate of rape straw during simulated straw returning in pot
2.6 菌株A15纤维素酶基因celI的克隆与分析
菌株A15以油菜秸秆为唯一碳源生长的胞外酶谱分析显示,左侧活性染色胶图中出现1条清晰透明条带,其显现出CMC酶活性,而右侧考染胶图中的条带与左侧具有酶活的条带相互对应,因此,将对应CMC酶活性的目的胶条切下进行LC-MS/MS质谱检测。
通过酶谱的质谱检测,获得1个纤维素酶氨基酸序列,其编码基因(celI)序列分析显示该基因全长1 374 bp,编码457个氨基酸,预测蛋白相对分子质量为47.405×103,理论等电点为5.06。利用NCBI的Conserved Domains对CelI的核苷酸序列进行功能结构预测,其含有1个CBH-EG保守结构域,隶属于GH7家族。利用SignalP-5.0 Server对CelI蛋白的信号肽进行分析,其信号肽为N端的24个氨基酸,推测该蛋白是一种胞外分泌蛋白。利用SWISS-MODEL对CelI进行同源建模,预测蛋白的三维结构。将CelI的氨基酸序列与PDB数据库中已知结构的蛋白进行比对,结果显示模板来源于Trichodermaharzianum(SMTL ID:5w0a.1.A),相似度为94.09%,可信度较高。CelI的结构(图6)为由多个loop区围绕反向平行的β-折叠而形成的β-三明治结构,是GH7家族典型的蛋白结构特征[19]。
图6 CelI蛋白的三维结构预测模型Fig.6 Three dimensional structure prediction model of CelI protein
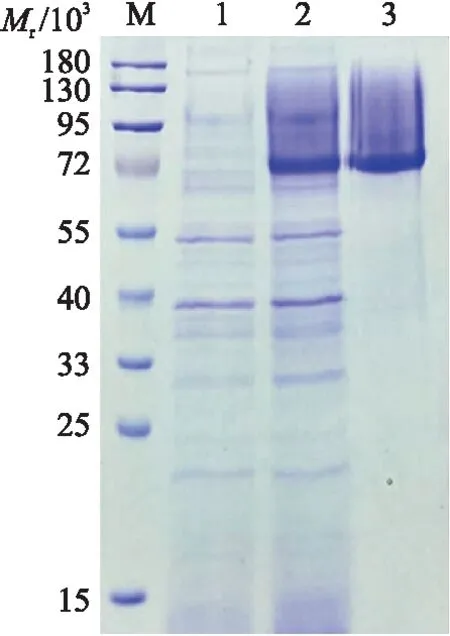
图7 CelI蛋白的SDS-PAGE分析Fig.7 SDS-PAGE analysis of CelI protein M. 蛋白标准品;1. pPICZαA空载转化菌株胞外总蛋白;2. pPICZαA-celI转化菌株胞外总蛋白;3. 纯化后蛋白。M. The standard protein marker;1. Total extracellular protein of the pPICZαA transformed strain;2. Total extracellular protein of the pPICZαA-celI transformed strain;3. Purified protein.
2.7 纤维素酶CelI的异源表达与酶学特性分析
表达纯化后的蛋白相对分子质量约为72×103(图7),较预测值偏大,可能是重组蛋白糖基化所造成的。CelI包含一个CBH-EG保守结构域,其同时能展现出内切葡聚糖酶和外切葡聚糖酶的双重活性。对纤维素酶CelI的酶学特性进行探究,结果如图8所示。纤维素酶活性随着酶促反应温度的上升先升后降,在50 ℃时达到最大值,温度过低或过高均影响酶促反应速率;在40、45 ℃条件下温育8 h时,重组纤维素酶活性保持较好,与初始值变化不大,当温育温度大于50 ℃时,随着温育时间的增加,酶活性均显著下降;当pH3时,纤维素酶活性趋近于0,而CelI的内切葡聚糖酶活性在pH4时达最大值,其外切葡聚糖酶活性在pH5时达最大值;Co2+、Mn2+、Ca2+均对CelI的内切纤维素酶活性具有促进作用,而对于外切纤维素酶活性来说,Mn2+具有显著激活作用,Zn2+、Fe3+具有抑制作用。
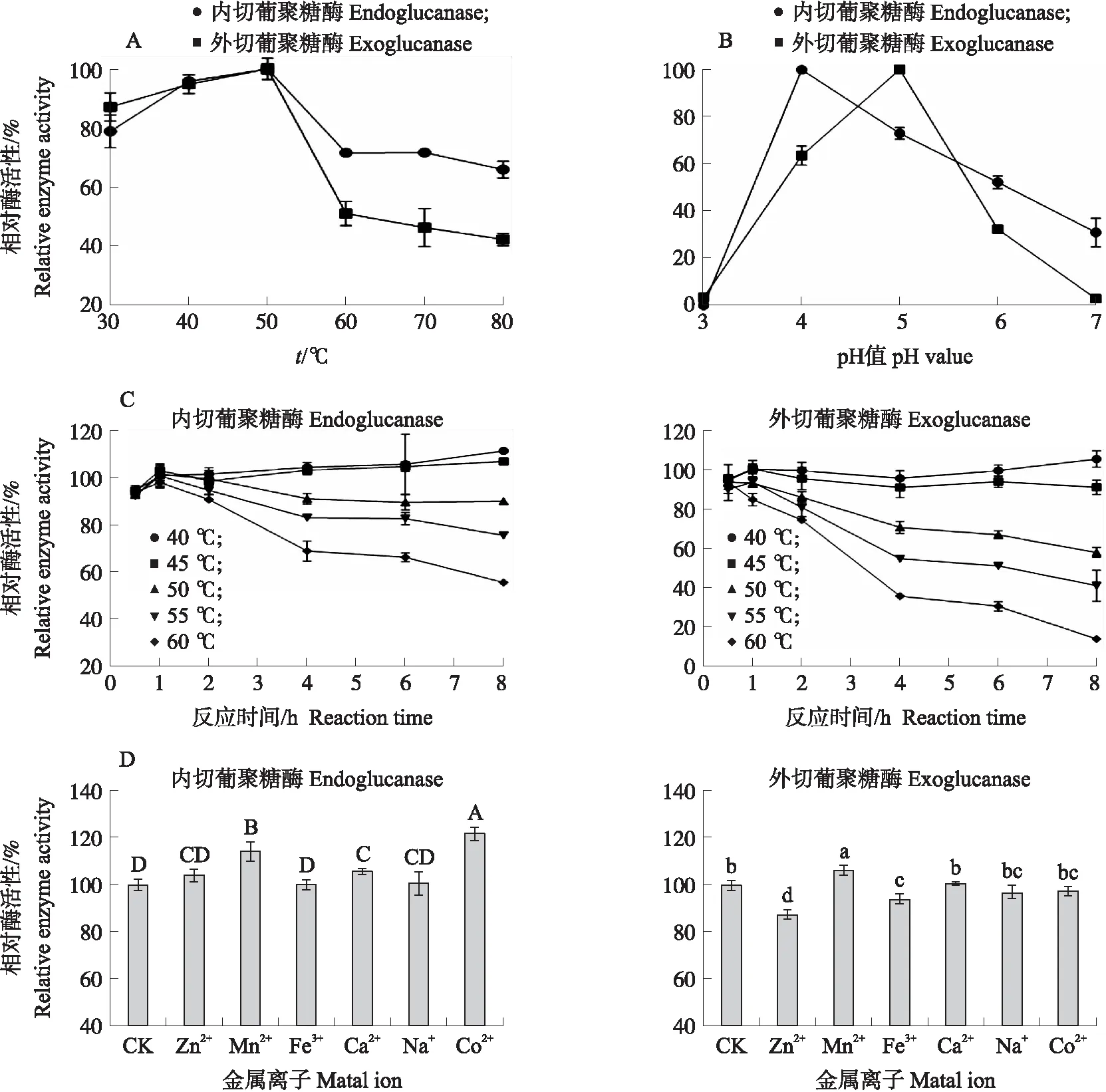
图8 不同条件下CelI酶活性的变化Fig.8 Changes of CelI enzyme activity under different conditions A. 温度对CelI酶活性的影响;B. pH值对CelI酶活性的影响;C. 温度对CelI稳定性的影响;D. 不同金属离子对CelI酶活性的影响。A. Effect of temperature on the activity of CelI;B. Effect of pH value on the activity of CelI;C. Effect of temperature on the stability of CelI;D. Effects of different metal ions on the activity of CelI.
3 讨论
生物质能源作为唯一一种含碳的可再生能源,在实现碳中和、碳达峰等方面具有重要地位,是传统化石能源的极佳替代者。我国农作物秸秆生物质资源十分丰富,而中国作为油菜生产大国,其生产面积和产量均约占世界的1/3[12],江苏省作为长江下游油菜优势种植区,油菜秸秆年产量巨大。因此,大力推动油菜秸秆的资源化综合利用在实现江苏省农业绿色发展以及生态环境保护等领域具有重要战略意义。
油菜秸秆的物质结构和成分十分复杂,主要由纤维素、半纤维素、木质素交联而成,共同构成牢固的三维立体木质纤维素结构。在自然环境中,微生物充当分解者,通过分泌多种酶系来有效降解、利用秸秆生物质资源。其中,真菌多产胞外酶,且产酶量大、产酶效率高、产酶种类多,而被认为是秸秆纤维素类物质的主要降解者,丝状真菌则最具代表性。本研究从南京市腐烂油菜秸秆田取样,在自然条件下筛选出更适合于降解油菜秸秆的菌株。通过前期一系列富集筛选试验,得到一株高效油菜秸秆降解真菌TrichodermavirideA15,试验结果表明以油菜秸秆粉为底物,菌株A15可分泌大量纤维素酶至发酵培养基中。王金昌等[20]通过类似的方法从土壤中筛选出1株高效降解水稻秸秆的真菌草酸青霉(Penicilliumoxalicum)T1,其滤纸酶活性、内切葡聚糖酶活性、外切葡聚糖酶活性和β-葡聚糖苷酶活性分别达30、78.68、22和39 U·mL-1。杨娜等[21]从自然发酵堆肥中筛选出1株纤维素降解真菌SC2,发酵10 d后其对玉米秸秆的降解率可达33.07%,经鉴定为黑曲霉(Aspergillusniger)。本研究利用改进后的范式洗涤法(Van Soest)对菌株A15固体发酵过程中油菜秸秆的木质纤维素含量进行测定,结果显示随着发酵进程的持续,秸秆中纤维素以及半纤维素含量均显著降低,但木质素含量则略有增加,原因是相较于纤维素及半纤维素来说,木质素含量更低且更难被降解,其降解的程度和速度远不及前者,所以导致剩余物中木质素的相对含量略有提升。Arantes等[22]的研究也发现了类似的结果。
本研究通过纤维素酶酶谱分析及质谱检测技术获得GH7家族纤维素酶基因celI的序列信息,并利用基因工程技术实现了该基因在毕赤酵母中的异源表达。糖苷水解酶7家族(GH7)中的纤维素酶在丝状真菌分解秸秆木质纤维素中起着关键作用,并已成为工业纤维素分解过程中酶混合物的主要成分[23-24]。对CelI的酶学性质研究发现,其同时具有内、外切葡聚糖酶活性的双重功能,而“内、外协同作用”对于纤维素的降解至关重要,其中内切葡聚糖酶主要水解纤维素的无定形部分,将纤维素链截短并产生大量新的糖链末端,从而增加纤维二糖水解酶的链端可用性,进而增加整体的降解效率[25]。CelI的内、外切葡聚糖酶活性的最适反应温度均为50 ℃,这与其他真菌纤维素酶[26]的最适温度相似,但最适pH值略有不同。Pellegrini等[26]对Trichodermaharzianum的重组内切葡聚糖酶Cel7B进行研究发现,其在55 ℃、pH3时显示出最佳活性,而Colussi等[27]的研究发现Trichodermaharzianum的纤维二糖水解酶(ThCBHI)的最适温度为50 ℃,最适pH值则为5。本研究中,CelI具有良好的热稳定性,将其置于50 ℃条件下保持8 h后仍具有约95%的内切葡聚糖酶活性及62%的外切葡聚糖酶活性。综上所述,本研究筛选获得了高效油菜秸秆降解菌株,为后期菌株的扩大培养和菌剂制备奠定了基础。

