水稻黄绿叶突变体yellow-green leaf 4的表型鉴定及候选基因定位和功能分析
刘忠学,张渝竣,刘林,刘世家,田云录,周时荣,江玲,万建民,2,刘玲珑*
(1.南京农业大学作物遗传与种质创新国家重点实验室/江苏省植物基因工程技术研究中心,江苏 南京210095;2.中国农业科学院作物科学研究所,北京100081)
水稻(Oryzasativa)是我国主要粮食作物之一,同时也是单子叶模式作物[1]。叶绿体是否正常发育和能否发挥功能对水稻的生长发育起到重要作用。叶色突变体的发现为研究叶绿体代谢、发育和光合作用分子机制提供理想遗传材料[2]。在水稻中发现了黄绿叶突变体yellow-greenleaf2(ygl2)[3]、yellow-greenleaf11t(ygl11t)[4]、yellow-greenleaf1(yg180)[5]、green-white-greenleaf(gwgl)[6],这些突变体的研究增加了对水稻光合作用和叶绿体发育的理解。
核黄素是一种水溶性维生素,可影响动物营养的吸收和生长及动物对疾病的抵抗力[7-10];核黄素也可以消除植物中的活性氧[11]。核黄素在植物体内的合成路径已经清晰,并且这些过程在所有植物体中都相似[12]。6,7-二甲基-8-核糖醇基二氧四氢蝶啶合酶(LS)催化核黄素合成反应中5-氨基-6-核糖基氨基-2,4(1H,3H)-嘧啶二酮与3,4-二羟基-2-丁酮4-磷酸缩合产生6,7-二甲基-8-核糖醇[12]。LS基因的突变会导致核黄素在植物体内的表达水平变化,进而影响植株生长、抗病性及众多生理生化过程[13-14]。例如,在拟南芥中发现了CORONATINEINSENSITIVE1(COI1)抑制基因CONIDIOPHORESTALK-LESS1(COS1),其编码一个LS基因,过表达COS1能恢复coi1突变体植物防御和衰老缺陷的表型[15]。但LS影响水稻叶色和叶绿体发育的作用还鲜有报道。
本研究从水稻品种‘中花11’中分离到1个黄绿叶突变体ygl4,在3叶期初期,ygl4叶片呈黄绿色表型,ygl4叶片光合色素含量降低,叶绿体发育受阻,突变性状在整个生长期均能保持。图位克隆和测序分析表明候选基因为LOC_Os04g42000。同时,通过体外核黄素补充试验验证核黄素水平的恢复能弥补突变体的表型变化。这为研究该基因在水稻光色素合成中的作用机制奠定基础。
1 材料与方法
1.1 试验材料和农艺性状调查
从水稻品种‘中花11’甲基磺酸乙酯(EMS)诱变突变体库筛选到黄绿叶突变体ygl4。将突变体ygl4与籼稻品种‘N22’杂交,对F2代分离群体2 073个单株进行遗传分析,其中挑选表型与突变体一致的551个黄绿叶单株进行基因定位。水稻种植于南京农业大学土桥实验基地,采用常规的田间栽培管理措施[16]。野生型和突变体大田种植采用完全随机区组设计,每个小区均种植4行,每行10株,每个小区重复3次。在野生型和突变体成熟后,调查株高、分蘖数、穗长、剑叶长和宽等。在种子收获期,调查枝梗数、结实率、每穗粒数、粒长、粒宽、千粒重等农艺性状。每个性状每个小区调查20株,计算平均值和标准差。
1.2 叶绿体显微结构观察
在野生型和突变体植株生长至倒2叶期,分别取野生型和突变体完全白化部位、半黄化部位以及正常部位叶片。参考王致远等[16]的方法,用Hitachi H-7650透射电镜对样品进行观察和拍照。
1.3 不同温度下叶绿素(Chl)和类胡萝卜素(Car)含量测定
选取发育完好的野生型和突变体ygl4的种子各300粒,用清水浸种24 h,再于30 ℃培养箱中黑暗催芽12 h,挑选长势一致的种子分别于20、25、30 ℃恒温光照培养箱培养,每个温度梯度野生型与突变体种子各50粒,光照/黑暗时间为16 h/8 h。10 d后准确称各温度条件下野生型和突变体叶片各0.05 g,并剪成均匀块状,将其放入装满95%乙醇溶液的4 mL离心管中,在4 ℃条件下避光处理24 h,轻轻摇晃多次,使色素完全溶解。吸取200 μL上清液,采用酶标仪分别测量665、649和470 nm波长的吸光值。色素含量计算公式参照文献[16]。
1.4 基因定位
突变体与籼稻品种‘N22’杂交得到F1种子,F1自交获得F2种子。将F2代种子种植于南京农业大学土桥实验基地。在F2分离群体中挑选551个与ygl4表型一致的极端单株用于基因定位。使用CTAB法提取DNA[15],利用本实验室的SSR与Indel引物库筛选均匀分布在水稻12条染色体,且多态性良好的138对标记用于定位。选取10个与ygl4表型一致的单株进行初步连锁分析,将基因定位于N4-27和N4-33之间,根据Gramene(http://www.gramene.org/)数据库‘日本晴’和‘93-11’序列,利用NCBI(https://www.ncbi.nlm. nih.gov/)设计分子标记[15],将剩余的极端单株用于精细定位。新开发的用于精细定位引物见表1。
1.5 蛋白序列分析
通过NCBI网站(https://www.ncbi.nlm.nih.gov/)下载YGL4以及同源蛋白氨基酸序列;通过 Pfam网站(http://pfam.xfam.org/)预测蛋白功能结构域;通过BioXM(V2.6)软件比对蛋白氨基酸序列。
1.6 实时定量PCR分析
分别取野生型和突变体植株倒2叶,剪碎并加入钢珠,放进2.0 mL离心管磨碎后用RNA prep pure Plant Kit(天根生化有限公司)提取叶片总RNA。RNA反转录和实时定量PCR均采用TaKaRa公司Super Script Ⅱ反转录试剂盒和SYBR®PremixExTaqTMKit,使用ABI prism 7500实时定量PCR系统。反应体系参照文献[15]。UBQ5(Ubiquitin)基因作为内参,每个样品3次重复,采用2-ΔΔCT法进行分析处理[16]。相关基因引物参照文献[17]。
1.7 亚细胞定位
分别扩增野生型YGL4与突变体ygl4全长cDNA,然后拼接到含有CaMV35S启动子的瞬时表达载体pAN580中。原生质体提取参照Livak等[18]的方法,载体转化到水稻原生质体参照Liu等[19]的方法。使用激光共聚焦显微镜(LSM780,Carl Zeiss,Germany)观察GFP荧光信号定位情况。
1.8 核黄素互补试验
取野生型与突变体饱满种子各200粒在清水中浸种36 h,置于30 ℃培养箱中黑暗催芽12 h,挑选长势一致的种子在20 ℃恒温光照培养箱培养,光照/黑暗时间为16 h/8 h。野生型和其中1份突变体用正常水浇灌,另1份突变体用5 mg·L-1核黄素溶液浇灌。待2叶1心期时观察表型。

图1 不同时期野生型(WT)和突变体ygl4的表型Fig.1 Phenotypes of wild type(WT)and mutant ygl4 at different stages A. 4叶期植株表型,比例尺为1 cm;B. 4叶期叶片表型,比例尺为0.5 cm;C.3叶期前田间植株表型;D.5叶期后田间植株叶色表型。A. The phenotypes of plants at four-leaf stage,bar=1 cm;B. The phenotypes of leaves at four-leaf stage,bar=0.5 cm;C. The phenotypes of plants at three-leaf stage in the field;D. The phenotypes of leaf color at five-leaf stage in the field.
2 结果与分析
2.1 突变体ygl4的表型观察
与野生型相比,ygl4在2~3叶龄出现黄绿叶表型,之后略有缓解(图1)。突变体秧苗在6月中下旬移栽大田后,黄绿叶表型更明显(图2-A),生长后期(图2-B)叶片白化部位约占全叶片总面积的50%,该性状一直保持到全生育期(图2-B)。相比野生型,ygl4的株高、穗长、结实率、千粒重极显著下降,有效分蘖数、剑叶长宽、一次枝梗和二次枝梗数、每穗粒数均无明显差异(表2)。

图2 大田移栽后突变体ygl4的表型Fig.2 The phenotype of mutant ygl4 plants after transplanting into the fieldA. 移栽1周后ygl4的表型;B. 移栽12周后ygl4的表型。A. Phenotype of ygl4 in one week after transplanting into the field;B. Phenotype of ygl4 in 12 weeks after transplanting into the field.
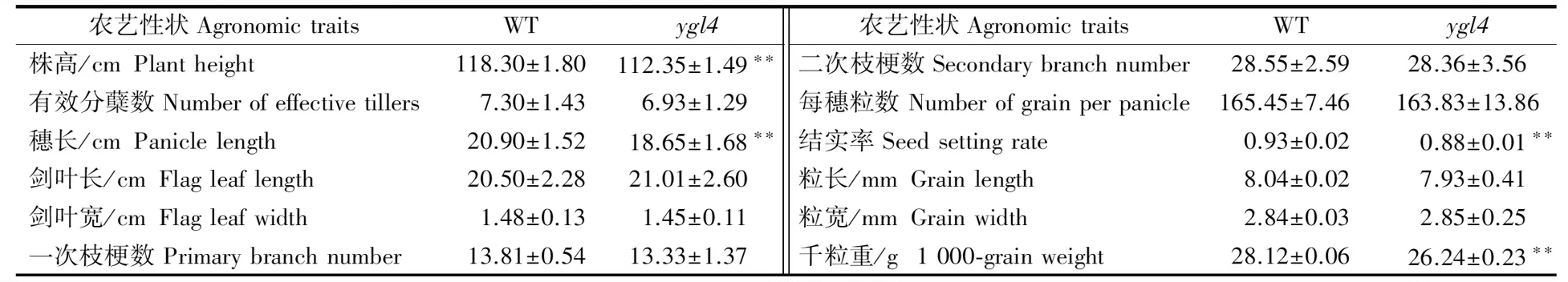
表2 WT和ygl4农艺性状比较Table 2 Agronomic trait comparison of WT and ygl4

图3 不同处理温度下WT和ygl4的表型Fig.3 The phenotypes of WT and ygl4 under different treatment temperaturesA,D. 20 ℃;B,E. 25 ℃;C,F. 30 ℃. Bar=1 cm in Fig.A,B and C;Bar=0.5 cm in Fig.D,E and F.
2.2 突变体ygl4温敏性分析
对野生型与突变体ygl4分别在20、25、30 ℃条件下进行了温敏性试验(图3),测定叶片叶绿素a、叶绿素b、类胡萝卜素含量(图4)。结果显示:突变体在20 ℃条件下黄化表型加重,且在20 ℃条件下突变体叶绿素a、叶绿素b及类胡萝卜素含量相较于野生型显著降低,而在25、30 ℃温度条件下黄化表型以及叶绿素、类胡萝卜素含量变化没有20 ℃明显,可见该基因受低温诱导,是一种低温敏感型叶色突变体。
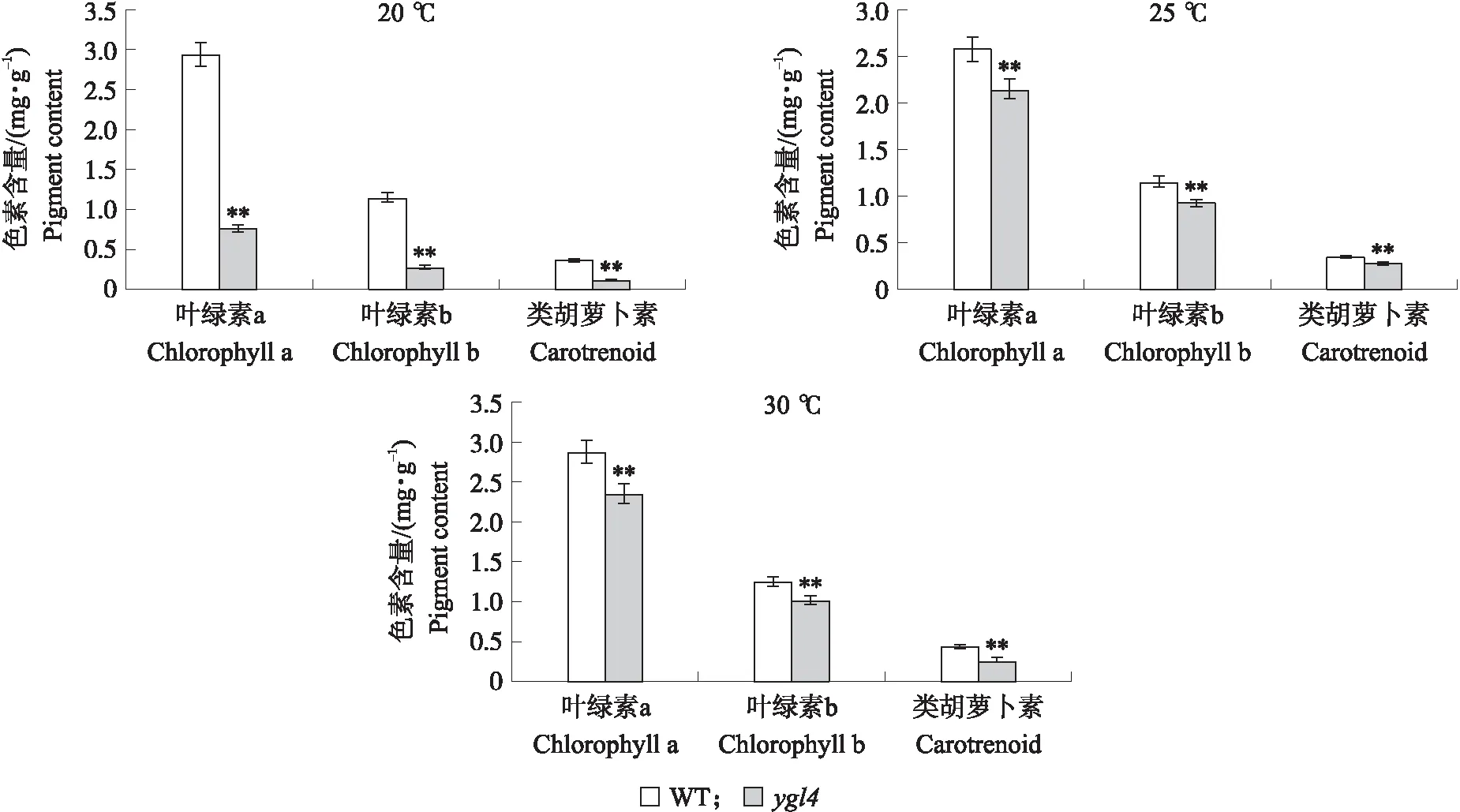
图4 不同处理温度下WT和ygl4的色素含量Fig.4 The pigment contents of WT and ygl4 under different treatment temperatures
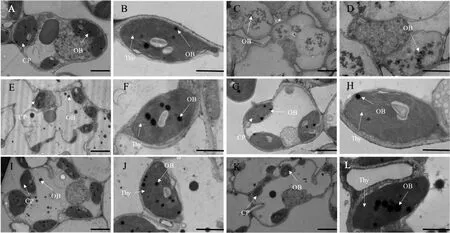
图5 WT和 ygl4 叶绿体超微结构观察Fig.5 Transmission electron microscopic observation of WT and ygl4 A—D. 野生型(A、B)正常部位对应突变体(C、D)完全白化部位叶绿体超微结构;E—H. 野生型(E、F)正常部位对应突变体(G、H)半黄化部位叶绿体超微结构;I—L. 野生型(I、J)正常部位对应突变体(K、L)正常绿色部位叶绿体超微结构。图A、C、E、G、I、K 比例尺为 2 μm;图B、D、F、H、J、L比例尺为1 μm。CP:叶绿体;Thy:类囊体片层;OB:嗜锇体。A-D. Transmission electron microscopic observation of the chloroplasts in the fully albino part of mutants(C,D)corresponding to the normal part of wild type(A,B);E-H. Transmission electron microscopic observation of the chloroplasts in the semi yellowing part of mutants(G,H)corresponding to the normal part of wild type(E,F);I-L. Transmission electron microscopic observation of the chloroplasts in the normal green part of wild-type(I,J)corresponding mutants(K,L). Bar in Fig.A,C,E,G,I and K is 2 μm;Bar in Fig.B,D,F,H,J,L is 1μm. CP:Chloroplast;Thy:Thylakoid lamellar;OB:Osmiophilic body.
2.3 突变体ygl4叶绿体超微结构观察
分别取野生型与突变体ygl4正常部位、半黄化部位(正常与白化部位过渡区)、完全白化部位,对叶绿体超微结构进行观察。结果表明,相比于野生型,ygl4完全白化部位叶片细胞叶绿体结构已完全损坏分解,并且叶片细胞内除细胞核外所有的细胞器都已被破坏(图5-A—D)。野生型与突变体半黄化部位叶片细胞叶绿体超微结构无差异(图5-E—H)。野生型与ygl4正常绿色部位叶片细胞叶绿体超微结构也基本无差异(图5-I—L)。
2.4 突变体ygl4的图位克隆
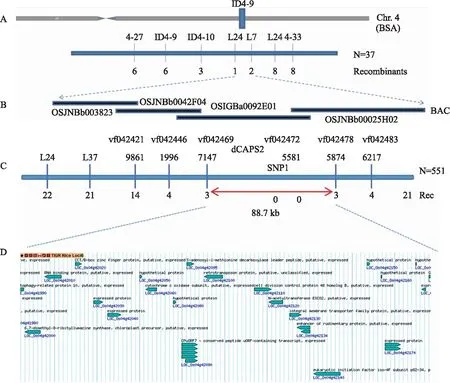
图6 ygl4的精细定位及候选基因分析Fig.6 Fine mapping and candidate gene analysis of ygl4 A. 初步定位:利用37个黄绿叶单株,将区间定位在L24与L7之间;B. 携带ygl4的细菌人工染色体(BAC);C. 精细定位:利用551个黄绿叶单株,将区间定位在VF0424697147与VF04245874之间;D. 基因预测。A. Preliminary mapping:the interval is mapped between L24 and L7 using 37 yellow-green plants;B. Bacterial artificial chromosome(BAC)harboring ygl4;C. Fine mapping:551 yellow-green plants are used to map the gene interval between VF0424697147 and VF04245874;D. Gene prediction.
2.5 YGL4蛋白序列分析
将ygl4基因序列输入NCBI(https://www.ncbi.nlm.nih.gov/)网站中查找其在其他物种中的同源基因。包括水稻(XP_015637168.1)、大麦(KAE_8767088.1)、玉米(NP_001356459.1)、高粱(OQU_91117.1)、粟(XP_004976101.1)、黍(XP_025824687.1)、大麻(XP_030507524.1)、狗尾草(XP_034604013.1)。蛋白序列比对分析(图7)表明,在N端信号肽处各种植物的氨基酸序列保守性较差,而在C端的氨基酸序列则基本相似,保守性较高。表明突变体ygl4的单个氨基酸变化发生在一个高度保守区域。

图7 YGL4同源蛋白序列比对Fig.7 Alignment of related proteins for YGL4 保守的氨基酸序列在共有序列中用红色方框标出;红色三角标出的是突变体ygl4氨基酸突变位点;比较序列分别来自水稻(XP_015637168.1)、大麦(KAE_8767088.1)、玉米(NP_001356459.1)、高粱(OQU_91117.1)、粟(XP_004976101.1)、黍(XP_025824687.1)、大麻(XP_030507524.1)、狗尾草(XP_034604013.1)。Conserved amino acid sequences are marked in red in the common sequence;The red triangulated line is the site of the ygl4 amino acid mutation;The comparison sequences are respectively from Oryza sativa(XP_015637168.1),Hordeum vulgare(KAE_8767088.1),Zea mays(NP_001356459.1),Sorghum bicolor(OQU_91117.1),Setaria italica(XP_004976101.1),Panicum hallii(XP_025824687.1),Cannabis sativa(XP_030507524.1),Setaria viridis(XP_034604013.1).

图8 在20 ℃条件下突变体ygl4外施核黄素的植株(A)和叶片(B)表型Fig.8 Phenotypes of plant(A)and leaf(B)of mutant ygl4 treated with riboflavin at 20 ℃野生型(WT)(左)、外施核黄素处理的突变体(ygl4)(中)和未处理的突变体(ygl4)(右)。比例尺为1 cm。Wild-type(WT)(left),riboflavin-treated mutant ygl4(middle),and untreated mutant ygl4(right). Bar=1 cm.
2.6 突变体ygl4外施核黄素互补分析
为了证实LS基因就是YGL4突变基因,对突变体ygl4进行外施核黄素处理,以验证核黄素水平的恢复是否能弥补突变体ygl4的叶色表型变化。从结果(图8)可以看出,外施的核黄素的突变体ygl4苗期黄绿叶表型消失,颜色变为与正常野生型一致。因此推测该LS基因就是YGL4基因。
2.7 YGL4细胞定位
利用水稻的原生质体瞬时转化系统对YGL4进行亚细胞定位检测(图9)。发现该基因定位于叶绿体,呈点状分布,并且在突变体中同样定位在叶绿体中。这与前人预测的植物核黄素合成都主要发生于叶绿体的结论一致[20]。表明其基因N端信号肽虽在各种植物中同源性较低,但功能类似,都能将该基因的表达蛋白转运到叶绿体。
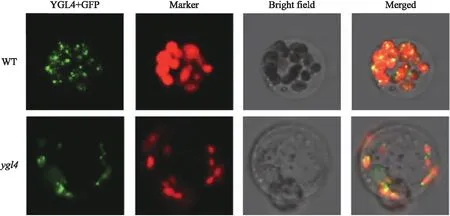
图9 YGL4亚细胞定位Fig.9 Subcellular localization of the YGL4
2.8 突变体ygl4叶绿素生物合成相关基因定量分析
从20 ℃光照培养箱中选取长势一致的3叶期野生型和突变体ygl4植株,黑暗处理3 h,再对叶片进行叶绿素生物合成相关基因定量分析(图10)。结果发现:CAO、DVR和POR等参与叶绿素合成光反应阶段的基因表达水平在ygl4中明显下调,而HEMA、HEML、HEMC、HEME、HEMF等参与叶绿素合成暗反应阶段的基因表达水平在ygl4中上调。这些结果表明突变体ygl4叶绿体发育受损与基因表达密切相关。
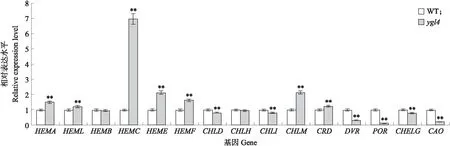
图10 WT与ygl4中叶绿素生物合成相关基因定量分析Fig.10 Quantitative analysis of genes associated with chlorophyll biogenesis in WT and ygl4 HEMA:谷氨酰t-RNA还原酶基因 Glutamyl t-RNA reductase gene;HEML:谷氨酸-1-半醛转氨酶基因Glutamate-1-semialdehyde-2,1-aminomutase gene;HEMB:胆色素原合酶基因 Porphobilinogen synthase gene;HEMC:羟甲基后胆色素原合酶基因 Hydroxymethylbilane synthase gene;HEME:尿卟啉原脱羧酶基因 Uroporphyrinogen Ⅲ decarboxylase gene;HEMF:粪卟啉原氧化脱羧酶基因 Coproporphyrinogen Ⅲ oxidase gene;CHLH:镁螯合酶H亚基基因 Mg-chelatase subunit H gene;CHLI:镁螯合酶Ⅰ亚基基因Mg-chelatase subunitⅠgene;CHLM:镁原卟啉IX甲基转移酶基因Mg-protoporphyrin Ⅸ methyltransferase gene;CRD:镁原卟啉原IX单甲酯环化酶基因Mg-protoporphyrin Ⅸ monomethyl ester(oxidative)cyclase gene;DVR:二乙烯基还原酶基因Divinyl reductase gene;POR:原叶绿素酸氧化还原酶基因 Protochlorophyllide oxidoreductase gene;CHELG绿素合酶G亚基基因 Mg-chelatase subunit G gene;CAO:叶绿素a氧化酶基因Chlorophyll a oxygenase gene.
3 讨论
ygl4是一个低温诱导突变体,在20 ℃培养箱中呈黄绿色,在25和30 ℃时与野生型相似,叶绿素含量仅在20 ℃时表现不同。在稻田生长环境下,ygl4在2~3叶龄时表现出不规则的黄绿色叶片症状,叶片严重部位表现出白化表型,突变性状在整个生育期都能保持,直到种子成熟。缺乏铁氧还蛋白-NADP(H)还原酶的烟草植株由于系统PET链被破坏和光合氧化还原的不平衡,表现出黄绿色表型[21]。因此,突变体在野外比在培养箱中更严重的白化表型可能是由光氧化作用造成的。
图位克隆YGL4基因结果表明其编码6,7-二甲基-8-核糖醇基二氧四氢蝶啶合酶(LS)。LS催化植物、真菌和微生物中核黄素(维生素B2)生物合成的倒数第2步[22],它是核黄素合成途径的关键成分。核黄素是核黄素单磷酸和黄素腺嘌呤二核苷酸辅酶的前体,核黄素途径产生的黄酮酶被发现在所有细胞中都是不可缺少的氧化还原辅助因子,如在DNA光修复、光敏感和生物发光等多种途径发挥作用[23]。由于核黄素途径对多种重要的细胞过程是必不可少的,完全消除核黄素途径将导致营养缺陷表型,并可能影响植物的生长。在突变体ygl4中,突变蛋白中的氨基酸替换减弱了核黄素的合成,但并没有完全破坏这一途径,结果验证了这一结论。
YGL4亚细胞定位于叶绿体内,呈现点状分布。由于其点状分布的不均匀性,猜测其精细定位在叶绿体的内囊体中。透射电镜观察的结果显示突变体ygl4叶色变化的可能机制是提前衰老,因此推测YGL4基因导致叶色变化的可能机制是突变体中LS基因表达异常,致使体内核黄素含量下降,导致ALA在黑暗环境下异常持续合成所带来的原叶绿素酸酯过多积累,使细胞受损、衰老及叶绿体提前降解,从而导致叶色变黄,甚至白化。
水稻作为单子叶模式植物,通常为其他作物基因功能研究提供借鉴。本文在水稻中发现LS基因和叶绿体发育密切相关,但该基因在其他单子叶植物中的作用仍有待进一步研究。
致谢:农业部长江中下游粳稻生物学与遗传育种重点实验室、长江流域杂交水稻协同创新中心、现代作物生产省部共建协同创新中心、江苏南京水稻种质资源国家野外科学观测研究站、南方粳稻研究院(公司)给予本研究支持,谨致谢意。

