基于网络药理学探讨苦参治疗增生性瘢痕的作用机制*
张琳竺,曾睿,黄楚渝,贾超
1.广州中医药大学,广东 广州 510405; 2.广州中医药大学第一附属医院,广东 广州 510405
增生性瘢痕(hypertrophic scar,HS)属于病理性瘢痕,是在机体所受创伤异常愈合后出现的局部外观损伤,甚者机体功能受到严重限制的病理现象,临床表现为增生组织表面潮红甚至紫红,质地变硬,可伴不同程度的瘙痒,严重时会出现水泡和瘢痕溃疡[1]。HS目前的治疗手段多以手术切除为主,但复发率高,给患者带来痛苦[2]。
苦参(SophoraflavescensAit.)性寒,味苦,属于豆科植物,有清热燥湿、杀虫、利尿的功效[3]。研究表明,苦参类生物碱作为苦参的主要活性成分,可以使瘢痕显著缩小,可能是通过影响相关调控蛋白的表达,干扰病理性瘢痕成纤维细胞的增殖和凋亡等过程,其中苦参碱和苦参素有抑制纤维化、肿瘤细胞、细菌以及病毒生长增殖的作用[4-6]。
网络药理学能够从整体探索疾病和药物之间的关联,与中医的整体观念相符,并融合了多学科的技术和内容,通过研究中药活性成分的靶点和作用机制,以及从分子生物学角度构建药物和疾病相关联的网络,使中药作用特点更鲜明,有利于中医药走向世界,也为中药的临床新运用及深入研究提供参考[7-8]。苦参治疗HS的具体作用机制尚待进一步研究,本文拟通过网络药理学的方法分析苦参治疗HS的作用机制,以期为苦参治疗HS的临床应用和药物研发提供依据和参考。
1 资料与方法
1.1 苦参主要有效成分及其相关靶点的获取本研究以“苦参”为检索词在中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)获取苦参的化学成分,并以类药性(drug-likeness,DL)≥0.18作为筛选条件对所获取化合物进行筛选,得到苦参的有效成分,剔除未被PubChem收录或无法在中国知网、pubmed中检索的部分[9]。运用TCMSP对得到的活性成分进行靶点预测,未查找到靶点的有效成分保存为mol2格式,上传至PharmMapper平台二次查找,将两个平台的结果合并[10]。通过Uniprot数据库规范化处理靶点基因名,选择条件为已验证的、来源于人类的去重后得到苦参的相关靶点[11]。
1.2 增生性瘢痕相关靶点的获取在OMIM数据库和Genecards数据库中输入“hypertrophic scar”,检索与HS相关的疾病靶点,并通过Microsoft Excel软件进行合并去重后得到HS相关的疾病靶点[12]。运用Venny平台将苦参的候选靶点与HS相关的疾病靶点导入后取交集,得到二者的交集靶点。
1.3 中药-有效成分-靶点网络构建将1.1项下所得的苦参靶点,以Excel文件格式分别定义数据和属性文件并导入Cytoscape3.7.2软件中进行数据可视化处理,得到苦参-有效成分-靶点图[13]。
1.4 构建蛋白质与蛋白质相互作用(protein-protein interaction,PPI)网络在STRING数据库中导入1.2项下所得苦参治疗HS的交集靶点,选择人类物种(homo sapiens)选项,绘制蛋白质相互作用网络(protein-protein interaction,PPI)。检索研究相关文献,为确保可信度,将交互分数限定为>0.4,去除游离的单一蛋白,采用Cytoscape 3.7.2软件将其可视化[14]。运用CytoNCA插件根据靶点自由度中心性(degree centrality,DC)对交集网络进行拓扑学参数分析和筛选,以DC大于中位数为条件筛选出核心靶点。
1.5 基因本体功能注释(gene ontology,GO)生物过程和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析将1.4项下PPI网络筛选出的核心靶点导入Metascape平台进行富集分析,探究苦参治疗HS的主要生物学机制。选择物种为人类(Sapiens),设置P<0.01,对导入靶点进行KEGG通路分析和GO注释,并将结果以气泡图的形式可视化[15]。根据现有文献研究筛选出苦参治疗HS关联性强的通路以及富集在通路上的靶点,结合预测有效成分,构建苦参“成分-靶点-通路”网络。
2 结果
2.1 苦参的主要有效成分及潜在靶点采用TCMSP、PharmMapper平台共检索出苦参活性成分90个,对应靶点297个(去重后),得到的靶点信息根据Uniprot进行名称标准化。使用韦恩图处理检索所得苦参的90个活性成分所对应的靶点和疾病靶点,筛选出交集靶点数目>6的活性成分作为预测有效成分。此外,苦参部分有效成分已被证实对HS有显著作用,故也纳入其中,此处列举预测有效成分共26个,见表1。

表1 苦参的预测有效成分
2.2 HS靶点及药物-疾病交集靶点的获取通过OMIM和Genecards数据库共找到HS相关靶点 1 246 个,通过Uniprot平台将靶点名称标准化。通过Venny 2.1将297个苦参靶点和1 246个HS靶点进行处理,以获取交集靶点118个,见图1。
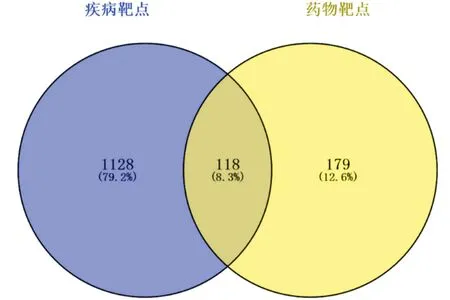
图1 苦参与HS共同作用靶点韦恩图
2.3 构建苦参-有效成分-靶点网络将2.1项下检索出的90个药物活性成分与297个潜在靶点以Excel文件格式分别定义数据和属性文件,在 Cytoscape 3.7.2软件中绘制苦参-有效成分-靶点网络图,其中圆形代表苦参有效成分,正方形代表其作用的靶点,共得到369个节点,1 076条边,见图2。以度值≥8为条件得到前34项,见表2。
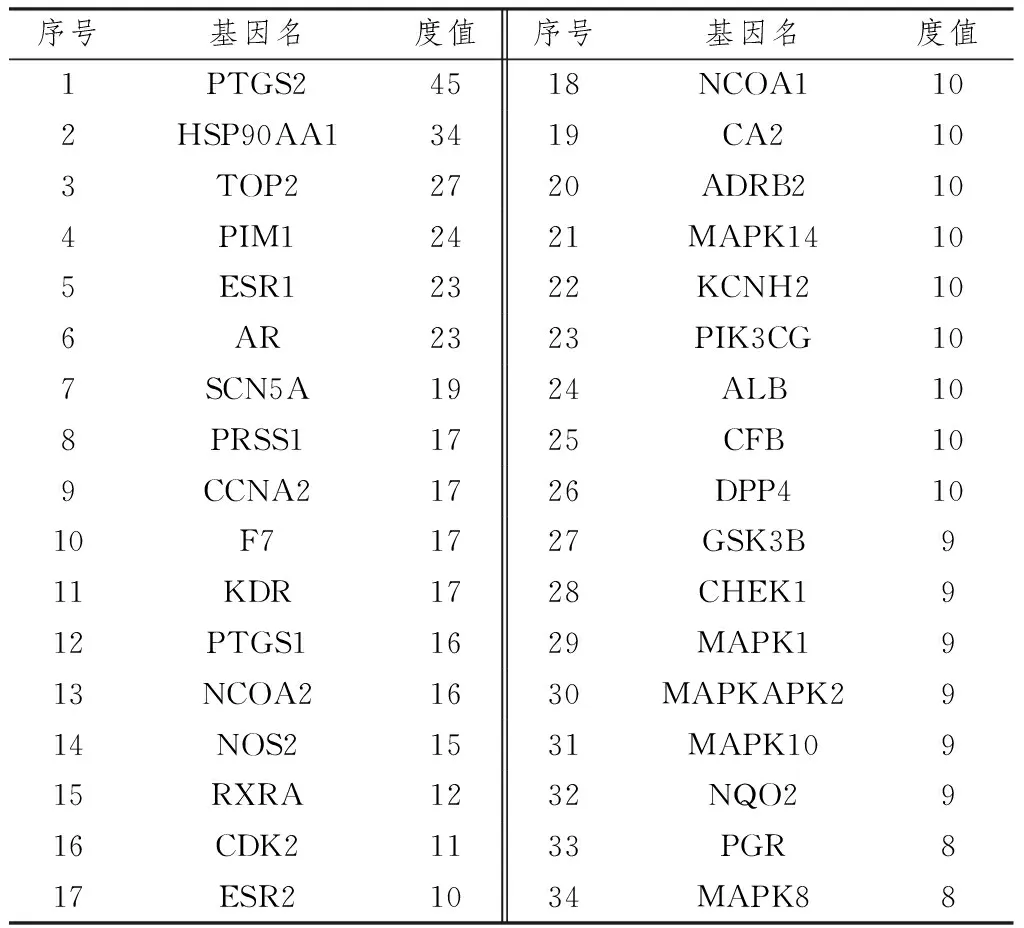
表2 度值≥8的前34个靶点
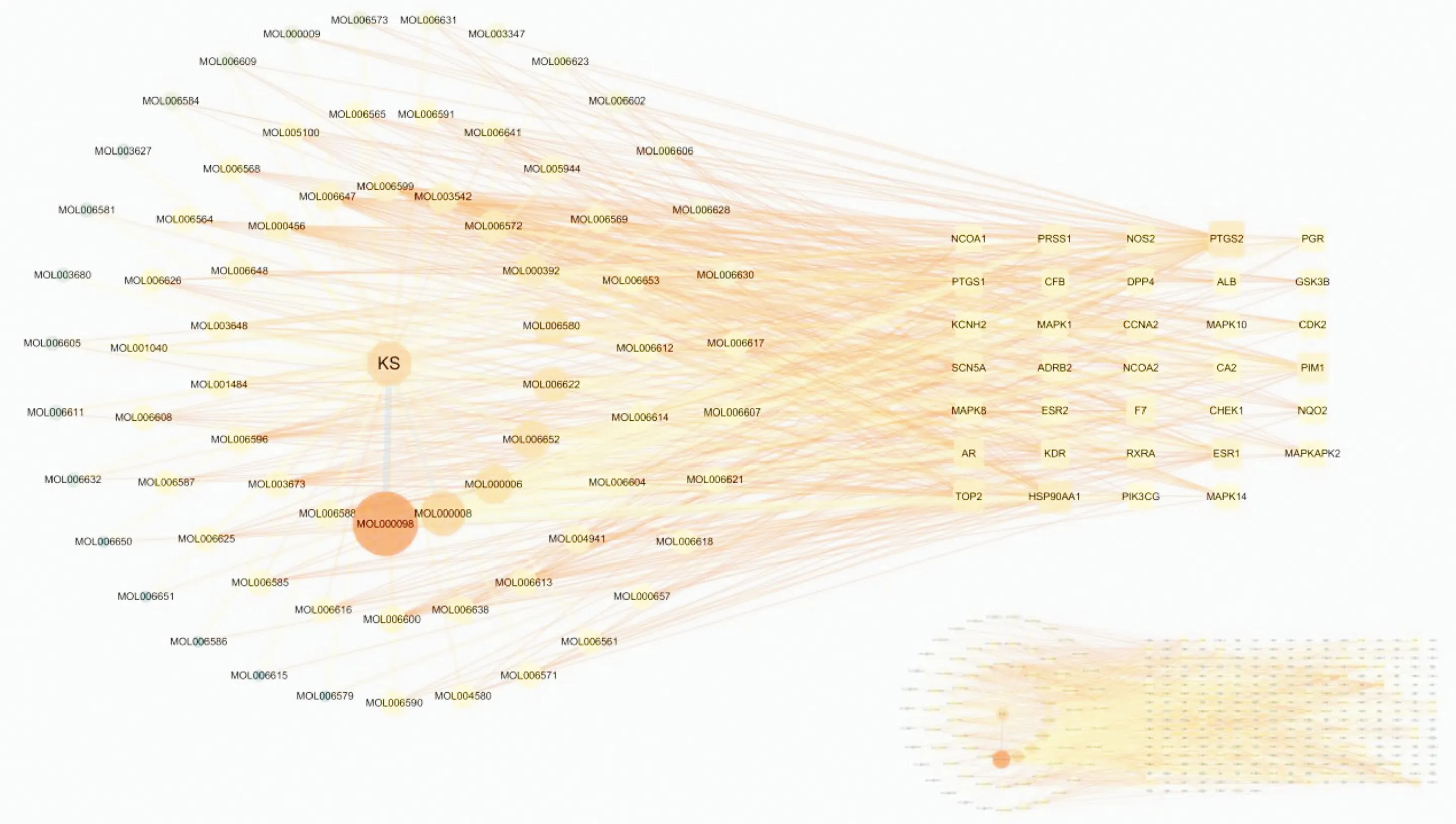
图2 苦参-有效成分-靶点网络图
2.4 构建PPI网络将2.2项下所得苦参与HS的118个交叉靶点导入STRING数据库获取PPI网络图,并将所得网络图导入Cytoscape 3.7.2软件可视化处理,如图3所示,度值越大,网络中相应的节点尺寸越大、颜色越深。筛选共得到59个核心靶点(DC>49)。与其余靶点相互作用比较多的靶点称为高频靶点(度值≥94),包括白细胞介素-6(interleukin-6,IL-6)、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、RAC-α丝氨酸/苏氨酸蛋白激酶(RAC-alpha serine/threonine-protein kinase,AKT1)、肿瘤坏死因子(tumor necrosis factor,TNF)、胰岛素(insulin,INS)、血清白蛋白(serum albumin,ALB)、细胞肿瘤抗原p53(cellular tumor antigen p53,TP53)。
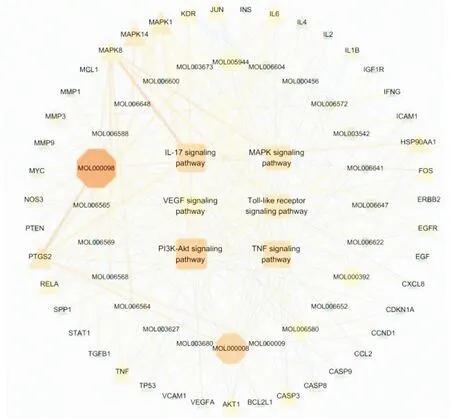
图3 苦参治疗HS的靶蛋白PPI网络图
2.5 GO生物过程和 KEGG通路富集分析通过Metascape平台将2.4项下PPI网络筛选出的59个核心靶点进行富集分析并将结果可视化,见图4。由图可知,苦参的多个靶点与HS有着较为密切的关系。分子功能(molecular function,MF)(图4-A)主要涉及细胞因子受体结合、蛋白激酶结合等;生物过程(biological process,BP)(图4-B)中主要包括细胞凋亡信号通路、细胞对炎症刺激、化学刺激的调节等;细胞组成(celluar component,CC)(图4-C)中靠前的有膜筏、细胞外基质等。KEGG 通路分析(图4-D)显示,苦参治疗HS的靶点主要涉及的通路为磷脂酰肌醇3-激酶-丝/苏氨酸激酶信号通路(PI3K-Akt signaling pathway)、促分裂原活化的蛋白激酶信号通路(MAPK signaling pathway)、Toll样受体信号通路(Toll-like receptor signaling pathway)、肿瘤坏死因子信号通路(TNF signaling pathway)、白细胞介素-17信号通路(IL-17 signaling pathway)、血管内皮生长因子信号通路(VEGF signaling pathway)等。

图4 苦参作用靶点GO富集分析(图4-A、图4-B、图4-C)和KEGG富集分析(图4-D)的前20条通路气泡图
2.6 苦参“成分-靶点-通路”的构建将26个预测有效成分、作用靶点及6个主要通路导入Cytoscape 3.7.2软件进行可视化操作,见图5。中间正方形节点代表作用通路,正八边形代表苦参有效成分,最外围三角形代表作用靶点。成分、靶点、通路之间皆有一条或多条边与其余节点相联,其中度值越大,节点越大,颜色越深。结果显示,槲皮素(quercetin)、芹菜素(apigenin)、芒柄花黄素(formononetin)、苦参碱(matrine)等有效成分的度值较大,考虑为苦参治疗HS的核心活性成分。
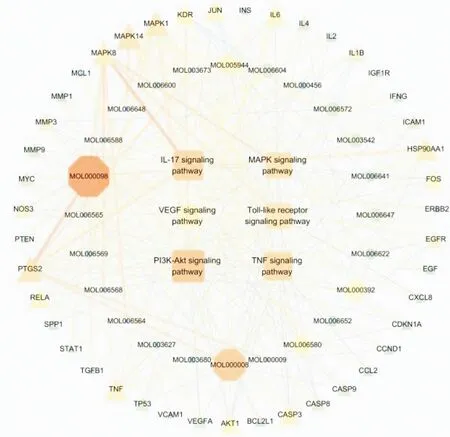
图5 苦参“活性成分-靶点-通路”网络
3 讨论
本研究筛选得到苦参活性成分90个,靶点297个,HS的相关靶点共1 246个,映射后得到苦参作用于HS的潜在靶点118个。苦参的活性成分槲皮素、芹菜素、木樨草素、芒柄花黄素、苦参碱等对应了多个疾病靶点,预测为苦参治疗HS的核心有效成分。槲皮素和芹菜素对HS成纤维细胞的生长和迁移有抑制作用,主要通过抑制Src信号通路和FAK信号通路来实现[16-18]。木樨草素能够抑制炎症因子CRP、VEGF、JNK2和p38的表达,进而抑制MAPK通路,改善瘢痕组织的形成[19]。Bcl-2因子可以抑制细胞凋亡,MTT试验结果显示,芒柄花黄素对HS成纤维细胞增殖的抑制作用呈剂量和时间依赖性,是通过抑制Cyclin D1表达阻滞人HS成纤维细胞的细胞周期于G1/S期,并下调Bcl-2以促进细胞凋亡[20-21]。苦参碱通过调控RPS5/p38信号通路对成纤维细胞的增殖、迁移和分化等过程产生抑制,并抑制p38 MAPK的表达和磷酸化,从而发挥抗炎、延缓病理性瘢痕纤维化进程的作用[22-23]。苦参的有效成分如槐果碱可抑制MAPK和NF-κB信号通路,降低炎症因子水平[24-25],(-)-14β-羟基苦参碱通过抑制细胞炎症因子的释放发挥抗炎作用[26]。综上所述,苦参可以通过多个有效成分、多个靶点对HS产生影响。
本研究发现苦参对HS发挥治疗作用的关键靶点节点有IL-6、VEGFA、AKT1、TNF、INS、ALB和TP53等。瘢痕长期以来被认为是一种慢性炎症反应[27-28]。Chawla的体外瘢痕模型表明,IL-6升高这一HS标志性过程会导致基质的过度合成和稳态的扰动[29],瘢痕组织中IL-6、IL-8等促炎因子升高会引起成纤维细胞的过度增殖与异常分化,导致炎症反应加剧[30-31]。HS中成纤维细胞的生物学变化可能受VEGF表达的增加影响。研究发现,苦参碱抑制血管生成与VEGFA参与的细胞凋亡有一定关联性[32]。晚期的TP53基因中一个染色体位点基因被认为与瘢痕形成相关[33]。研究发现,TNF-α、IL-6在HS形成过程0~2 d的mRNA水平升高,而后2~7 d再下降[34]。TNF-α可减少瘢痕皮肤中的成纤维细胞数量,抑制其产生的平滑肌肌动蛋白的表达,验证了本研究获得的结果[35]。调节PI3K/AkT1/NFκB信号通路也可实现对炎症反应的抑制[36-37]。本研究发现,INS、ALB也是苦参作用的关键靶点,但关于苦参通过调控两者作用于HS的研究近期尚未见报道,可对其深入研究。由此可见,IL-6、VEGFA、TNF、TP53、AkT1等关键靶点所调控的炎症反应过程、细胞凋亡途径以及成纤维细胞功能等,可能是苦参对增生性瘢痕的介导作用机制。
GO分析结果显示,苦参治疗HS主要涉及细胞凋亡、细胞对外刺激的反应等,涉及细胞膜、细胞外基质等。KEGG富集通路分析结果显示,关键基因主要富集于MAPK信号通路、Toll样受体信号通路、PI3K/Akt信号通路等。MAPK信号通路被多种细胞外信号激活后,可以对细胞增殖、分化和凋亡等过程进行调控,当MAPK信号转导通路被激活后,迅速转位至细胞核,进一步应答,促进细胞增殖和生长[38]。ERK/MAPK信号通路能够在多种细胞异常增殖类疾病中发挥重要作用[39],在生长活跃的增殖期瘢痕中ERK1和ERK2基因表达相比于正常皮肤显著增高[40]。在增生性瘢痕中p44/42MAPK信号分子活化程度较正常皮肤高,p44/42MAPK通路的激活可刺激真皮成纤维细胞的生长[41]。体内外实验证实胶原沉积和瘢痕形成的减少与抑制P38/MAPK信号转导通路相关[42]。在增生性瘢痕成纤维细胞中,Toll样受体4(Toll like receptor-4,TLR-4)的表达高于正常皮肤成纤维细胞,且细胞内信号通路被激活[43],提示在创伤愈合过程中,Toll样受体信号通路的高表达可能促进了增生性瘢痕的形成。PI3K/Akt信号转导通路由酶联受体所介导。体外培养人HS成纤维细胞中PI3K在蛋白质和mRNA水平的表达高于其在正常皮肤成纤维细胞中的表达[44],PI3K/Akt信号通路通过介导结缔组织生长因子实现对人体HS成纤维细胞增殖以及凋亡过程的调节[45]。皮肤成纤维细胞表面有大量 IL-17 受体表达,IL-17通路的活化可诱导特定亚型巨噬细胞浸润,从而加重纤维化[46-47]。局部炎症可刺激瘢痕形成,通过下调IL-17通路的转录活性抑制炎症细胞的产生从而延缓HS进程[48]。
本研究通过网络药理学发现苦参介导HS生成的核心有效成分为槲皮素、芹菜素、木樨草素、芒柄花黄素、苦参碱等,主要作用于IL-6、VEGFA、AKT1、TNF等潜在靶点,及MAPK、Toll样受体、PI3K/Akt、IL-17等信号通路,体现出中药发挥药理作用时在“组分-靶标-通路”网络上的相对多样性[49]。考虑到市面上治疗HS的中药制剂以外用方法为主[50],故本研究在筛选苦参有效成分时未将口服利用度纳入筛选标准,研究结果与单纯口服用药可能存在一定偏差。本研究为苦参外用治疗HS提供了新的思路,后期可在本研究基础上进一步进行实验研究,以探明苦参对HS的具体治疗机制,为老药新用及新药研发奠定基础。

