基于网络药理学分析苓桂术甘汤治疗眩晕病的潜在作用机制*
曹政华,刘寅,孙莉
1.长春中医药大学,吉林 长春 130117; 2.吉林省中医药科学院第一临床医院,吉林 长春 130021
眩晕是指以头晕目眩为主症的一种疾病,眩是指眼花或眼前发黑,晕是指头晕甚或感觉自身或外界景物旋转[1]。眩晕的发病率很高,美国成人头晕及平衡障碍的年患病人数超过3 300万,年患病率为14.8%[2]。中医药治疗眩晕病历史悠久,具有独特的见解和优势,尤其在改善症状方面具有巨大潜力。苓桂术甘汤出自《伤寒论》,现代药理学研究认为其对β淀粉样蛋白沉积以及由此引发的神经细胞炎症具有良好的改善作用,具有调控脂质代谢和胰岛素抵抗、保护心肌细胞和调节水液代谢的药理作用[3],但缺乏苓桂术甘汤全面的药理作用机制总结,导致对其治疗眩晕病的作用机制尚不明确。本研究采用网络药理学构建苓桂术甘汤的“药物-成分-靶点-疾病”多层次网络图,从苓桂术甘汤整体出发,探索其对眩晕病的有效活性成分、潜在靶点和作用机制,为进一步研究治疗眩晕病的作用机制提供一定理论依据。
1 材料与方法
1.1 苓桂术甘汤相关靶点的筛选借助中药系统药理学数据库和分析平台(traditional Chinese medicine systems pharmacology,TCMSP,https://old.tcmsp.com/tcmsp.php),对苓桂术甘汤中的“茯苓”“桂枝”“白术”和“甘草”的活性成分以口服利用度(oral bioavailability,OB)>30%、类药性(drug-likeness,DL)>0.18为标准进行筛选以获得活性化合物及其作用的蛋白质靶点,并对其进行整理筛选。对整理的苓桂术甘汤有效活性成分所涉及的蛋白质靶点,统一通过蛋白质数据库(universal protein,UniProt)(www.uniprot.org)进行规范化命名,使用Swiss Target Prediction数据库对靶点信息进行补充去重。
1.2 苓桂术甘汤有效活性成分及其靶点网络的构建根据得到的苓桂术甘汤的有效活性成分及其蛋白质预测靶点,采用Cytoscape_v3.7.2软件,构建苓桂术甘汤有效活性成分潜在靶点网络。
1.3 眩晕病相关靶点的筛选以“vertigo disease”“dizziness”“giddy”等与眩晕病相关的关键词,通过Genecards数据库(www.genecards.org)和在线人类孟德尔遗传数据库(oneline mendelian inheritance in man,OMIM)(www.omim.org)搜索眩晕病的相关靶点,并通过DRUGBANK数据库(www.drugbank.ca)对其相关靶点进行补充。在Genecards数据库中,Score值越高代表其与疾病的联系越密切。根据经验,若靶点过多,对Score值取中位数进行筛选,根据实际情况可继续取中位数进行筛选潜在靶点,合并3个疾病数据库,并对其重复靶点进行剔除后得到眩晕病的相关靶点。
1.4 苓桂术甘汤-眩晕病共同靶点的筛选在Venny2.1在线作图软件作图工具平台(bioinfogp.cnb.csic.es/tools/venny)中分别录入苓桂术甘汤与眩晕病的靶点,并绘制韦恩图,得到苓桂术甘汤与眩晕病的共同靶点。
1.5 苓桂术甘汤-眩晕病共同靶点蛋白质相互作用(protein-protein interaction,PPI)网络的构建将其所得到的共同靶点输入STRING11.0数据库(string-db.org)中进行搜索,将物种设置为“Homo sapiens”,并把minimum required interaction score设置成大于0.4,其余设置为默认,构建其共同靶点的PPI网络。将PPI网络数据导入Cytoscape_v3.7.2软件中使其结果可视化,根据Degree值筛选出核心靶点,并构建其核心靶点的网络图。
1.6 构建“药物-成分-靶点-疾病”网络图将数据导入Cytoscape_v3.7.2软件中,构建“苓桂术甘汤-成分-靶点-眩晕病”网络图,并对其网络图进行可视化分析。
1.7 苓桂术甘汤-眩晕病共同靶点的通路分析将其共同靶点录入到Metascape平台(metascape.org),设置P<0.01,进行基因本体(gene ontology,GO)功能富集分析、京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,并筛选出排名前20位的生物过程(biological process,BP)和信号通路,绘制条形图和气泡图。
1.8 分子对接验证将获取的部分核心基因通过PDB数据库下载结构,去除水分子和小分子配体,与其对应的化合物使用AutoDock Vina软件进行分子对接,使用Pymol软件进行可视化绘图。
1.9 核心基因在大脑组织中的分布通过HPA数据库(www.proteinatlas.org/)对其核心基因进行免疫组织化学数据收集,确定核心基因在人体大脑组织分布情况。
2 结果
2.1 苓桂术甘汤的活性成分及靶点以0B>30%和DL>0.18为条件筛选白术的活性成分7种,茯苓的活性成分15种,桂枝的活性成分7种,甘草的活性成分92种,桂枝与甘草共有活性成分1种,苓桂术甘汤的有效活性成分共有将活性成分120种(图1)。再选择“Related Targets”,筛选出苓桂术甘汤的有效活性成分及所对应的靶点,其中白术有效活性成分4种,茯苓有效活性成分6种,桂枝有效活性成分6种,甘草有效活性成分88种。共预测靶点 1 896 个,白术预测靶点23个,茯苓预测靶点30个,桂枝预测靶点74个,甘草预测靶点 1 769 个,经过剔除重复靶点后一共得到249个预测靶点,记录各个有效活性成分的靶点数目,其中甘草取靶点数目较多的前10位的有效活性成分(表1)。对应的靶点输入UniProt数据库,并使用Swiss Target Prediction数据库对靶点信息进行补充,删除去重,共筛选出212个药物靶点。

图1 苓桂术甘汤活性成分分布
2.2 苓桂术甘汤的活性成分及预测靶点网络的构建通过分析得知苓桂术甘汤共有靶点212个(去重之后),其中桂枝和甘草共有靶点1个(表1),构建苓桂术甘汤有效活性成分靶点网络(图2),包含319个结点,1 592条边。
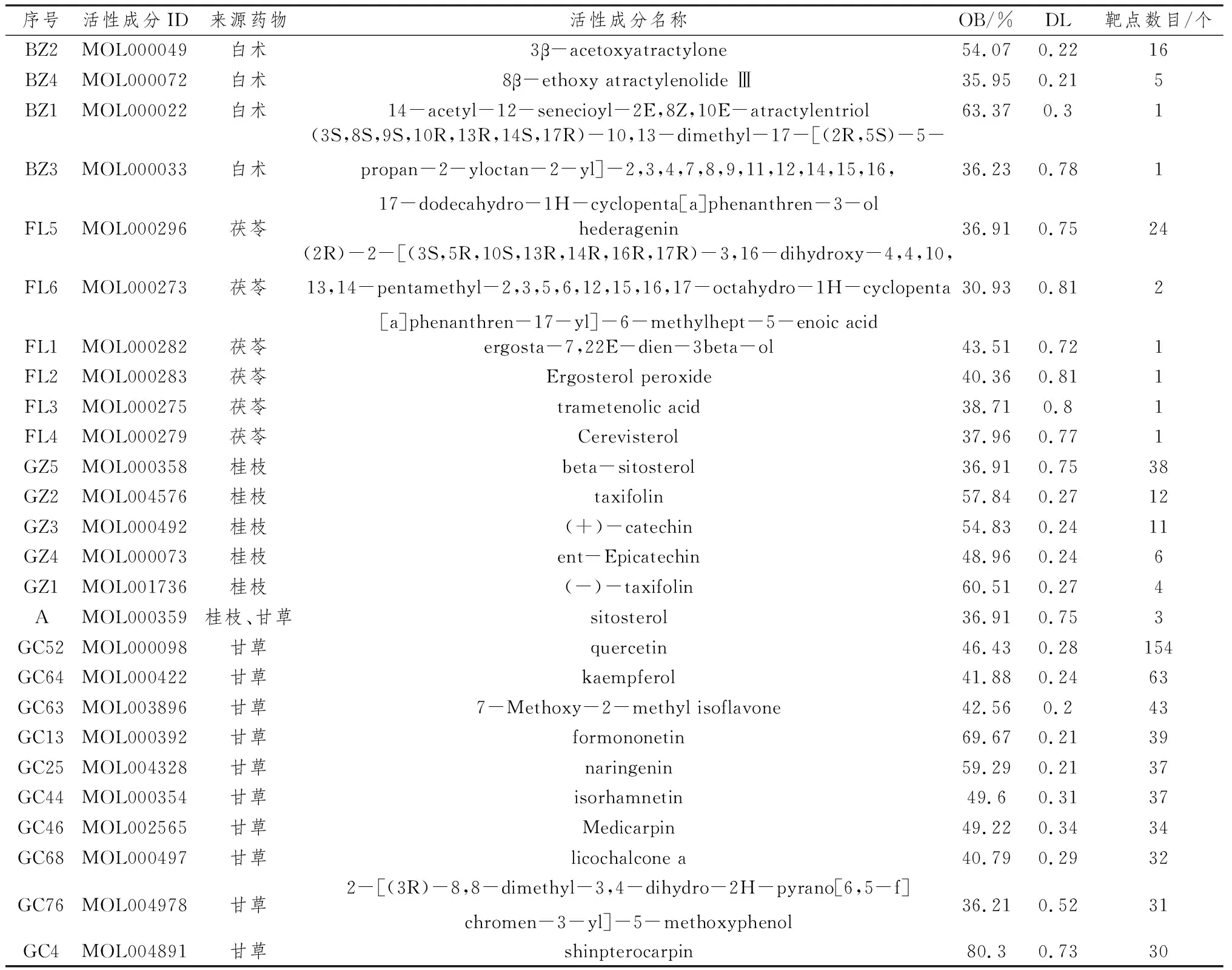
表1 苓桂术甘汤有效活性成分的部分基本信息

注:黄色是苓桂术甘汤的药物,浅蓝色是白术的有效活性成分,蓝色是茯苓的有效活性成分,淡紫色是甘草的有效活性成分,紫色是桂枝的活性成分,红色是桂枝和甘草共有的活性成分,桃红色是其靶点。图案大小不同代表不同的节点度值,图案越大度值越大;透明度渐变也表示不同的节点度值,颜色越深,度值越大
2.3 疾病相关靶点的筛选从Genecards数据库获得“dizziness”靶点4 959个,“vertigo”靶点4 732个,“giddy”靶点59个。根据经验Score大于中位数的目标靶点为眩晕病的潜在靶点,如通过Genecards所得到的“dizziness”靶点Score最大值为80.85,最小值为0.18,中位数为8.31,根据既往经验及靶点数目,需再取一次中位数,第2次中位数为14.54,故设定Score>14.54的靶点为“dizziness”的潜在靶点。结合OMIM数据库获得的“dizziness”靶点526个,“vertigo”靶点537个,“giddy”靶点534个;同时结合DRUGBANK数据库补充相关靶点,对其数据进行合并删除重复值,最终得到1 776个眩晕病相关靶点。
2.4 苓桂术甘汤-疾病共同靶点的获取在Venny2.1在线软件作图工具平台上输入212个药物靶点、1 776个疾病靶点,绘制韦恩图,两者取交集后获得药物-疾病共同靶点114个(图3)。

图3 苓桂术甘汤-眩晕病共同靶标韦恩图
2.5 苓桂术甘汤-眩晕病共同靶点PPI网络的构建将苓桂术甘汤-眩晕病114个共同靶点录入STRING数据库中,将物种设置为人,取中置信度0.400,得到了苓桂术甘汤-眩晕病共同靶点的PPI网络(图4),共得到114个结点,2 115条边,平均节点度37.1。将得到的PPI网络数据导入Cytoscape_v3.7.2软件中,以degree>34为条件,得到苓桂术甘汤治疗疾病的核心靶点网络图(图5)。其中degree排名前10位依次为白细胞介素-6(interleukin-6,IL-6)、RAC-α丝氨酸/苏氨酸蛋白激酶(AKT1)、肿瘤坏死因子(TNF)、血管内皮生长因子A(VEGFA)、细胞肿瘤抗原p53(TP53)、半胱天冬酶3(CASP3)、表皮生长因子(EGF)、转录因子AP-1(JUN)、基质金属蛋白酶9(MMP-9)、前列腺素G/H合酶2(PTGS2),说明以上靶点在苓桂术甘汤治疗眩晕病中起到关键作用,其中degree值最高的前10关键靶点,见表2。

图4 苓桂术甘汤-眩晕病共同靶点的PPI网络

注:以Degree的度进行排序,颜色越深,形状越大,其度值越大

表2 度值最高前10的苓桂术甘汤和眩晕病关键靶点信息
2.6 构建“药物-成分-靶点-疾病”网络图采用Cytoscape_v3.7.2软件构建“苓桂术甘汤-成分-靶点-眩晕病”网络图(图6),图中共有213个结点,其中苓桂术甘汤活性成分97个。根据degree值筛选,其中MOL000098(quercetin/槲皮素)、MOL000422(kaempferol/山柰酚)、MOL000392(formononetin/刺芒柄花素),其度值分别是178、62、36,说明以上活性成分在苓桂术甘汤治疗眩晕病中起到较为重要的作用。

注:绿色是苓桂术甘汤的有效活性成分,红色代表着靶点,黄色代表着苓桂术甘汤,紫色代表着眩晕病
2.7 GO功能富集分析对苓桂术甘汤治疗眩晕病的114个关键靶点进行GO功能富集分析,其中GO BP富集分析结果为2 031个,主要富集于对无机物的反应、活性氧代谢过程、对脂多糖的反应、对受伤的反应、积极调节细胞运动、凋亡信号通路、对氧气水平的反应、DNA结合转录因子活性的调节、对细胞外刺激的反应、细胞分化的负调控等。
GO细胞组分(cell composition,CC)分析结果为93个,主要富集于对膜筏、质膜蛋白复合物、细胞外基质、膜面、细胞质的核周区域、空泡、细胞体、细胞的顶端部分、黏着斑、早期内体等。
GO分子功能(molecular function,MF)富集分析结果为151个,主要富集于转录因子结合、细胞因子受体结合、泛素样蛋白连接酶结合、蛋白激酶结合、蛋白酶结合、血红素结合、丝氨酸水解酶活性、磷酸酶结合、蛋白质异二聚活性等。
苓桂术甘汤治疗眩晕病关键靶点的GO功能富集分析(图7)。分别对GO功能富集分析的GO BP、GO CC和GO MF富集分析做出前20条信号通路气泡图(图8、图9、图10)。

图7 关键靶点的GO功能富集分析条形图

图8 GO BP前20条信号通路气泡图

图9 GO CC前20条信号通路气泡图
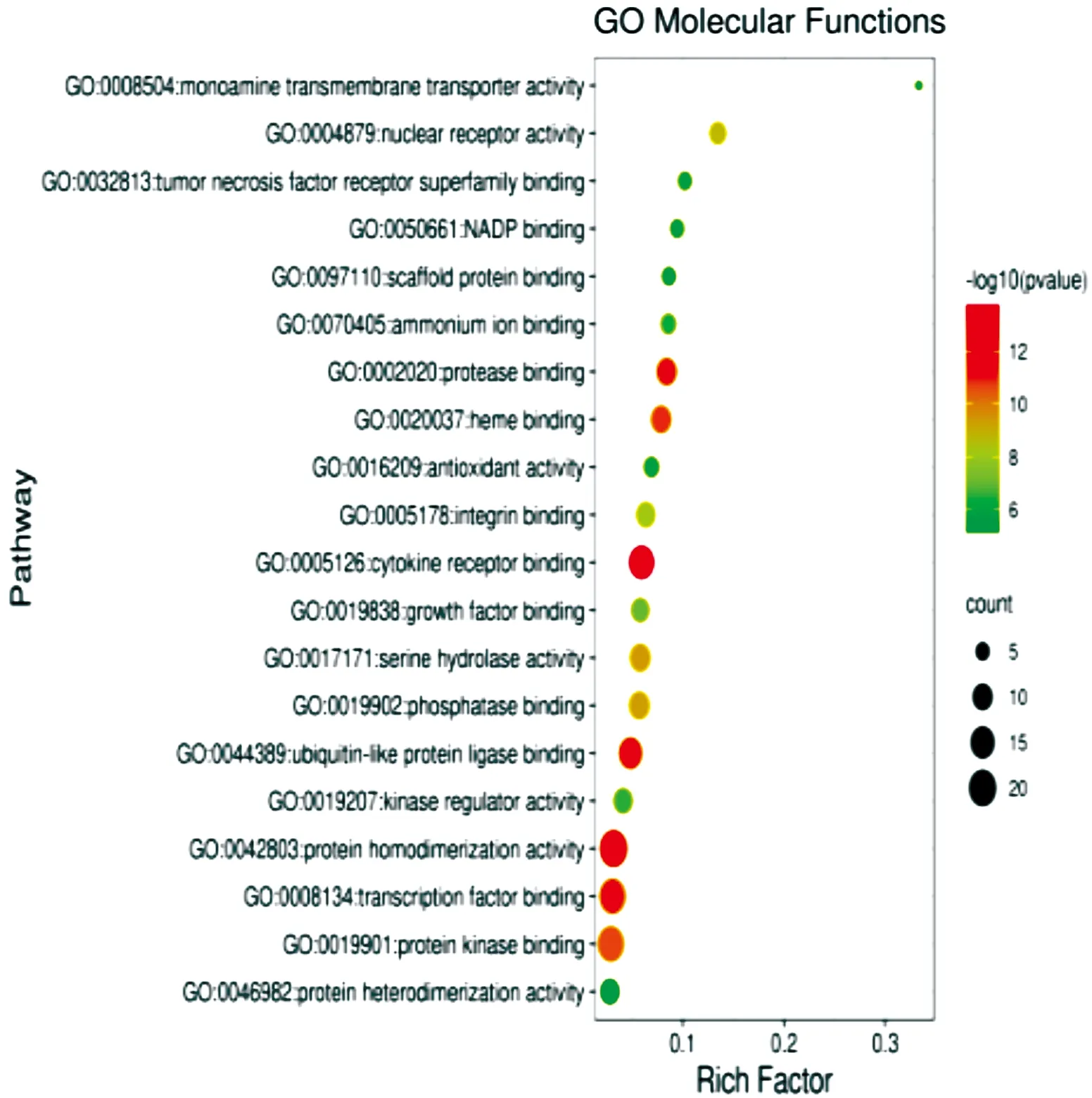
图10 GO MF前20条信号通路气泡图
2.8 KEGG通路富集分析将114个关键靶点进行KEGG通路富集分析,得到了304条KEGG通路,主要富集于癌症的途径、糖尿病并发症中的AGE-RAGE信号通路、IL-17信号通路、HIF-1信号通路、松弛素信号通路、p53信号通路等。KEGG通路富集分析前20条信号通路条形图(图11)和气泡图(图12)。

图11 关键靶点的KEGG功能富集分析条形图

图12 关键靶点的前20条KEGG功能富集气泡图
2.9 分子对接验证选取部分核心基因IL-6、AKT1和VEGFA靶蛋白与度值较高的化合物槲皮素、山柰酚和刺芒柄花素进行分子对接,其结合能为-6.21~-3.03 kcal·mol-1,自由结合能越低,其结合活性越高,其相互作用可能性越大。核心靶点与有效成分对接结果(表3),使用Pymol软件进行可视化绘图(图13)。

表3 部分核心靶点与有效成分对接结果 (kcal·mol-1)

注:A:IL-6与槲皮素;B:IL-6与山柰酚;C:IL-6与刺芒柄花素;D:AKT1与槲皮素;E:AKT1与山柰酚;F:AKT1与刺芒柄花素;G:VEGFA与槲皮素;H:VEGFA与山柰酚;I:VEGFA与刺芒柄花素
2.10 核心基因在大脑组织的分布通过HPA数据库分析,发现IL-6主要在大脑组织的基底神经节、大脑皮层、海马结构、脑桥和髓质中分布;AKT1主要在大脑皮层的内皮细胞、胶质细胞、神经元细胞和神经毡中分布,使用抗体CAB003765染色,其中神经元细胞为高度染色;VEGFA主要在大脑皮层的内皮细胞、胶质细胞、神经元细胞和神经毡中,使用抗体CAB005429染色,其中神经元细胞为高度染色(图14)。
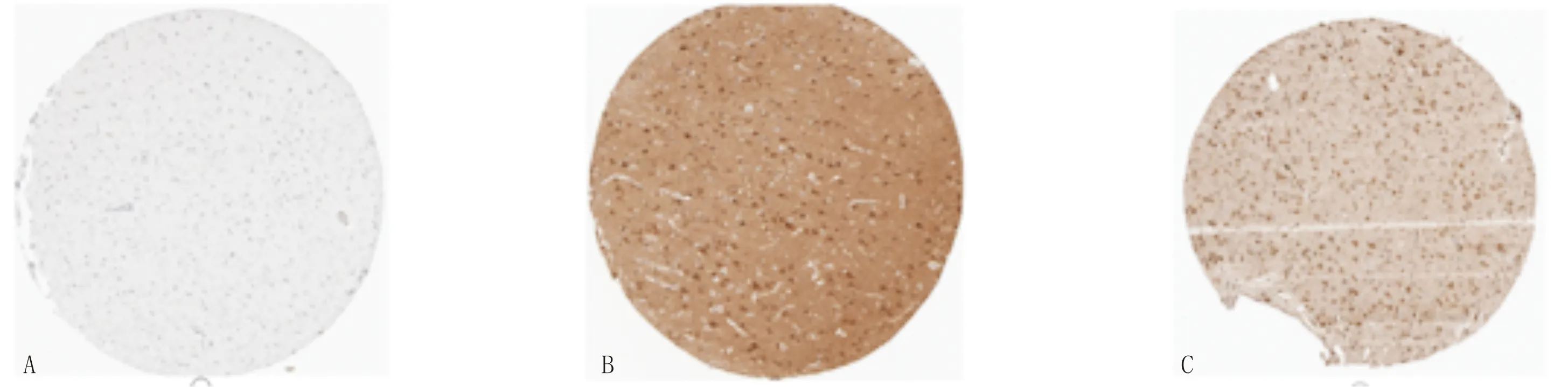
注:A:IL-6在大脑皮层免疫组织化学结果;B:AKT1在大脑皮层免疫组织化学结果;C:VEGFA在大脑皮层免疫组织化学结果
3 讨论
“心下有痰饮,胸胁支满,目眩者,苓桂术甘汤主之。”一般认为,其主治胸胁苦满,目眩心悸,短气而咳,舌苔白滑,脉弦滑或沉紧。苓桂术甘汤的组成为茯苓、桂枝、白术、甘草,其中茯苓味淡,具有利水消肿、健脾宁心的功效,有抗肿瘤、抗氧化、抗炎、保肝等药理活性[4];桂枝发汗解肌,温通经脉,助阳化气,平冲降逆,有抗菌和抗炎以及抗过敏等活性[5];白术有益气健脾,止汗固表、安胎等功效,用于机体的免疫调节[6];甘草有缓急止痛,调和诸药的功效,具有抗炎、抗微生物等作用[7]。四药合用,可温阳化饮、健脾利湿,用于治疗中阳不足痰饮所致的眩晕病。周剑宇等[8]发现,苓桂术甘汤能有效治疗内耳眩晕。刘姝伶等[9]总结王庆国使用苓桂术甘汤的经验,发现其对眩晕病疗效显著。赵智儒等[10]对苓桂术甘汤的研究发现,其可明显改善患者的眩晕症状,促进患者的康复。
本研究共检索出苓桂术甘汤的有效活性成分103种,得到预测靶点212个,其中苓桂术甘汤对眩晕病的关键靶点114个。其有效活性成分为槲皮素、山柰酚、刺芒柄花素、常春藤皂苷元等。槲皮素具有抗炎的作用,可以上调脑损伤后PGC-1α的表达,从而减少脑损伤后炎症反应所致的脑组织神经细胞凋亡,起到有效的脑保护作用[11]。山柰酚能通过抑制氧化应激反应[12],对由氧化应激引起的神经损伤起到一定的保护作用。刺芒柄花素能够对抗神经细胞损伤[13],其潜在机制可能与抑制脑内炎症反应和神经保护的氧化应激有关。常春藤皂苷元有抗炎的作用,可以恢复受损的神经功能[14],其中核心靶点为IL-6、AKT1、VEGFA、MMP-9等。IL-6为具有多种生物学功能的细胞因子,在细胞分化中起着重要作用,可诱导神经细胞分化,作用于中枢神经系统细胞。IL-6在神经组织的生理稳态中起关键作用[15],在周围神经的再生中起着至关重要的作用,并且是神经营养因子。AKT1可以调节代谢、细胞增殖、细胞存活、细胞生长和血管生成的过程,控制新生神经元整合过程的速度,包括正确的神经元定位,树突发育和突触形成,通过调节AKT1抑制小鼠模型细胞凋亡起到对神经的保护作用[16],促进神经元样PC12细胞的神经突生长[17]。VEGFA可以诱导内皮细胞增殖,促进细胞迁移,抑制细胞凋亡并诱导血管透化,可促进神经损伤的修复[18],也可影响前庭细胞增殖与凋亡的关系[19]。MMP-9在细胞外基质的局部蛋白水解和白细胞迁移中可能起重要作用,在神经损伤时起修复神经系统的作用[20]。
本研究GO功能富集分析发现,GO BP富集主要集中于对无机物的反应、活性氧代谢过程、对脂多糖的反应等,活性氧代谢过程可以通过激活ERK或p38信号通路,促进或抑制脑细胞增殖[21]。GO CC富集分析结果主要涉及膜筏、质膜蛋白复合物、细胞外基质等。膜筏的消耗能够促进中枢神经系统和周围神经系统中轴突再生长[22]。GO MF富集分析集中在蛋白酶结合等。神经营养蛋白对周围和中枢神经系统的发育和维持至关重要[23]。KEGG通路富集分析集中在IL-17信号通路、HIF-1信号通路、p53信号通路等。IL-17信号通路可介导星形胶质细胞炎症反应[24],其在中枢炎症免疫反应中起重要作用;p53信号通路通过对神经损伤后轴突再生的调节,达到对神经损伤的修复作用[25];HIF-1信号通路[26]通过发挥对神经的保护作用,保护神经损伤及减轻神经元的凋亡。
结合分子对接技术模拟核心基因与有效成分相互作用关系,发现筛选出的核心靶点IL-6、AKT1、VEGFA等和有效成分为槲皮素、山柰酚、刺芒柄花素等结合性较高,验证了其可能通过脑神经的保护及修复,介导炎症,维持脑组织稳态等方面治疗眩晕病。结合核心基因的免疫组织化学分析,发现其核心基因主要集中在大脑皮层中,尤其是神经元细胞中,这正与眩晕病的病位在脑相符,侧面验证苓桂术甘汤的有效成分在病位处缓解眩晕的症状。
综上所述,苓桂术甘汤治疗眩晕病通过核心靶点——IL-6、AKT1、TNF、VEGFA等参与IL-17信号通路、HIF-1信号通路、p53信号通路的调控,可能与调控中枢神经炎症,保护及重塑脑神经和调节脑组织有关。本研究只是从理论上对其进行探讨,其结果有待于进一步基础实验验证。

