生发片HPLC-DAD指纹图谱及指标性成分定量研究
司徒文辉,谢诗婷,刘颖,王永刚,彭维,姚宏亮,3*(.中山大学生命科学学院,广东省中药上市后质量与药效再评价工程技术研究中心,广东省热带亚热带植物资源与利用重点实验室,广州 5075;.广西南宁百会药业集团有限公司,南宁 53003;3.广东省科学院动物研究所,广东省动物保护与资源利用重点实验室,广东省野生动物保护与利用公共实验室,广州 5060)
生发片收载于《中药成方制剂》第十七册,由何首乌、女贞子、黑豆、黑枣、墨旱莲、麦冬、牡丹皮、桑椹、地黄、山药、茯苓、泽泻12 味中药组成[1]。具有滋补肝肾、益气养血、生发乌发的功效,用于肝肾不足、气血亏虚所致的头发早白,脱落,斑秃,全秃,脂溢性脱发。
中药成分复杂,生发片现行质量标准中仅对何首乌进行了定性和定量检测,不能确保生发片的安全性、有效性和均一性。目前对生发片质量研究较少,黄蓓蓓[2]曾建立生发片中总黄酮含量测定方法;曲珍仪等[3]用薄层鉴别对生发片中何首乌、墨旱莲、麦冬、地黄4 种药材进行鉴别,用高效液相色谱法(HPLC)测定二苯乙烯苷、特女贞苷含量[4]。指纹图谱具有整体性和模糊性的特点,是中药质量控制有效手段,能很好地评价和控制中药材及复方的质量[5-7],目前未有生发片指纹图谱的文献报道。
本研究采用HPLC 法构建了生发片指纹图谱,同时测定了二苯乙烯苷、大豆苷、特女贞苷的含量,为完善生发片的质量控制方法提供参考。
1 仪器与试药
1.1 仪器
十万分之一电子分析天平(MS105DU,瑞士Mettler toledo 公司);万分之一电子分析天平(ME 204,瑞士Mettler toledo 公司);超纯水器(arium mini,德国Sartorius 公司);数控超声波清洗器(KQ500DE,昆山市超声仪器有限公司);Agilent 1260 高效液相色谱仪(美国Agilent 公司);Dionex Ultimate 3000 高效液相色谱仪(美国Dionex 公司);UFLC-Triple-TOF-MS/MS 超快速高效液相色谱串联四级杆飞行时间质谱仪(日本岛津公司);Triple TOF 5600 plus(美国AB SCIEX 公司)。
1.2 试药
2,3,5 ,4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷(批号:110844-201713,纯度:93.6%)、特女贞苷(批号:111926-201605,纯度:93.3%)、大豆苷(批号:111738-201603,纯度:93.3%)、芍药苷(批号:110736-201438,纯度:96.4%)对照品(中国食品药品检定研究院)。何首乌(批号:120934-201410)、 女贞子(批号:121041-201404)、黑豆(批号:120975-201406)、墨旱莲(批号:120958-201407)、牡丹皮(批号:121490-201102)、 地黄(批号:121180-201506)、 茯苓(批号:121117-201509)、泽泻(批号:121081-201406)、山药(批号:121137-201606)、麦冬(批号:121013-201310)、大枣(批号:121040-201408)(对照药材,中国食品药品检定研究院)。甲醇(广州化学试剂厂,批号:20180801,分析纯);甲醇(Honeywell,批号:Q8AG1H,色谱级);磷酸(阿拉丁,批号:G1614094,色谱级);水为超纯水;28 批生发片均由广西南宁百会药业集团有限公司提供,编号为S1 ~S20 的生发片作为研究集建立对照指纹图谱;另8 批(S21 ~S28)生发片作为检验集与对照指纹图谱比较,具体见表1。
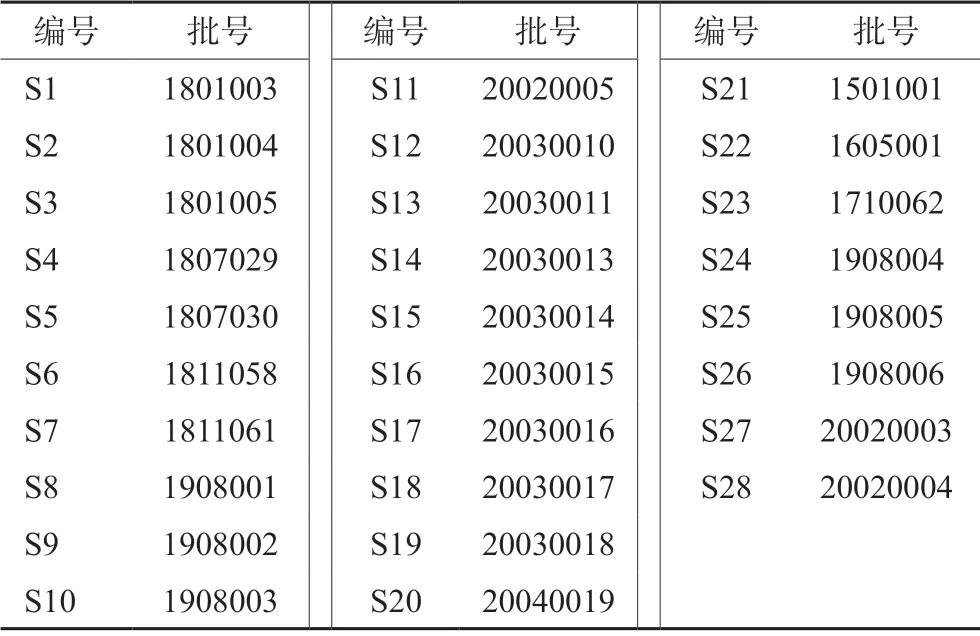
表1 生发片供试品批号Tab 1 Lot numbers of Shengfa tablets
2 方法与结果
2.1 溶液的制备
2.1.1 对照品溶液的制备 分别称取2,3,5,4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷、大豆苷、特女贞苷、芍药苷适量,精密称定,加甲醇溶解,制成每1 mL 含2,3,5,4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷35 μg、大豆苷10 μg、特女贞苷85 μg、芍药苷50 μg 的混合对照品溶液。
2.1.2 对照药材溶液的制备 分别取何首乌、女贞子、黑豆、墨旱莲、牡丹皮、地黄、茯苓、泽泻、麦冬、大枣和黑豆对照药材各0.25 g,精密称定,置具塞锥形瓶中,精密加入甲醇10 mL,称定重量,超声处理(功率300 W,频率40 kHz)30 min,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
2.1.3 供试品溶液的制备 取生发片20 片,去糖衣,研细,取约0.5 g,精密称定,置具塞锥形瓶中,精密加入甲醇10 mL,称定重量,超声处理(功率300 W,频率40 kHz)30 min,放冷,再称定重量,用甲醇补足减失的重量,摇匀,过0.45 μm 滤膜,取续滤液,即得。
2.1.4 阴性样品溶液的制备 按处方比例及工艺制备缺何首乌、女贞子、黑豆的阴性样品,并按“2.1.3”项下方法制备阴性样品溶液,即得。
2.2 分析条件
2.2.1 色谱条件 色谱柱:Welch Ultimate XB-C18(4.6 mm×250 mm,5 μm);柱温:25 ℃;流动相:甲醇(A)-0.1%磷酸(B),梯度洗脱(0 ~105 min,5% ~60%A);流速:1 mL·min-1;进样量:10 μL;柱温:25℃;指纹图谱检测波长:227 nm;含量测定检测波长:250 nm(大豆苷)、320 nm(二苯乙烯苷)、227 nm(特女贞苷)。
2.2.2 质谱条件 ESI 电喷雾离子源,离子喷雾电压负模式-4500 V;喷雾气55 psi;辅助加热器55 psi;离子源温度550 ℃;气帘气35 psi;碰撞气压力10 psi,扫描范围m/z100 ~2000,采用负离子模式进行检测。
2.3 生发片指纹图谱的构建
2.3.1 精密度试验 取同一供试品溶液(批号:1801003),连续进样6 次。以6 号峰为参照,各共有峰的相对保留时间和相对峰面积RSD分别为0.030%~0.17%,0.86%~4.6%。结果表明仪器的精密度良好。
2.3.2 稳定性试验 取供试品溶液(批号:1801003), 分别在0、2、8、24、26、48 h 进样测定。以6 号峰为参照,各共有峰的相对保留时间和相对峰面积的RSD分别为0.030%~0.42%,0.38%~3.3%。结果表明供试品溶液放置48 h 稳定。
2.3.3 重复性试验 取同一批供试品(批号:1801003),按“2.1.3”项下方法分别制备6 份供试品溶液,进样检测。以6 号峰为参照,各共有峰的相对保留时间和相对峰面积的RSD分别为0.020%~0.10%,0.60%~3.8%。结果表明该方法重复性良好。
2.3.4 指纹图谱的构建及相似度分析 取20 批(S1 ~S20)生发片,按“2.1.3”项下方法制备供试品溶液,进样测定,采用“中药色谱指纹图谱相似度评价系统”2012 版进行评价。20 批生发片的色谱图中有10 个共有峰稳定重现,编号为1 ~10。对20 批生发片HPLC 指纹图谱数据进行处理,建立叠加色谱图(见图1),通过中位数法获得生发片HPLC 对照指纹图谱(见图2)。

图1 20 批生发片HPLC 指纹图谱Fig 1 HPLC fingerprint of 20 batches Shengfa tablets
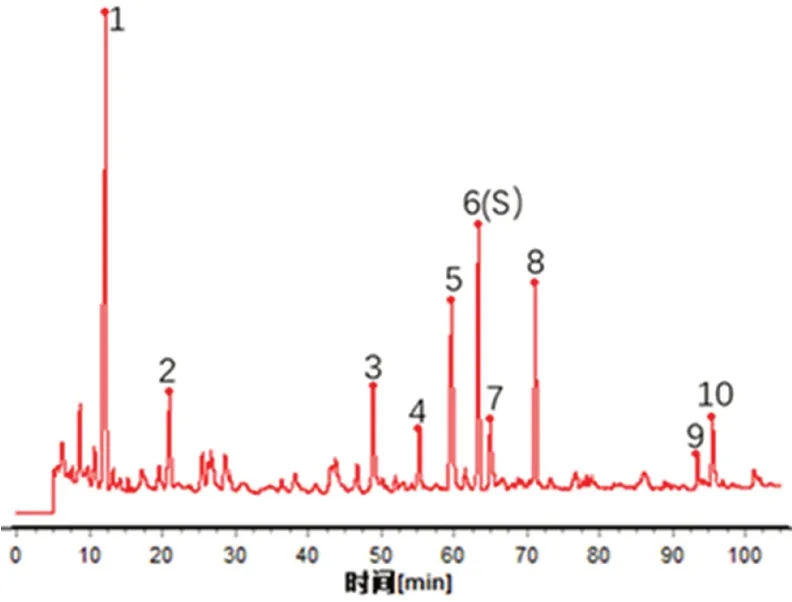
图2 生发片HPLC 对照指纹图谱Fig 2 HPLC control fingerprint of Shengfa tablets
以6 号峰(二苯乙烯苷)作为参照峰,计算10 个共有峰的相对保留时间,分别为0.19、0.33、0.77、0.87、0.94、1.00、1.03、1.12、1.47、1.51,各共有峰相对保留时间RSD在0.05%~1.2%。20 批生发片的相似度均大于0.95,结果见表2,表明不同批次生发片质量稳定。

表2 20 批生发片相似度评价结果Tab 2 Similarity of 20 batches of Shengfa tablets
2.3.5 共有峰的指证及药味归属分析 精密吸取对照药材溶液以及供试品溶液,进样检测,记录色谱图,通过保留时间、光谱图数据对比,得到10 个共有峰的归属,见图3。
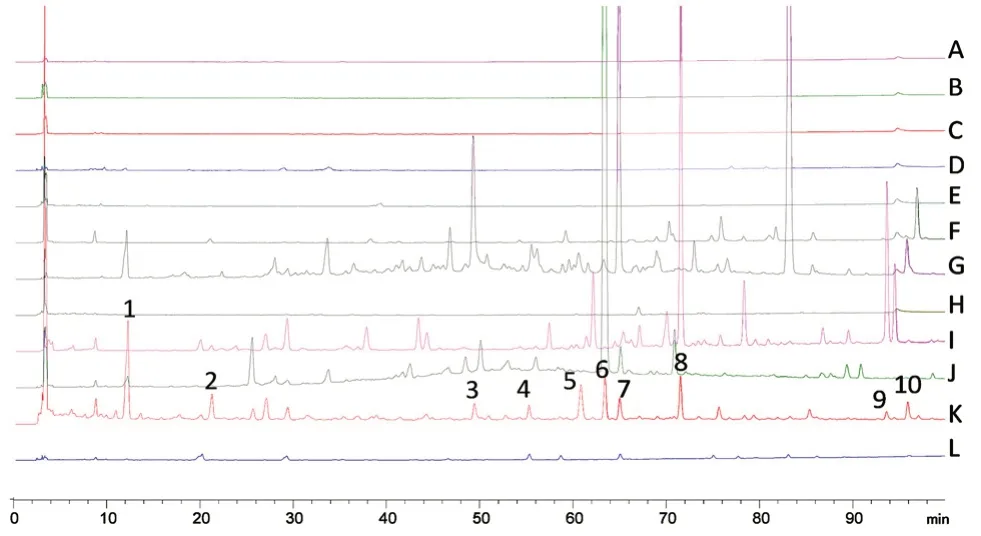
图3 生发片指纹图谱共有峰归属性Fig 3 Attribution peak fingerprint of characteristic peak of Shengfa tablets
通过UFLC-Triple TOF-MS/MS 技术手段,按“2.2.2”项下质谱条件对对照品溶液、供试品溶液及对照药材溶液进行检测。通过对照品对照确证了其中4 个共有峰。通过保留时间、质谱分析及文献查询,指认1 号峰为没食子酸[8],2 号峰为原儿茶酸[9-10],5、10 号峰为单帖苷类化合物[11],7 号峰为异黄酮类化合物[12],9 号峰为裂环环烯醚萜类化合物[13],共有峰的药味归属分析结果见表3。
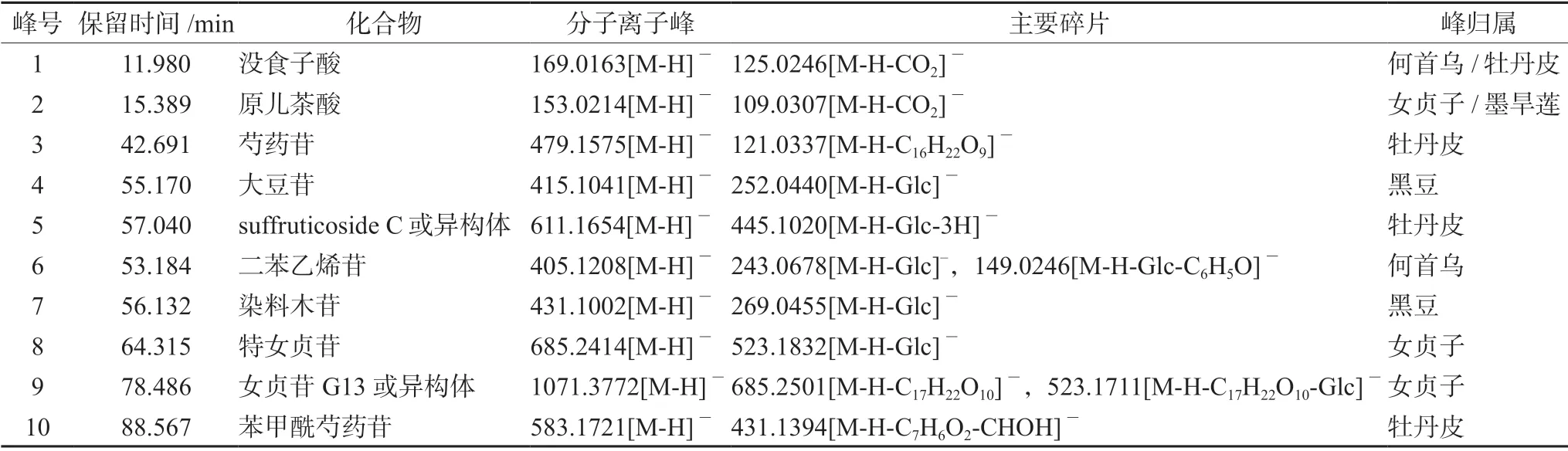
表3 生发片共有峰指证及药味归属Tab 3 Identification and origin assignment of characteristic peaks in HPLC fingerprint
2.3.6 生发片指纹图谱的验证 对8 批生发片(S21 ~S28)进行测定,所得生发片HPLC-DAD指纹图谱如图4 所示,其中R 为对照指纹图谱。对8 批生发片指纹图谱与生发片HPLC 对照指纹图谱进行相似度评价,结果见表4。2 批超出有效期的生发片与对照指纹图谱的相似度低于0.90;6 批有效期内的生发片相似度均大于 0.95。

表4 8 批生发片验证相似度评价结果Tab 4 Similarity of HPLC fingerprint of 8 batches of Shengfa tablets

图4 8 批生发片HPLC 指纹图谱验证Fig 4 Validation of HPLC fingerprint of 8 batches of Shengfa tablets
2.4 指纹图谱同时对指标成分进行含量测定
2.4.1 系统适用性试验 分别吸取对照品溶液及供试品溶液进样测定,理论塔板数按特女贞苷计算应不低于30 000;结果二苯乙烯苷、特女贞苷和大豆苷均与其他组分达到基线分离,分离度大于1.5。
2.4.2 专属性考察 分别吸取供试品溶液、对照品溶液、阴性样品溶液、对照药材溶液各10 μL,进样测定,在供试品色谱图中呈现出与对照品二苯乙烯苷、特女贞苷、大豆苷及其对应对照药材色谱峰保留时间相同的色谱峰,阴性样品无干扰,具有良好专属性,结果见图5 ~7。

图5 二苯乙烯苷含量测定专属性试验(320 nm)Fig 5 Specificity test for determination of stilbene glycoside(320 nm)

图6 特女贞苷含量测定专属性试验(227 nm)Fig 6 Specificity test for determination of specnuezhenide(227 nm)
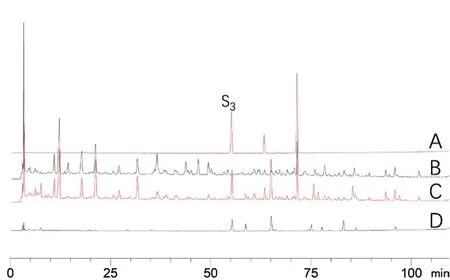
图7 大豆苷含量测定专属性试验(250 nm)Fig 7 Specificity test of daidzin content determination(250 nm)
2.4.3 线性关系考察 分别取二苯乙烯苷、特女贞苷和大豆苷对照品适量,加甲醇配制成含二苯乙烯苷对照品1.68、3.35、6.70、16.75、23.45、33.50 μg·mL-1,含特女贞苷对照品4.36、8.71、17.42、43.55、60.97、87.10 μg·mL-1, 含大豆苷对照品0.56、1.13、2.26、5.65、7.91、11.30 μg·mL-1系列溶液;按“2.2.1”项下色谱条件测定,以峰面积积分值A与进样质量浓度C(μg·mL-1)进行回归分析,3 种成分在各自的浓度范围内,进样质量浓度C(μg·mL-1)与峰面积A值呈良好线性关系,见表5。
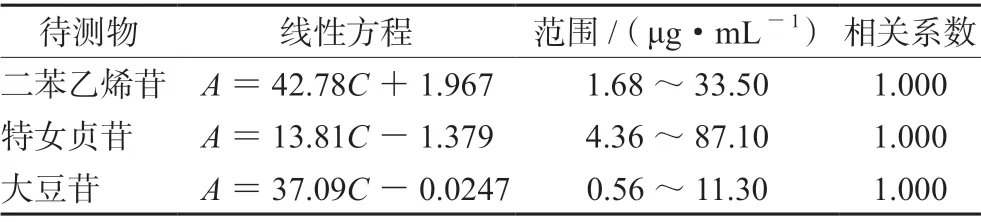
表5 3 种成分的线性关系Tab 5 Linearity of the 3 components
2.4.4 精密度试验 精密吸取混合对照品溶液10 μL,连续进样6 次,结果3 个对照品峰面积的RSD分别为0.94%、0.91%和0.94%,表明该方法精密度良好。
2.4.5 稳定性试验 取混合对照品溶液、供试品溶液,放置0、2、8、24、26、48 h 后进样测定,结果供试品溶液与对照品溶液中二苯乙烯苷峰面积的RSD分别为1.6%、0.76%,特女贞苷峰面积的RSD分别为1.4%、0.73%,大豆苷峰面积的RSD分别为1.6%、0.83%。表明生发片供试品溶液及混合对照品溶液在48 h 内稳定性良好。
2.4.6 重复性试验 取同一批号(批号:1801003)生发片样品适量,按“2.1.3”项下方法平行制备6 份,进样测定。结果供试品中二苯乙烯苷、特女贞苷、大豆苷的平均含量分别为0.3652、0.7442、0.1459 mg·g-1,RSD值分别为0.46%、0.88%、0.91%。表明该方法重复性良好。
2.4.7 加样回收试验 精密称取已知含量的生发片适量,平行6 份,分别精密加入适量的二苯乙烯苷、特女贞苷、大豆苷对照品,进样测定,结果供试品中二苯乙烯苷、特女贞苷和大豆苷的平均回收率分别为92.85%、99.13%、98.21%,RSD分别为2.5%、2.2%、2.2%。表明该方法回收率好。
2.4.8 样品测定 取28 批生发片样品,分别按“2.1.3”项下方法制备供试品溶液,进样测定,用外标法计算二苯乙烯苷、特女贞苷和大豆苷的含量,结果见表6。

表6 生发片的含量测定结果(mg/片)Tab 6 Content determination of Shengfa tablets (mg/tablet)
3 讨论
3.1 流动相的选择
通过比较乙腈-0.2%甲酸、甲醇-0.2%甲酸、甲醇-0.1%磷酸等流动相,发现甲醇-0.1%磷酸作为流动相时,各色谱峰分离度较好,基线较平,故选择甲醇-0.1%磷酸作为流动相。
3.2 检测波长的选择
采用DAD 检测器测定,二苯乙烯苷、特女贞苷和大豆苷最大吸收波长分别为318.87、227.23、250.91 nm;在2020年版《中国药典》一部何首乌药材【含量测定】中二苯乙烯苷选择320 nm 为检测波长。因3 个色谱峰的保留时间比较接近,不能用切换波长的方法对3 个图谱进行合并,且为保证含量测定的准确度,故选用成分最大吸收波长作为含量测定检测波长,即在320 nm 下检测二苯乙烯苷含量,227 nm、250 nm 分别检测特女贞苷与大豆苷含量。
3.3 含量测定指标成分的确定
用混合对照品确证了3 号峰芍药苷、4 号峰大豆苷、6 号峰二苯乙烯苷和8 号峰特女贞苷,结合4 个峰的分离度、不对称性、专属性、耐用性等因素;综合考虑,暂不把芍药苷成分列入含量测定的检测指标。
3.4 指纹图谱验证
2 批超出有效期的生发片为不合格样品,与对照指纹图谱的相似度低于 0.90。在后续含量测定时发现,过期生发片中二苯乙烯苷含量均低于有效期内的生发片;推测生发片过期后会有部分化学成分降解,所以相似度低于0.90。
4 结论
本研究建立了生发片HPLC 指纹图谱,确定了10 个共有峰,并利用对照品和HPLC-MS 技术对这10 个共有峰进行了确证和指认,确认它们是何首乌、女贞子、黑豆、牡丹皮、墨旱莲5 味药材的活性成分。在此基础上,对何首乌、女贞子、黑豆的指标性成分二苯乙烯苷、特女贞苷、大豆苷进行含量测定,全面有效地评价生发片的质量。经过方法学验证,表明所建立的检测方法操作简便、稳定、重复性良好,可为生发片的质量评价提供参考。

