TRPV5基因多态性与肾含钙结石疾病的相关性研究
范先明 林剑锋 涂建平 梁福律 叶志彬 张明芽 李亚楠 郭昭建 胡力仁
(福建中医药大学附属厦门市第三医院泌尿外科,福建 厦门 361100)
泌尿系结石在我国乃至全世界都是常见的疾病,其发病率仍持续增加,我国发病率高达6.06%,但呈不均衡分布,男性多于女性,农村高于城市,南方高于北方[1];而含钙结石是最常见的泌尿系结石的类型[2]。泌尿系结石病因涉及环境和遗传因素等方面[3]。研究发现泌尿系结石患者其亲属50%~70%患有泌尿系结石[4]。而Curhan等[5]对泌尿系结石患者的家庭成员限制钙摄入量后,结石风险增加,导致人们对遗传因素、环境因素及混杂因素增加泌尿系结石的风险存有疑惑。目前有基因的作用研究支持有泌尿系结石病史的家庭中有常染色体显性遗传可能[6]。全基因组关联分析(genome-wide association study wide association,GWAS)是在全基因组范围内常见遗传变异(单核苷酸多态性和拷贝数)与疾病进行轮廓性的整体性的关联分析方法,筛选出与疾病相关的SNPs。目前仅有少量来自欧洲和日本关于泌尿系结石形成中调节钙和磷酸盐代谢的各种基因位点的GWAS,认为常见遗传变异的尿液转运蛋白和大分子是尿路结石病相关的危险因素[7-8]。GWAS研究易于实施并呈上升的趋势,是评估复杂疾病(如肾结石)的遗传决定因素,实用且经济高效的方式,在资源有限的研究环境中有明显的优势[9]。目前已经发现许多与增加肾结石风险相关的SNP位点[10-14]。但能够减少肾结石风险相关的SNP位点较少报道。本研究旨在确定TRPV5、UMOD基因中常见遗传变异与泌尿系结石患者易感性之间的潜在关联。此外,我们还通过收集和分析与含钙肾结石易感性相关的TRPV5、UMOD基因多态性的现有数据,采用了系统的方法,这是通过使用含钙肾结石病患者和健康对照的候选基因关联研究确定的,通过Logistic回归分析影响含钙肾结石发病的危险因素,报道如下。
1 资料与方法
1.1 一般资料 研究组:随机选择在厦门市第三医院确诊的肾含钙肾结石共237例为研究对象,时间为2017年10月至2020年7月,年龄52~73岁,平均(64.78±3.93)岁;对照组:选择我院同期的无泌尿系结石病史的健康者149名,年龄55~74岁,平均(65.31±3.87)岁。两组一般资料比较,P>0.05,具有可比性。采用相同方法分析血清中的钙、尿素和肌酐,并分析尿液以研究尿钙排泄[15]。通过问卷调查获得研究组与对照组年龄、性别、BMI、肾结石家族史的详细信息。对所有的参与研究的结石患者进行随访,以了解结石的复发情况。本研究已经获得伦理委员会批准。
1.2 纳入和排除标准
纳入标准:年龄18~85岁;确诊泌尿系结石患者;患者属于中国国籍及汉族;临床资料完整;患者经结石成分分析为含钙结石。
排除标准:有肾结石家族史的患者;怀孕期、哺乳期的泌尿系结石患者;有骨髓自体移植和外周干细胞移植等器官移植史,及近期输血史患者;有明显精神障碍及中枢神经系统障碍史者;伴有严重泌尿系感染或活动性消化道溃疡需要治疗者;合并有长期的尿路梗阻、甲状腺功能亢进、慢性肠道疾病、甲状旁腺功能亢进、不能控制的糖尿病等疾病患者;合并恶性肿瘤患者。
1.3 方法 收集研究组血液样本237例及对照组血液样本149例。留取EDTA抗凝血标本,弃去上清后留取其他的细胞成分,存放于-80 ℃冰箱,待后采用苯酚-氯仿法提取DNA,测定DNA浓度及纯度,保持DNA A260/280在1.7~1.9。在第三方检测机构中检测目的基因SNP。
试验流程:样品质检—设计引物¬¬—PCR验证—PCR扩增—PCR产物回收纯化—建库—上机测序—数据分析。利用HapMap据库(http://hapmap.ncbi.nlm.nil.gov/)以及相关文献,选择候选基因功能性SNP位点位于启动子、5'-非翻译区(5'-UTR)、内含子和3'-非翻译区(3'-UTR)等,且满足在CHB人群中MAF>0.05。与TVRP5相关的3个单核苷酸多态性(SNP)(rs17210、rs17212和rs17262),UMOD基因相关的SNP(rs13329952、rs11648131和rs9652588)已进行调查。对于所有SNP,样品中的检出率约为91%。经χ2检验验证了受试者符合Hardy-Weinberg平衡(HWE)。根据SNP位点序列信息并采用Assay Designer 3.1软件进行引物设计PCR反应和单碱基扩展引物,并交由有限公司合成。TRPV5、UMOD基因各个SNP位点引物序列详见表1。多聚酶链反应(polymerase chain reaction,PCR)在4 μL体系中进行,每个微孔中的总体积为4 μL,包括1 μL基因组DNA,0.625 μL 10×PCR缓冲液,1 μL引物使用液,0.325 μL MgCl2,0.1 μL HotstarTaq,用双蒸水补足不足体积。PCR反应条件:94 ℃ 5 min;94 ℃ 20 s、56 ℃ 30 s、72 ℃ 1 min,72 ℃ 3 min,4 ℃ forever。PCR反应后,多余的脱氧核糖核苷三磷酸(dNTP)和引物用SAP酶清除,SAP程序:37 ℃40 min,85℃ 5 min,4 ℃ forever。延长反应,延长反应条件:1.94 ℃ 30 s;2.94 ℃ 5 s;3.52 ℃ 5 s;4.80 ℃ 5 s;5.72 ℃ 3 min;6.4 ℃ forever。3~4步骤5个循环后,2~4步骤再40个循环。产物纯化及构建文库,把检测样品转移到表面覆盖基质的Mass ARRAY SpectroCHIP测序芯片上,即可放入质谱仪进行全自动分析检测,每个检测点只需3~5 s。应用边合成边测序方式进行测序,碱基种类根据4种不同的荧光信号来确认,并保证核酸序列质量。试验结果用TYPER软件分析并获得分型数据。

表1 TRPV5、UMOD 基因SNP位点的合成引物序列
1.4 研究指标 研究对象的基本情况、饮食和运动情况。研究对象基本情况包括:年龄、性别、基础病(糖尿病、心血管疾病等)和体质量指数(BMI)。
1.5 统计学方法 收集的资料符合正态分布的用()描述。利用SPSS 25.0统计软件,两组独立样本采用Student's检验,3组样本及以上计量资料用方差分析。统计所有样本中SNP位点的分型情况,基因型、最小等位基因数(MAF)以及不同等位基因/基因型的比例。使用χ2检验检查受试者中每个的基因型频率是否偏离Hardy-Weinberg平衡(HWE),P>0.05被认为与HWE差异无统计学意义。使用χ2检验分析不同基因型/等位基因与肾结石发病风险之间的相关性,以P<0.05其相关性差异有统计学意义。通过二元Logistic回归分析了SNP与含钙结石患者之间的关联,确定比值比(odds ratio,OR)及其95%置信区间(confidenceInterval,CI)。
2 结果
2.1 两组基本资料比较 研究组的BMI、血尿酸、血肌酐、收缩压及收缩压显著高于对照组(P<0.05),其他指标差异无统计学意义(P>0.05)。见表2。
表2 两组基本资料比较()
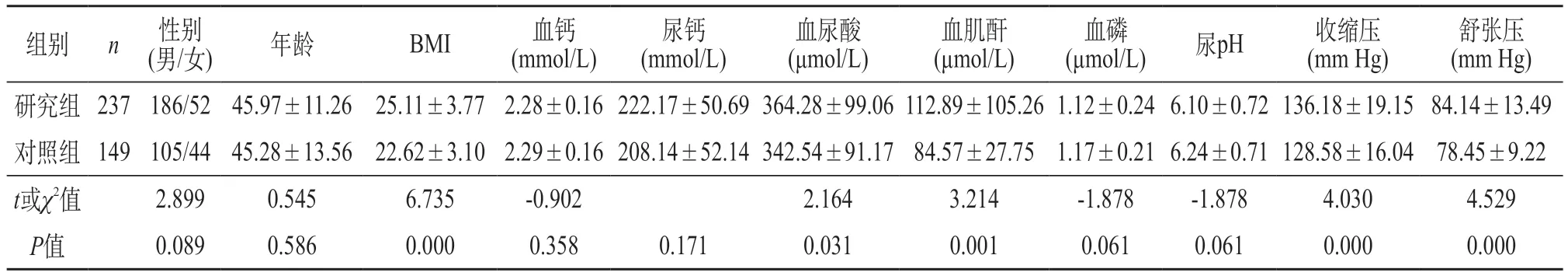
表2 两组基本资料比较()
2.2 两组TRPV5和UMOD基因多态性分布比较 研究组TRPV5基因rs17212位点的等位基因A的频率显著高于对照组(P<0.05),rs17212位点AA、GA的基因型显著高于对照组(P<0.05),UMOD基因rs11648131位点的等位基因C的频率显著高于对照组(P<0.05),rs11648131位点CC的基因型显著高于对照组(P<0.05),其他点位基因多态性差异无统计学意义(P>0.05)。见表3、表4。

表3 两组TRPV5基因多态性分布比较
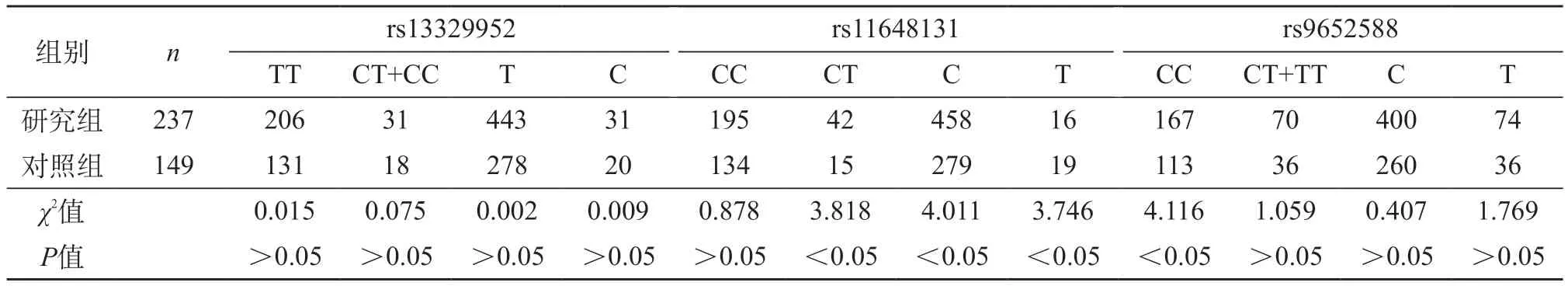
表4 两组UMOD基因多态性分布比较
2.3 含钙肾结石危险因素Logistic回归分析 Logistic回归分析结果显示年龄≤35岁、BMI和rs17212是含钙肾结石发病的危险因素(P<0.05),rs11648131是含钙肾结石发病的保护因素(P<0.05),血尿酸与含钙肾结石无明显相关性。见图1。

图1 Logistic回归分析泌尿结石危险因素的OR值
3 讨 论
目前肾结石可通过许多微创的方法治疗,但其有较高的残石率及复发率,肾结石仍是泌尿外科中棘手问题之一[16]。在泌尿系结石中以草酸钙或磷酸钙结石为主,主要成分是钙离子[17-18]。既往研究表明,高尿钙症也是泌尿系结石的主要危险因素之一,遗传和环境风险因素会对原尿液中钙离子再吸收产生重大影响,继而导致泌尿系结石[19-20]。因此,促进尿液钙离子再吸收和减少尿钙排泄可能是减少肾结石形成的一种方式。
在肾脏中,TRPV5蛋白质主要在肾远曲小管和连接小管的上皮中表达,是钙离子重吸收的最后门户,在尿原液中钙离子的重吸收和维持钙离子的稳态中起重要的作用[21-23]。已有研究证明,TRVP5基因敲除的小鼠表现出Ca2+重吸收减少,增加肠道钙吸收和降低骨密度[24-25],用小的活化RNA(ds-320)激活TRVP5后可促进大鼠尿钙离子的重吸收并减少尿钙离子的排泄,从而抑制乙二醇诱导的草酸钙晶体形成[26]。TRPV5表达下调直接降低大鼠尿液中钙离子重吸收,直接导致尿钙丢失并导致高钙尿症[27]。这表明TRPV5的表达水平涉及肾结石的形成,上调TRPV5的表达可能是肾结石一个新的治疗方法。
TRPV5单核苷酸多态性主要在高钙性疾病中。首个报告在美国非洲裔中TRPV5有A8V、R154H(rs4236480)、A563T和L712F的基因多态性,仅R154H(rs4236480)与高尿钙相关[28]。在20例高的尿钙患者中检测到TRPV5的SNP(A8V、R154H和A561T),尽管对TRPV5通道功能没有受到影响[29]。与野生型TRPV5相比,TRPV5的S682P突变导致小鼠模型中出现高钙尿症、多尿症、高磷尿症和更酸性的尿液[30]。在我国台湾地区人群中,发现与泌尿系结石相关TRPV5基因多态性位点是rs4236480,因为携带TT+CT基因型的患者比CC基因型患者患结石的风险增加[31]。Oddsson等[32]通过全基因组关联研究(GWAS)发现TRPV5与泌尿系结石的复发存在明显相关性(OR=3.62,P=4.1×10-5)。在本研究中,所选得TRPV5的SNP(rs17210,rs17212和rs17262)仅发现rs17212与肾结石的发病风险显著相关,在肾结石的患者中rs17212的AA 纯合子基因型携带者高于其他基因型携带者,rs17212是肾结石的危险因素之一[OR=2.210,95%CI(1.040~4.698)]。
UMOD 基因位于染色体16p12上,编码哺乳动物尿液中含量最高的尿调节蛋白(Tamm-Horsfall蛋白)。GWAS发现UMOD单核苷酸多态性(SNPs)对含有钙的肾结石具有保护作用[33]。UMOD通过细胞外作用和减少TRPV5的内吞作用来上调TRPV5,刺激Ca2+重吸收有助于防止肾结石发生的风险,形成并具有抑制结石形成特征的巨细胞[34-35]。在本研究中UMOD 3个多态性位点(rs13329952、rs11648131和rs9652588)仅发现rs1164813多态性位点与肾结石的发病风险显著负相关,在肾结石患者中CC纯合子基因型携带者低于CG杂合子基因型携带者,有助于防止肾结石发生的风险。
这项研究仍然存在局限性。由于潜在的SNP是根据已发表的文章和公共数据库选择的,因此我们可能会错过其他一些潜在的功能遗传变异性,这些变异不一定是SNPs。其次,偏差可能由本研究的样本量相对较小引起,需要进一步研究样本量较大的样本量来验证我们的发现。此外,这项研究的参与者都是中国人,最好将这项研究扩展到不同的种族群体,并检验我们发现的有效性。此外,虽然我们已经揭示了SNP rs17212、rs1164813与肾结石之间的关联,但实际分子和细胞机制仍有待探索。
——肾结石

