长链非编码RNA NEAT1影响骨髓瘤细胞ATO敏感性的作用研究
潘韶英,朱 斌,王素丽,丁志勇,赵文理
0 引言
多发性骨髓瘤(Multiple myeloma,MM)为恶性克隆性浆细胞病,常累及骨、肾、血细胞甚至神经系统[1-2]。近年来,新型药物(如蛋白酶抑制剂、免疫调节药物)的广泛使用使多发性骨髓瘤患者的治疗反应率大幅提高,但难以长期维持,几乎所有患者最终都会出现疾病复发及耐药,大部分患者死于并发症[3-4]。三氧化二砷(Arsenic trioxide,ATO)最早在我国用于急性早幼粒细胞白血病。近年研究发现,ATO在非急性早幼粒细胞白血病、淋巴瘤、多种实体肿瘤及多发性骨髓瘤中具有诱导细胞凋亡能力[5-7]。此外,ATO可调控多种肿瘤相关信号通路及靶基因[8-9],表明ATO对MM治疗具有较好的临床应用前景。
长链非编码RNA-NEAT1在MM的发生发展中起关键作用[10-11]。有文献报道NEAT1与肿瘤化疗药物抵抗有关[12]。本研究拟阐述ATO对MM细胞生长及凋亡的作用,并探究NEAT1及相关通路在此过程中作用,为ATO潜在临床应用提供实验依据。
1 材料与方法
1.1 主要材料 OPM2、KM3细胞购自美国ATCC公司,U266、RPMI8226细胞购自武汉普诺赛生命科技有限公司。RMPI1640高糖培养基购自美国Hyclone公司;胎牛血清、胰酶购自美国Gibco公司;细胞用青霉素和链霉素、RIPA裂解液、BCA蛋白定量检测试剂盒、鼠抗人GAPDH单克隆抗体及辣根过氧化物酶(HRP)标记的抗鼠及抗兔二抗购自上海碧云天生物技术有限公司;总RNA分离提取试剂TRIzol、siRNA转染试剂LipofectamineTM 3000购自美国Invitrogen公司;逆转录-实时荧光定量PCR检测试剂盒购自日本TaKaRa公司。ECL化学发光试剂盒购自Millipore公司。蛋白一抗均购自CST公司。引物、siRNA由上海吉玛制药技术有限公司合成。ATO购自美国Sigma-Aldrich公司。
1.2 方法
1.2.1 实验分组 将细胞试验分为2组,①NEAT1敲减组:对KM3细胞进行NEAT1特异性siRNA转染,减低NEAT1表达水平;②对照组:对KM3细胞转染阴性siRNA,作为对照。
1.2.2 细胞培养及药物处理 骨髓瘤细胞OPM2、U266、RPMI8226及KM3培养于RPMI 1640含10%胎牛血清、100 μg/ml链霉素和100 U/ml青霉素的DMEM高糖培养液,置于27 ℃、5%CO2的培养箱中培养。收集对数生长期的细胞用于后续实验。用RPMI 1640稀释ATO,并配制为5、15、20 μM终浓度工作液,与细胞孵育培养48 h后用于后续试验。
1.2.3 CCK-8细胞增殖活性检测 各实验组及对照组细胞以1×104细胞/孔浓度接种96孔板,次日更换含不同浓度ATO的细胞培养液培养48 h,加入CCK-8溶液(10 μl/孔),继续培养4 h。通过酶标仪测量该样品在450 nm处的吸光度值。

×100%
1.2.4 RNA提取及基因表达检测 总RNA提取、逆转录及荧光定量PCR按试剂盒说明书操作。Real-time定量PCR条件为:95 ℃ 10 min后,95 ℃ 15 s,60 ℃ 1 min,40个循环。Real-time定量PCR使用ABI 7500仪器进行。根据待测标本的Ct值,以GAPDH作为内参照,采用2-△△Ct法计算相对表达倍数变化。其中各基因引物如下:NEAT1:F:5′-ATGCCACAACGCAGATTGAT-3′,R:5′- CGAGAAACGCACAAGAAGG-3′。Notch1:F:5′- GAGGCGTGGCAGACTATGC-3′,R:5′-CTTGTACTCCGTCAGCGTGA-3′。Jag2:F:5′-TGGGCGGCAACTCCTTCTA-3′,R:5′-GCCTCCACGATGAGGGTAAA-3′。ADAM10:F:5′-ATGGGAGGTCAGTATGGGAATC-3′,R:5′-ACTGCTCTTTTGGCACGCT-3′。PRKD2:F:5′-GAAAGCGGCACTATTGGCG-3′,R:5′-ACTCCACCGTGAGGATTTCTG-3′。GAPDH: F:5′-GACCTGACCTGCCGTCTA-3′,R:5′-AGGAGTGGGTGTCGCTGT-3′。
1.2.5 NEAT1敲减实验 siRNA阴性对照序列5′-UUCUCCGAACGUGUCACGU-3′。NEAT1特异性2条siRNA序列如下。siNEAT1-1:5′-GUGAGAAGUUGCUUAGAAACUUU-3′,siNEAT1-2:5′-UGAUGGAGACGGAGCUGAAUU-3′。siRNA转染骨髓瘤细胞株按脂质体转染试剂Lipofectamine 3000说明书进行操作。在KM3细胞中敲减NEAT1,利用qPCR检测2条siRNA敲减效率,发现与阴性siRNA对照比较,空转细胞NEAT1表达(1.08±0.061vs.1.00±0.083,t=1.792,P=0.245)无明显差异;siNEAT1-1敲减组细胞NEAT1表达(0.51±0.035vs.1.00±0.083,t=10.98,P<0.001)显著减低;siNEAT1-2敲减组细胞NEAT1表达(0.20±0.016vs.1.00±0.083,t=17.79,P<0.001)显著减低;同时,siNEAT1-2敲减效率更高,后续研究以siNEAT1-2细胞作为NEAT1敲减组细胞研究。
1.2.6 流式细胞仪检测细胞凋亡 PBS洗涤贴壁细胞1次,加入适量胰酶细胞消化液消化细胞。取5~10万重悬的细胞,1 000 r/min离心5 min,弃上清液,加入195 μl Annexin V-FITC结合液轻轻重悬细胞。加入5 μl Annexin V-FITC,轻轻混匀。加入10 μl碘化丙啶(PI)染色液,轻轻混匀。室温避光孵育10~20 min,随后置于冰浴中,使用铝箔避光。采用流式细胞仪检测,Annexin V-FITC 为绿色荧光(为凋亡图横坐标),碘化丙啶为红色荧光(为凋亡图纵坐标)。计算细胞总凋亡率=早期凋亡细胞百分率+晚期凋亡细胞百分率。
1.2.7 蛋白免疫印迹(Western blot,WB)检测研究蛋白的表达 采用RIPA裂解每组样品抽提总蛋白,根据BCA试剂盒说明书进行蛋白定量。每组细胞取50 μg蛋白上样,在10%的SDS-PAGE中进行电泳2 h,然后将蛋白转膜至甲醇预处理的PVDF膜1 h,以5%脱脂奶粉在室温下封闭1 h,加入1∶1 000稀释的一抗,4 ℃孵育过夜,次日PBST漂洗3次,每次10 min,加入1∶5 000稀释的HRP标记的二抗室温孵育2 h,PBST漂洗3次,每次10 min后,用ECL化学发光液曝光显色,利用Image J 1.8.0分析各条带灰度值。

2 结果
2.1 ATO不同敏感性骨髓瘤细胞的NEAT1表达比较 如表1所示,各种骨髓瘤细胞对ATO的抑制率显著不同。与0 μM ATO处理比较,各骨髓瘤细胞均在15 μM ATO处理下出现显著抑制,且ATO对各种骨髓瘤细胞抑制率由大到小(敏感性)顺序为:OPM2>RPMI8226>U266>KM3。

表1 骨髓瘤细胞在不同浓度ATO培养下的抑制率(中位数)比较(n=5)
利用qPCR检测,以OPM2为对照组细胞,OPM2的NEAT1相对表达倍数为1.00±0.062(n=3),U266为1.73±0.13(n=3),RPMI8226为3.45±0.43(n=3),KM3为6.91±0.17(n=3),其中KM3细胞株表达NEAT1含量最高,ATO敏感性最差,以此细胞株作为后续研究对象。
鉴于KM3细胞在15 μM ATO处理下出现抑制现象,因此选择15 μM ATO浓度处理。利用qPCR检测发现:处理细胞NEAT1表达倍数显著低于未处理细胞(0.54±0.059vs.1.00±0.25,t=3.09,P=0.037,n=3),表明ATO可显著下调NEAT1表达。
2.2 NEAT1敲减组KM3细胞与对照组KM3细胞在不同浓度ATO处理下的抑制率比较 与对照组细胞相比,NEAT1敲减组KM3细胞ATO敏感性显著增加。对照组细胞在15 μM ATO处理下出现抑制,而敲减组细胞5 μM即出现明显抑制,并且各药物浓度下的抑制率也大幅增加,详见表2。

表2 KM3对照组细胞及NEAT1敲减组细胞在不同ATO浓度处理下抑制率比较(n=5)
2.3 NEAT1敲减组KM3细胞与对照组KM3细胞在不同浓度ATO处理下的凋亡率比较 利用流式细胞仪检测细胞凋亡发现:未用ATO(0 μM)处理的对照组细胞和敲减组细胞,敲减组细胞凋亡率显著高于对照组细胞(17.14%±1.50%vs.8.44%±0.40%,t=9.68,P=0.000 6)。15 μM ATO处理后,敲减组细胞凋亡率显著高于对照组细胞(41.75%±2.98%vs.26.04%±0.76%,t=8.86,P=0.000 9),见图1。此外,蛋白免疫印迹检测也证实ATO处理后,NEAT1敲减组KM3的促凋亡分子Bax表达上调,抗凋亡分子Bcl-2表达下调,见图2。

图1 NEAT1敲减组与对照组ATO诱导凋亡比较(n=3)
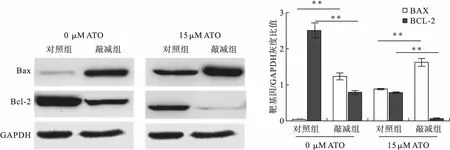
图2 NEAT1敲减组与对照组ATO诱导凋亡蛋白表达比较(n=3)注:**与对照组比较,P<0.01
2.4 NEAT1敲减细胞株与对照株细胞Notch信号通路活化比较 未用ATO处理,我们发现敲减组细胞Notch信号通路较对照组减低。用15 μM ATO处理后,对照组Notch信号更为减低,且敲减组抑制显著,见图3。
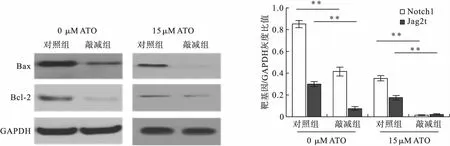
图3 NEAT1敲减组与对照组ATO抑制Notch信号通路比较(n=3)注:**与对照组比较,P<0.01
2.5 NEAT1调控Notch信号通路与ADAM10、PRKD2相关 利用qPCR检测在对照组及敲减组中Notch1相关调节基因的表达变化,结果显示,与对照组比较,敲减组Notch1及Jag2表达下调,同时ADAM10及PRKD2表达显著下调,见表3。

表3 NEAT1敲减组与对照组Notch相关调节基因表达比较(n=3)
3 讨论
砷在传统医学中用于治疗溃疡、瘟疫及疟疾等疾病已有上百年历史[9]。现代医学中,ATO被用于治疗多种疾病如急性早幼粒细胞白血病、淋巴瘤、骨髓瘤及肝癌等。II/III期临床研究表明,ATO联合其他药物可显著提高多发性骨髓瘤疗效,尤其对复发/难治性患者效果显著[13-14]。本研究将骨髓瘤细胞与不同浓度ATO进行体外培养,发现各细胞对ATO敏感性不同,但在15 μM浓度处均出现明显抑制效应,抑制率为36.94%~73.91%,证实ATO对骨髓瘤细胞有抑制效应。
ATO对骨髓瘤细胞具有抑制活性,已有研究显示,ATO 可以抑制NF-kB、JAK/STAT3及Notch信号通路[15-17]。本实验也证实ATO可抑制Notch信号通路成员Notch1和Jag2。近年来研究发现,Notch在各实体肿瘤与血液肿瘤中参与调节肿瘤细胞的化疗敏感性[18-20],提示ATO对骨髓瘤细胞抑制作用依赖Notch信号通路。
长链非编码RNA在肿瘤发生、发展中起到关键作用。有报道,长链非编码RNA NEAT1可调控Notch信号通路[21-22],并且NEAT1与肿瘤耐药性有关。因此,推测ATO处理骨髓瘤细胞后可引起NEAT1表达变化,进而导致Notch信号通路变化,发生耐药表型。本研究发现,骨髓瘤细胞对ATO耐药敏感性与NEAT1表达相关,并且ATO可抑制NEAT1表达,提示NEAT1是ATO重要作用靶点。后续试验发现NEAT1敲减细胞较对照细胞对ATO处理更为敏感,ATO抑制率大幅提高。流式细胞凋亡试验和蛋白免疫印迹检测也发现,NEAT1敲减组较对照组诱导产生更多凋亡细胞,ATO处理后NEAT1敲减组凋亡率更进一步提高,表明ATO介导NEAT1下调在诱导细胞凋亡中起到关键作用。
近年来研究发现,Notch信号通路可受ADAM10及PRKD2上游分子调控。有报道,ADAM10在乳腺癌中可以通过激活Notch信号通路,调节患者新辅助化疗反应和预后[19]。而在肠癌发生过程中,ADAM10异常表达,上调Notch信号通路[20]。在多发性骨髓瘤的研究中,ADAM10在癌症微环境的炎症和血管形成中起重要作用[21]。PRKD2是Notch信号通路的另一重要调节分子,在急性髓系白血病研究中,发现PRKD2可以通过上调Notch信号通路促进癌细胞增殖及化疗药物抵抗[22]。由此可见,ADAM10及PRKD2是Notch信号通路的重要调节因子。为进一步解析NEAT1与Notch信号通路的关系,本研究也检测了敲减组和对照组骨髓瘤细胞中Notch信号通路上游调节因子ADAM10及PRKD2基因表达情况。结果表明,敲减组细胞ADAM10和PRKD2显著下降,NEAT1可能通过上游调节因子作用于Notch信号通路,但需要进一步研究证实。
综上所述,本研究发现,ATO可通过NEAT1及Notch信号通路表达显著抑制骨髓瘤细胞体外生长,并诱导其凋亡。本研究为ATO临床应用提供实验依据,并为增强其疗效提供精准分子靶点。

