喜树叶斑病病原菌鉴定及其防治药剂筛选
宁 平,黄艳花,黄 微,2,邢政杰,陈 婵,王小欣
(1.广西农业职业技术大学,南宁 530007;2.广西南宁合一生物防治技术有限公司,南宁 530007)
【研究意义】喜树(Camptothecaacuminata)别名旱莲、千丈树,是蓝果树科喜树属植物[1]。喜树速生丰产,既是观赏绿化树又是抗癌中药材,在我国湖南、湖北、云南、四川、贵州、广西和广东等地均有栽培[2]。1969年Monron从喜树皮中分离出喜树碱,经肿瘤实验证实这种生物碱具有抗癌活性[3]。由于喜树碱在医学上的巨大作用,科学界一直在研究喜树碱的抗癌效果和作用机理[4]、喜树叶片中喜树碱含量的变化情况[5]、喜树碱对部分植物病虫的杀虫杀菌作用[6]。随着市场对喜树碱的需求越来越大,喜树的栽培研究也显得极为重要,并在1999年被列为国家Ⅱ级重点保护植物[7]。自2017年广西农业职业技术大学中草药园引种喜树以来,连续几年均发生较严重的叶斑病,其中,每年的7—10月在植株中下部叶片发病较重,上部嫩叶发病较轻,发病初期叶片出现淡褐色小斑点,叶片成熟后病斑增多,大部分病斑早期淡褐色形状不规则,边缘不清晰,后期病斑深褐色边缘清晰;叶片越老病斑越多,有的叶片多个病斑连成一片形成不规则大病斑,最后叶片发黄干枯,容易脱落。但目前关于喜树叶斑病的研究报道较少。因此,鉴定喜树叶斑病病原菌,对开展大田喜树叶斑病精准防控具有重要意义。【前人研究进展】关于喜树病害研究,胡一鸣等[8]发现浙江流行的喜树角斑病是由棉花叶点菌(Phyllostictagossypina)、黄麻褐斑菌(P.corchori)和细交链孢(Alternariatenuis)3种真菌复合侵染引起;张月季[9]研究发现,杭州地区的喜树角斑病是由拟尾孢菌(Pseudocercosporacamptothecae)侵染引起;韦文传等[10]研究认为,广西东兰地区的喜树褐斑病致病菌是尾孢菌(Cercosporacamptothecae);许晓平等[11]明确了南京市东善桥林场的喜树溃疡病为拟茎点霉属(Phomopsissp.)真菌侵染所致。Lin等[12]研究喜树内生真菌的种类,从喜树中分离到与C.cassiicola同源性很高的真菌,但未进行致病性测定。多主棒孢霉(Corynesporacassiicola)寄主范围较广,能侵染530多种植物[13],主要侵染热带及亚热带地区的香蕉[14-15]、辣木[16]、橡胶树[17-18]、番茄[19]、苦瓜[20]、黄脉爵床[21]、广藿香[22]等引发叶斑病。在喜树叶斑病发生初期,因症状不明显而容易错过防治时期,多主棒孢霉引起的叶斑病在热带及亚热带地区大面积栽培的香蕉、橡胶树和烟草上已逐渐上升为主要病害[15,17,23]。在棒孢霉叶斑病防治方面,番华彩等[14]使用7种杀菌剂对云南香蕉棒孢霉叶斑病进行室内毒力测定,发现抑菌效果较佳的是丙环唑、多抗霉素和苯甲·丙环唑。谢昌平等[17]使用14种不同杀菌机理杀菌剂对海南橡胶树叶斑病的棒孢霉进行室内毒力测定,发现多菌灵的抑菌效果最佳;陈鑫[23]开展涪陵烤烟棒孢霉叶斑病田间药剂筛选研究,发现化学防治效果较好,而生物农药枯草芽孢杆菌和木霉菌的防治效果不理想。【本研究切入点】喜树叶斑病的病原种类复杂多样,而目前对广西南宁地区喜树叶斑病的病原尚不明确,国内外至今没有棒孢霉引起喜树叶斑病及其有效防治药剂筛选的相关报道。【拟解决的关键问题】通过分离喜树叶斑病病原菌,经柯赫氏法则验证,结合形态特征及分子鉴定,明确其病原菌的种类,进一步通过室内毒力测定筛选出防治喜树叶斑病的有效杀菌剂,为大田喜树叶斑病的综合防治提供科学依据。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 喜树叶斑病病叶和健康叶片均于2017年9月采自广西农业职业技术大学中草药园(东经108°21′,北纬22°49′)。
1.1.2 杀菌剂 供试杀菌剂12种,分别为三唑类20%戊菌唑水乳剂(海利尔药业集团股份有限公司)、250 g/L丙环唑乳油(招远三联化工厂有限公司)和10%苯醚甲环唑水分散粒剂(先正达南通作物保护有限公司);咪唑类的20%抑霉唑水乳剂(一帆生物科技集团有限公司)和450 g/L咪鲜胺水乳剂(上海沪联生物药业夏邑股份有限公司);苯并咪唑衍生物类的50%多菌灵可湿性粉剂(四川润尔科技有限公司);吡咯类的50%咯菌腈可湿性粉剂(先正达中国投资有限公司);抗生素类的10%多抗霉素可湿性粉剂(住商农资广州有限公司);甲氧基丙烯酸酯类的250 g/L吡唑醚菌酯乳油(巴斯夫植物保护江苏有限公司);三唑类与甲氧基丙烯酸酯类复配的30%苯甲·吡唑酯悬浮剂(江苏耘农化工有限公司)和325 g/L苯甲·嘧菌酯悬浮剂(先正达南通作物保护有限公司);三唑类与咪唑类复配的20%苯甲·咪鲜胺微乳剂(山东中新科农生物科技有限公司)。
1.2 试验方法
1.2.1 病原菌分离与纯化 采用常规组织分离法[24]剪取喜树叶片病健交界处约4 mm×4 mm大小的病害样本组织,经75%酒精消毒30 s,10%次氯酸钠溶液浸泡1 min,用无菌水漂洗3次,然后转至马铃薯蔗糖培养基(PSA培养基)上,置于28 ℃恒温培养箱培养3~5 d,待长出菌落后,在菌落边缘用接种针挑取菌丝转移到新的PSA培养基上培养,单孢分离纯化后转移至PSA斜面试管中,28 ℃恒温培养箱培养5 d后置于4 ℃冰箱保藏备用。
1.2.2 病原菌致病性测定 菌丝块离体叶片接种法:摘取新鲜且健康的喜树叶片,无菌水冲洗3次,放入铺有灭菌纸巾的托盘中,加无菌水湿润。用直径5 mm的打孔器在PSA培养基上培养7 d的菌落边缘打孔,并将菌丝块接种到叶片上,以保鲜膜密封保湿,置于28 ℃下恒温培养,每个菌株接种5张叶片,3个重复,并用空白PSA琼脂块接种作为对照。接种发病后用挑针移去菌丝块,并连续观察发病情况。
孢子液离体叶片和活体叶片接种法:将病原菌的菌丝块接种到PSA培养基上使其产生分生孢子,产孢后加无菌水将分生孢子洗下来,用纱布将菌丝过滤,用血球计数板将孢子液浓度调为1×106个/mL,并添加吐温使其终浓度为0.1%左右。离体叶片接种在室内恒温条件下进行,采集健康无病的喜树嫩叶置于铺有灭菌吸水纸的托盘上,加无菌水保湿,用移液枪将配好的分生孢子液20 μL滴在喜树叶片上,以滴无菌水的叶片为对照,接种叶片置于恒温条件下保湿培养。每个菌株接种5片叶片,3个重复。活体接种在室外喜树植株上进行,选择健康无病的嫩叶,在叶片上放置一小团无菌棉花,点接20 μL分生孢子液,然后喷施少量无菌水套袋保湿,观察并记录叶片发病情况。
从接种发病叶片的病健交界处剪取大小约为4 mm×4 mm的组织,用常规组织分离法对病原菌进行再分离,然后鉴定再次分离到的病菌与接种用的菌株形态是否一致,完成柯赫氏法则验证。
1.2.3 病原菌形态特征观察 将直径5 mm的菌丝块接种到PSA培养基上,在28 ℃恒温培养箱下培养,观察病原菌的菌落特征及有无分生孢子产生。将滤纸剪成与载玻片一般大小,并在滤纸中央剪出1 cm×2 cm的长方形窗口,将裁好的长方形滤纸放在载玻片上,在90 mm培养皿中叠放3层吸水纸,添加少量蒸馏水湿润,然后将带有滤纸片的载玻片放入培养皿中,湿热(121 ℃)灭菌30 min。用挑针从活化5 d的菌落边缘取细碎菌丝块置于滤纸窗口的四周,28 ℃恒温光照条件下培养,待孢子产生后在光学显微镜下测量分生孢子大小。
1.2.4 分子生物学鉴定 委托广西南宁国拓生物科技有限公司完成病原菌DNA提取,然后采用真菌核糖体DNA通用引物ITS1和ITS4对rDNA-ITS区域进行PCR扩增,引物序列ITS1为5′-TCCGTAGGTGAACCTGCGG-3′,ITS4为S′-TCCTCCGCTTATTGATATGC-3′。将PCR产物送至生工生物(上海)股份有限公司进行纯化和双向测序。将测序结果进行拼接后在NCBI数据库中进行BLAST比对,下载相关序列,进行同源性比较,采用邻接法运用MEGA 7.0构建系统发育进化树,自举重复(Bootstrap replication)设置为1000次。
1.2.5 不同杀菌剂对病原菌的室内毒力测定 利用菌丝生长速率法对12种杀菌剂按照倍数法稀释成不同浓度的母液,再从每个倍数的母液中吸取0.5 mL加入至49.5 mL的PSA培养基中制作成含药培养基,药剂终浓度见表1,再将培养7 d的病原菌用打孔器打出5 mm直径的菌饼,接种到含药培养基上,每个处理3个重复,以不加药的PSA培养基为对照,27 ℃培养箱暗培养7 d后以十字交叉法测量菌落直径,计算各杀菌剂的抑菌率。
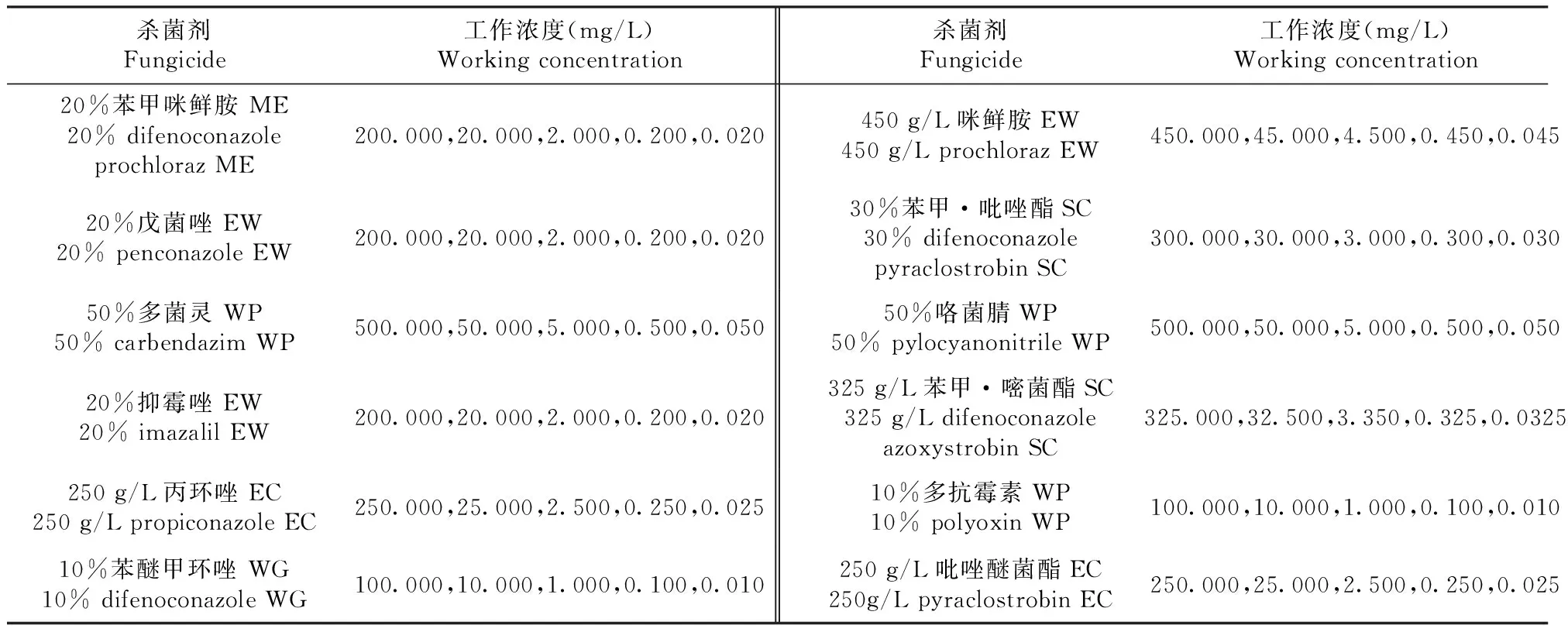
表1 12种杀菌剂的稀释浓度Table 1 Dilution concentration for 12 fungicides
抑菌率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径)×100
1.3 数据处理
用浙大DPS数据处理系统分析药剂终浓度对数值(x)和对应菌丝生长抑菌率的机率值(y),根据不同杀菌剂对棒孢霉菌丝生长的毒力回归方程y=a+bx计算各供试药剂对病原菌的致死中浓度EC50。
2 结果与分析
2.1 病原物的分离及致病性测定
对采集的喜树叶斑病病叶(图1-A、1-B和1-C)进行分离培养,获得3株菌落形态不同的菌株,将3株菌株分别回接到健康喜树叶片上,用菌丝块刺伤接种,发现只有分离频率最高的菌株XS-1成功侵染,发病率达100%,发病症状如图1-D。菌株XS-1接种2 d后健康喜树叶片即发病,继续培养后病斑逐渐变大、变褐色后再变黑褐色,而对照叶片不发病。培养出分生孢子后,用分生孢子液进行接种,发病症状如图1-E,通过对接种发病叶片再分离,获得与菌株XS-1形态相同的菌株,证实菌株XS-1为喜树叶斑病病原菌。
2.2 病原菌鉴定
2.2.1 病原菌形态特征 形态学观察结果表明,菌株XS-1在PSA培养基上的菌落均为圆形,有同心轮纹,气生菌丝灰色,生长茂盛(图1-F),菌落背面中央灰褐色并隆起,边缘灰白色(图1-G);分生孢子梗浅灰褐色,有单生偶尔有分枝,有隔膜;分生孢子串生,链状,棒棍状至圆筒形,长短差异较明显(图1-H),大小为(24.1~196.5)μm×(3.5~10.0)μm,平均长(81.8±37.9)μm,平均宽(7.2±1.2)μm(n=98),无色至橄榄褐色,壁平滑,具有假隔膜。结合菌落形态和分生孢子特征并参考魏景超[25]的研究结果,将菌株XS-1鉴定为棒孢霉属(Corynespora)真菌。

A:喜树叶斑病田间发病症状;B:叶片正面症状;C:叶片背面症状;D:菌丝块离体接种发病症状;E:田间活体植株叶片孢子液接种发病症状;F:病原菌菌落正面形态;G:病原菌菌落反面形态;H:病原菌分生孢子梗和分生孢子;bar=20 μmA:Symptoms of leaf spot disease of C.acuminata in the field;B:Disease symptoms of the upper surface of leaf;C:Disease symptoms of the lower surface of leaf;D:Symptoms of leaf by artificial incubation with mycelial plugs;E:Symptoms of C.acuminata leaves inoculated with conidial suspensions on detached leaves and attached leaves;F:Colony morphology of upper side on PSA;G:Morphology of colony on reverse side of PSA;H:Conidiophore and conidia;bar=20 μm图1 喜树叶斑病田间发病症状、致病性测定及病原菌XS-1的形态特征Fig.1 Symptoms of leaf spot disease on C.acuminata and morphological characteristics of strain XS-1
2.2.2 病原菌rDNA-ITS序列分析 将菌株XS-1的ITS序列提交到NCBI的GenBank数据库进行同源性比对,结果表明,病原菌XS-1的ITS序列与GenBank的多主棒孢霉(C.cassiicola)相似性在99%以上。根据比对结果,选择棒孢霉属不同种菌株的ITS序列构建系统发育进化树(图2),菌株XS-1与C.cassiicola(HQ64107、EF198116、FJ85257和KF26678)在同一分支上,结合形态学观察和rDNA-ITS序列分析结果,将菌株XS-1初步鉴定为多主棒孢霉,即喜树发生的叶斑病为喜树棒孢霉叶斑病。
2.3 防治药剂室内筛选
室内药剂筛选结果(表2)表明,12种杀菌剂对菌株XS-1菌丝生长均具有抑制作用,但抑菌效果存在明显差异,其中,20%苯甲·咪鲜胺的抑制作用最强,其次是20%戊菌唑、50%多菌灵、20%抑霉唑、250 g/L丙环唑和10%苯醚甲环唑,其EC50分别为0.0980、0.3737、0.4557、0.4878、0.5746和0.5956 mg/L,这几种杀菌剂均可用于喜树棒孢霉叶斑病防治;而250 g/L吡唑醚菌酯的EC50为3.8588 mg/L,抑菌效果最差,10%多抗霉素、325 g/L苯甲·嘧菌酯、50%咯菌腈、30%苯甲·吡唑酯和450 g/L咪鲜胺的EC50分别为1.7516、1.4503、1.0844、1.0628和0.9166 mg/L,抑菌效果也较差。
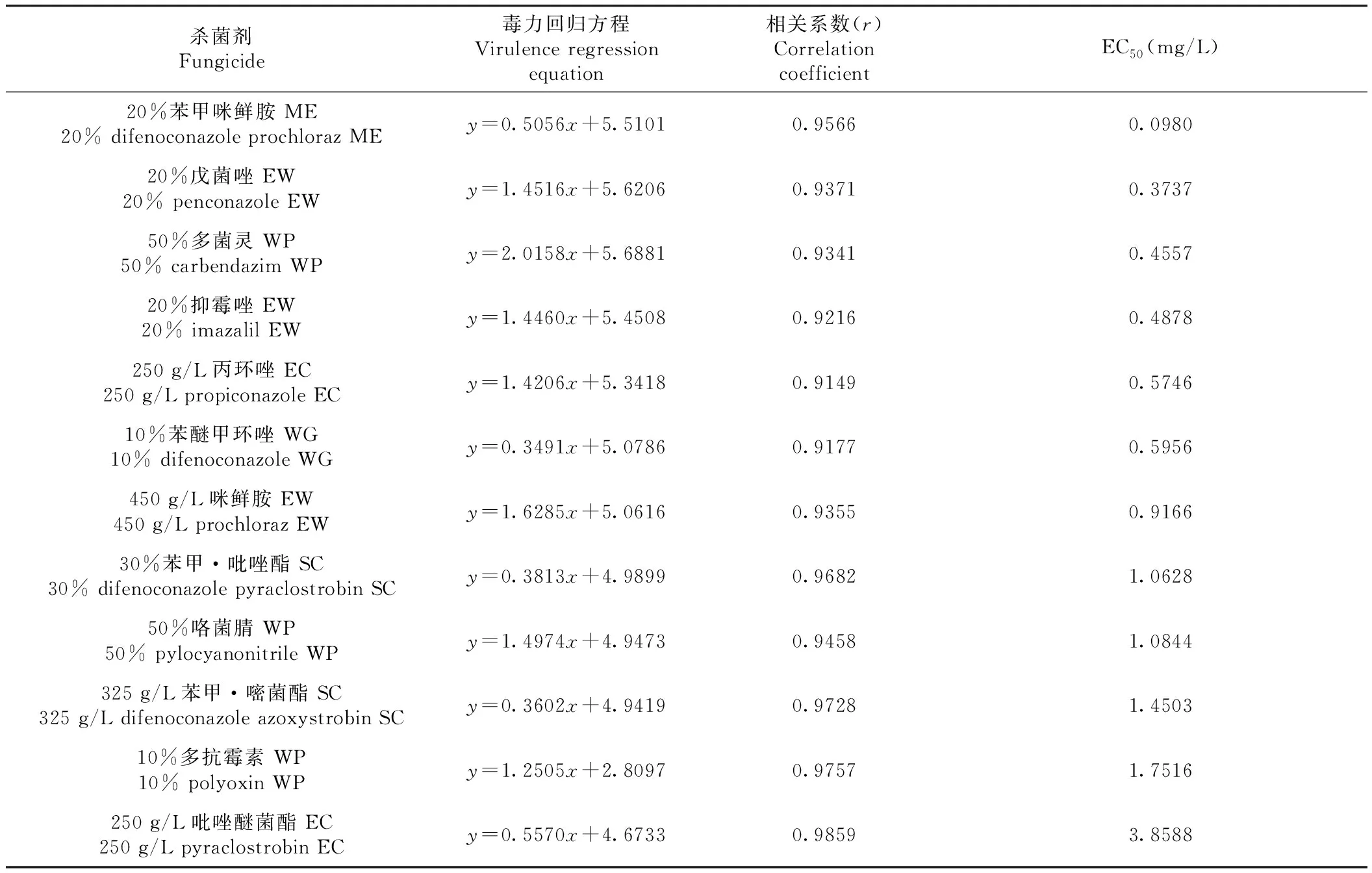
表2 12种杀菌剂对菌株XS-1菌丝生长的毒力测定Table 2 Inhibition effects of 12 fungicides against the myceilial growth of XS-1
3 讨 论
目前国内外已报道的喜树叶斑病病原菌种类有棉花叶点菌、黄麻褐斑菌、细交链孢、拟尾孢菌、尾孢菌和拟茎点霉[8-11],其中,在浙江地区流行的喜树角斑病是多种病原菌复合侵染的结果[8],与杭州地区发现的喜树叶斑病田间症状[9]相似,但病原不同。本研究中,经致病性测定、形态特征观察和rDNA-ITS序列分析,确定引起广西南宁地区喜树叶斑病的病原菌为多主棒孢霉,在国内为首次报道。采用形态学观察与分子鉴定相结合是鉴定棒孢霉较可靠的方法,在形态学观察的基础上,结合rDNA-ITS序列系统发育进化树分析可确定其分类地位[26]。
关于棒孢霉叶斑病的防治研究,番华彩等[14]用7种杀菌剂对云南香蕉棒孢霉叶斑病进行室内毒力测定,结果发现抑菌效果较好的是丙环唑、多抗霉素和苯甲·丙环唑,丙森锌、氟硅唑和乙蒜素次之,而嘧菌酯的抑菌效果最差;陈鑫[23]研究表明,化学药剂对涪陵烤烟棒孢霉叶斑病的田间防治效果优于生物农药。本研究发现,三唑类杀菌剂(20%戊菌唑、250 g/L丙环唑、10%苯醚甲环唑)对菌株XS-1的杀菌效果较好,甲氧基丙烯类杀菌剂(250 g/L吡唑醚菌酯)对菌株XS-1的杀菌效果较差,与番华彩[14]的研究结果一致。谢昌平等[17]用14种不同杀菌机理杀菌剂对海南橡胶树叶斑病的棒孢霉进行室内毒力测定,结果发现多菌灵的抑菌效果最好,其EC50为0.4472 mg/L,丙环唑的抑菌效果优于苯醚甲环唑。本研究结果与谢昌平等[17]的研究结果相似,使用3种三唑类杀菌剂及咪唑类杀菌剂中的20%抑霉唑的杀菌效果均优于450 g/L咪鲜胺,另外2种不同杀菌机理的50%咯菌腈和250 g/L吡唑醚菌酯的杀菌效果相对较差;比较6种不同杀菌机理杀菌剂对喜树棒孢霉叶斑病病原菌菌丝生长的抑菌效果,总体上以三唑类、苯并咪唑衍生物类和咪唑类较好,吡咯类一般,抗生素类和甲氧基丙烯酸酯类较差。本研究还发现,复配杀菌剂的抑菌活性不一定强于单剂杀菌剂,其中,10%苯醚甲环唑的EC50为0.5956 mg/L,明显低于复配杀菌剂325 g/L苯甲·嘧菌酯悬浮剂(含125 g/L苯醚甲环唑和200 g/L嘧菌酯)和30%苯甲·吡唑酯悬浮剂(含苯醚甲环唑22%和吡唑嘧菌酯8%)的EC50,可能与甲氧基丙烯酸酯类中的嘧菌酯和吡唑醚菌酯对棒孢霉的抑菌效果不佳而影响复配后的杀菌效果有关;而复配杀菌剂20%苯甲·咪鲜胺微乳剂(含苯醚甲环唑5%和咪鲜胺唑15%)的EC50为0.0980 mg/L,均明显低于单剂的10%苯醚甲环唑或450 g/L咪鲜胺的EC50,说明单剂的10%苯醚甲环唑与450 g/L咪鲜胺复配为20%苯甲·咪鲜胺微乳剂能发挥杀菌增效作用,可作为防治喜树棒孢霉叶斑病的首选药剂。
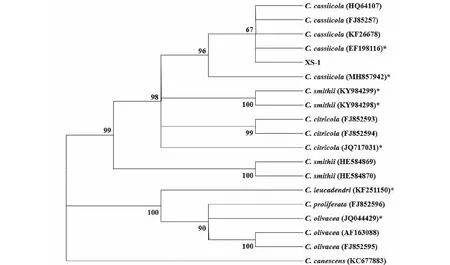
*为模式菌株* represented model strain图2 喜树叶斑病病原菌的系统发育进化树Fig.2 Phylogenetic relationships of C. cassiicola tree based on rDNA-ITS sequences
4 结 论
经致病性测定、形态特征观察和分子鉴定,确定引起喜树叶斑病的病原菌为多主棒孢霉(C.cassiicola);20%苯甲·咪鲜胺微乳剂、20%戊菌唑水乳剂、50%多菌灵可湿性粉剂、20%抑霉唑水乳剂、250 g/L丙环唑乳油和10%苯醚甲环唑水分散粒剂对喜树棒孢霉菌丝生长均具有较强的抑制作用,可作为喜树棒孢霉叶斑病田间防治参考用药。

