淋巴细胞与中性粒细胞比值对食管鳞癌患者同步放化疗疗效及预后判断的临床意义
陈阳 陈方 施朕善 王磊
食管癌是常见的恶性肿瘤之一,我国食管癌发病率高、病情进展快、死亡率较高,严重影响患者的生命安全[1]。食管癌病情较为隐匿,初期临床症状少,不易被察觉,大多数患者就诊时,病情已处于中晚期,已错手术治疗机会,常采用放疗或者放疗联合其他治疗[2⁃3]。同步放化疗为食管癌治疗中常见的治疗方式之一,能够控制肿瘤的发展,延长患者生存时间,但治疗后患者的具体疗效及预后却难以准确评估。相关研究表明淋巴细胞与中性粒细胞比值(neutrophil to lymphocyte ratio,NLR)与多种恶性肿瘤的治疗效果及预后具有一定相关性,如胃癌、肝癌、鼻咽癌等,能够为疾病的治疗提供相关依据[4]。本次研究中探讨了NLR 对食管鳞癌患者同步放化疗疗效及预后判断的价值,报道如下。
1 对象
1.1 研究对象
选取2018年3月至2021年9月间安徽省亳州市人民医院肿瘤科收治的122 例食管鳞癌患者为研究对象。其中男性患者76 例,女性患者46 例,平均年龄(72.16±6.52)岁,卡氏功能状态评分(Karnof⁃sky,KPS)为70~100 分[5]。 所有患者均接受同步放化疗。纳入标准:①18 岁≤年龄≤85 岁,性别不限;②经临床及病理检查确诊为食管鳞癌,符合食管鳞癌诊断标准;③可接受放化疗;④食管病灶长度<10 cm,且未侵犯主支气管;⑤精神状态良好,可积极配合各项检查及治疗;⑥预计生存期超过3 个月;⑦临床资料完整。排除标准:①未经确诊的患者;②合并感染的患者;③存在精神类疾病,意识不清者,无法配合治疗者。该研究经医院伦理学审批同意。NLR 最佳截断值为3.29,低NLR 组(NLR<3.29)为82 例,高NLR 组(NLR≥3.29)为40 例。本实验经医院伦理委员会批准。所有患者或家属均签订知情同意书。
1.2 方法
1.2.1 实验方法
患者放疗前1周内抽取抽取患者静脉血5 mL,进行血常规检查,并计算NLR曲线,并依据NLR最佳截断值为3.29,ROC 的检验变量为NLR,状态变量为患者的预后情况,预后良好设为0,预后不良设为1。
1.2.2 治疗方法
所有患者均行同步放化疗,采用Manaco 5.11治疗计划系统设计靶区。采用TiGRT IVS 放射治疗图像引导系统进行图像引导放射治疗(IGRT),该系统分辨率高,集成了胶片及电子射野影像装置的射野记录与验证功能,能快速实现患者的位置验证。固定野调强,最大剂量率700 MU/min。选择医科达(synergy)直线加速器6MV 光子束,临床靶区的处方剂量为2.0 Gy/次,总剂量为60~64 Gy,1 次/d,5 d/周,共30~33 次。剂量限制:脊髓最大点剂量Dmax≤45 Gy,双肺V20≤30%、V30<20%、双肺平均受量≤13 Gy,心脏V30<40%、V40<30%、Dmean<30 Gy。危及器官优化结果难以满足预设条件时,优先顺序为双肺>脊髓>心脏。同时给与化学药物进行治疗,采用氟尿嘧啶类药物同步化疗(口服卡培他滨或替吉奥胶囊),具体用法:卡培他滨(厂家:江苏恒瑞医药股份有限公司;批号:220108KB)1 000 mg/m2口服周一到周五给药,替吉奥胶囊(厂家:江苏恒瑞医药股份有限公司;批号:211116N.J)40 mg/m2口服BID 周一到周五给药;直至放疗结束。
1.3 随访情况
治疗结束后每3 个月进行一次随访,主要通过电话、邮件及门诊复查的方式进行,随访的内容主要包括患者的生存状况、进食状况、实验室检查、超声、CT 等。
1.4 观察指标
采用实体瘤疗效评价标准(Response Evalua⁃tion Criteria in Solid Tumors)[6]进行评价,该标准将治疗效果共分四个级别,分别为完全缓解(com⁃plete remission,CR):病灶全部消失;病情进展(progress disease,PD):出现新的病灶,病灶直径总和增加≥20%;部分缓解(partial remission,PR):所有靶病灶的直径缩小30%及以上;疾病稳定(sta⁃ble disease,SD):病情相对较为稳定,所有病灶总直径缩小程度未达到30%,病灶总直径增及以上。临床有效率=(CR+PR)/总例数×100%。
肿瘤的分期采用第8 版TNM 分期标准[7]。原发〔T〕TX:原发无法评价T0:没有原发肿瘤的证据;Tis:高级别上皮内瘤变/异型增生;T1a:侵犯黏膜固有层或黏膜肌层;T1b:侵犯黏膜下层;T2:侵犯固有肌层;T3:肿瘤侵及食管纤维膜;T4a:侵及胸膜、心包、奇静脉、膈肌或腹膜;T4b:侵犯邻近组织结构;区域淋巴结〔N〕NX:区域淋巴结无法评价;N0:区域淋巴结无转移;N1:1⁃2 个区域淋巴结有转移;N2:3⁃6 个区域淋巴结有转移;N3:7 个及7个以上区域淋巴结转移。
远处转移〔M〕M0:无远处转移;M1:存在远处转移。
分期:0 期:TisN0M0;Ⅰ期:T1N0⁃1M0;Ⅱ期:T2N0⁃1M0、T3N0M0;Ⅲ期:T3N1M0、T1⁃3N2M0;ⅣA 期:任何T4N0⁃2M0 任何TN3M0;ⅣB 期:任何T 任何NM1。
1.5 统计学方法
采用SPSS 26.0 统计软件对数据进行处理。计量资料以()表示,组间比较采用独立样本t检验,计数资料以n(%)表示,组间比较采用χ2检验。通过ROC 分析NLR 对食管鳞癌患者同步放化疗疗效及预后判断的价值,并进行Cox 比例风险回归分析,采用Logistics 回归进行多因素分析,P<0.05 为差异有统计学意义。
2 结果
2.1 患者的临床疗效
低NLR 组患者临床有效率明显高于NLR 组,差异有统计学意义(P<0.05)。见表1。
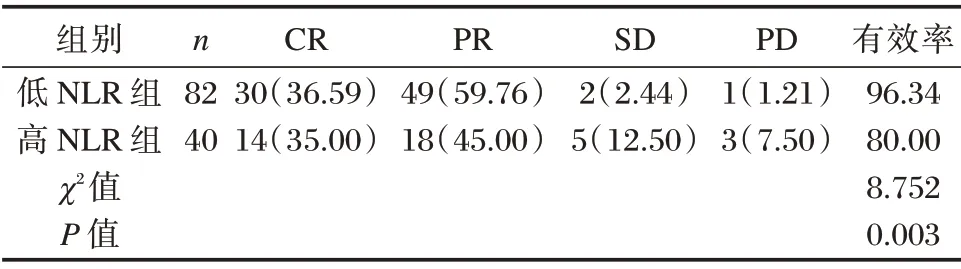
表1 低NLR 组与高NLR 组的临床有效率比较[n(%)]Table 1 Comparison of clinical effective rates between the two groups[n(%)]
2.2 NLR 水平与临床特征
低NLR 组与高NLR 组患者间年龄、性别比较,差异无统计学意义(P>0.05),两组TNM 分期具有统计学意义(P<0.05)。见表2。

表2 低NLR 组与高NLR 组的临床特征比较[n(%)]Table 2 Comparison of clinical characteristics between low NLR group and high NLR group[n(%)]
2.3 影响预后的相关因素
Cox 比例风险回归模型分析,影响患者预后的相关因素主要为NLR 水平、TNM 分期,多因素分析表明影响患者预后的独立危险因素为NLR 水平、TNM 分期。见表3。

表3 Cox 比例风险回归模型分析影响患者预后的因素分析Table 4 Analysis of prognostic factors of image patients by Cox proportional hazards regression model
2.4 诊断价值
NLR 对食管鳞癌预后具有一定的诊断价值(P<0.05)。见表4、图1。

表4 NLR 对食管鳞癌预后的诊断价值Table 4 diagnostic value of NLR in the prognosis of esophageal cancer

图1 ROC 曲线Figure 1 ROC curve
3 讨论
食管鳞癌的发生发展受多种因素的影响,如遗传、生物、环境等,早期的食管鳞癌细胞仅存在于食管的粘膜层,病情较为隐匿,症状比较轻微,患者往往无任何感觉,往往容易被忽略,一般在胃镜检查中被发现[8⁃9]。早发现、早诊断及早治疗是降低死亡率、改善患者预后的重要策略。当出现消瘦、声音嘶哑、吞咽困难等症状时往往已到了病情的中晚期,容易复发及转移,治疗存在一定困难,预后效果不够理想[10]。
目前治疗食管鳞癌的方式越来越多,常见的治疗方式主要有内镜下黏膜剥离术、内镜下黏膜切除术、放疗、化疗、介入治疗及免疫、中医药等综合治疗等[11]。常规放疗往往存在靶剂量不能均匀分布、肿瘤靶体积不能达到所给的处方剂量等问题[12]。IGRT 为新型的放疗技术,通过持续改变机架旋转速度以及多叶准直器的位置来调整各个角度的剂量强度,并且能在机架旋转的同时不间断照射,进一步提高了治疗精度。在本次研究中采用IGRT 对患者进行放疗,取得了良好的治疗效果。
袁俊等[13]研究表明NLR 组患者的放疗有效率高于低NLR 组,NLR 对老年食管癌放疗预后效果的评估具有一定价值。吴佳等[14]研究表明放疗前中性粒细胞与淋巴细胞比值对食管癌患者预后具有一定的评估价值。在本次研究中NLR 最佳截断值为3.29,以该值为标准,将患者分为低NLR 组与高NLR组两个组别,其中低NLR 组为82 例,高NLR 组为40例。经统计,低NLR 组患者临床有效率为96.34%,高NLR 组患者临床有效率为80.00%,差异具有统计学意义。患者整体临床有效率较高,高NLR 组与低NLR 组间有效率存在明显差异,低NLR 患者表现出更好的治疗效果,说明NLR 是与患者预后密切相关的指标,进一步证实了NLR 这一指标作为预测食管鳞癌患者预后的可靠性。Cox 比例风险回归模型分析影响患者预后的因素主要为NLR 水平,Logis⁃tics 多因素分析表明NLR 是影响患者预后的危险因素。提示了NLR 与患者的预后关系密切,进一步说明了NLR 作为食管鳞癌预后评估指标的重要意义。这与之前研究具有一致性,田界勇等[15]研究表明术前NLR 水平对食管鳞癌的预后具有重要意义。
综上所述,NLR 对食管鳞癌患者同步放化疗疗效及预后具有一定的预测价值,可依据NLR 值为患者制定针对行的治疗方案,以提高治疗效果,改善食管鳞癌患者的生存情况。

