CRYAB在肺鳞癌中的表达及其临床意义
卞春安 田晓奇 林超宇 许里
肺鳞状细胞癌(LUSC)是非小细胞肺癌(NSCLC)第二大组织学亚型,不同于肺腺癌,各类针对驱动基因的TKI及免疫治疗药物在肺鳞癌中进展缓慢,晚期肺鳞癌病人的5年生存率小于15%,总体预后不佳[1-2]。 小热休克蛋白(sHsps)是一个庞大的蛋白家族,人类基因组包含10个编码sHsps的基因[3]。其中HspB4(CRYAB)在多种细胞类型中出现异常表达并可针对凋亡刺激、氧化应激等情况调节细胞功能。多项研究指出,CRYAB在乳腺癌、头颈肿瘤、胶质瘤、卵巢癌中同样存在异常表达及其并与肿瘤的多种恶性生物学行为显著相关[4-5]。我们首先采用qPCR法检测20例肺鳞癌组织中的CRYAB mRNA的表达水平,初步证实了CRYAB在肺鳞癌组织中为高表达,进一步采用免疫组织化学法检测了59例肺鳞癌组织芯片中的CRYAB蛋白的表达情况,结合相应病人的临床病例资料,探讨CRYAB表达水平与肺鳞癌病人临床病理特征及预后的关系。
对象与方法
一、对象
标本来源:肺鳞癌病人组织标本20例,为2014年1月~2016年12月收治的肺鳞癌手术病人。免疫组化实验的59例肺鳞癌病人组织芯片购买于上海芯超生物科技有限公司[6]。
肺鳞癌病人组织芯片59例, 男性54例,女性5例,年龄60~78岁;肿瘤直径≥3 cm 56例,<3 cm 3例;病理类型Ⅰ~Ⅱ级43例,Ⅲ~Ⅳ级16例;脉管侵犯4例;淋巴结阳性24例,远处转移1例。TNM分期Ⅰ~Ⅱ期38例,Ⅲ~Ⅳ期21例。随访时间为1~91个月,平均46.8个月。见表1。

表1 CRYAB表达与59例肺鳞癌病人临床病理特征关系(例)
二、方法
1.主要试剂 Trizol购自于Invitrogen公司(Invitrogen,Carlsbad,CA,USA),CRYAB抗体购自Abcam公司(Abcam,Cambridge,MA,USA),免疫组化SP试剂盒和DAB显色试剂盒购自武汉博士德生物工程有限公司(BOSTER,Wuhan,China)。
2.RNA提取根据Trizol试剂盒说明步骤进行[7]。CRYAB引物序列如下:正向 5'-CTT TGA CCA GTT CTT CGG AG-3' ,反向 5'-CCT CAA TCA CAT CTC CCA AC-3';内参基因GAPDH的引物序列如下:正向5'-TGC ACC ACC AAC TGC TTA GC-3',反向 3'-GGC ATG GAC TGT GGT CAT GAG-5'。
3.SP免疫组化检测按照所采购的试剂盒说明书进行[8]。通过免疫组化评分(immunohistochemical scores,IHS)进行判读,以阳性细胞数≤10%判定为阴性,阳性细胞数>10%判定为阳性。免疫组化的结果判定由两个高年资病理科医生共同作出。
三、统计学分析
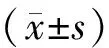
结果
1.20例癌和对应癌旁组织中CRYAB mRNA表达情况见图1。结果显示,癌组织和癌旁组织CRYAB mRNA表达分别为4.456±1.5120和(2.944±0.4907,两组比较其差异有统计学意义(P<0.05)。
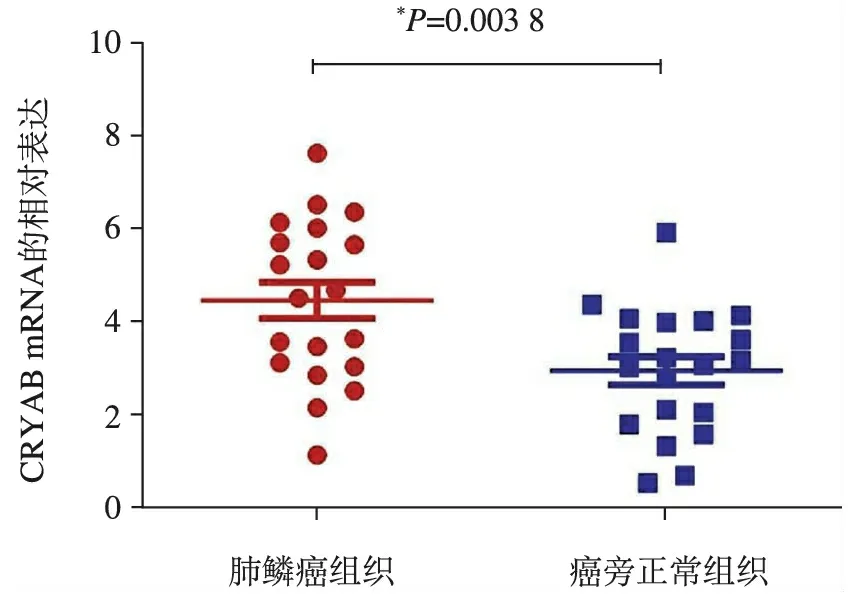
图1 CRYAB mRNA在肺鳞癌组织及癌旁正常组织中的表达
2.免疫组化检测:免疫组化结果显示,59例肺鳞癌病人中,有23例(38.98%)CRYAB蛋白高表达,其表达产物主要位于肿瘤细胞胞浆(图2);对应的癌旁正常组织病例仅有8例(13.56%)显示CRYAB蛋白高表达,其差异有统计学意义(P<0.05)。
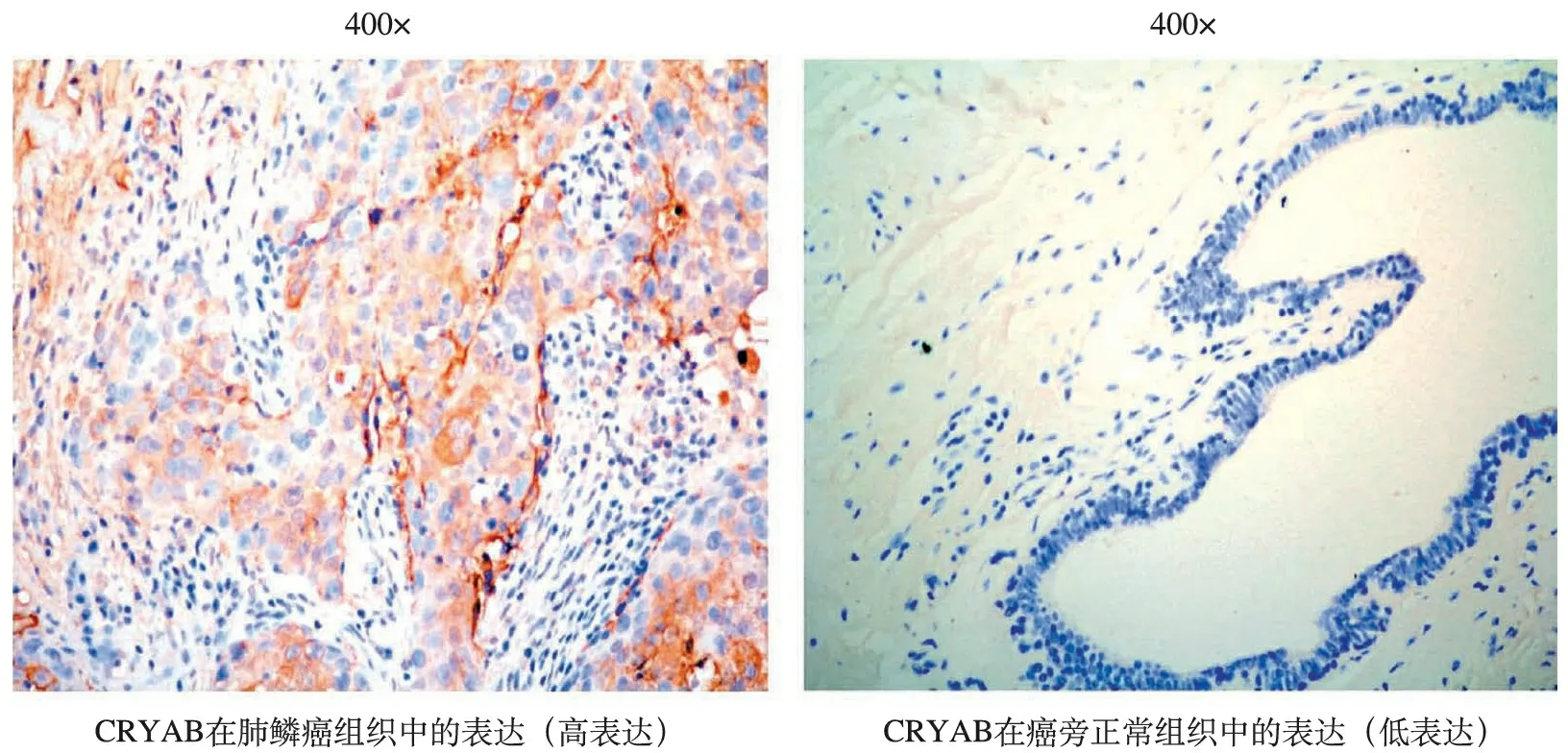
图2 CRYAB在肺鳞癌组织及癌旁正常组织中的表达(SP×400)
3.CRYAB表达与肺鳞癌临床病理特征的关系:CRYAB的表达与LUSC临床指标中T分期显著相关(P<0.05)。见表1。
4.生存分析:单因素分析显示,CRYAB的表达及T分期与病人的总生存期有关(P<0.05)。进一步多因素Cox回归分析证实,CRYAB的表达和T分期是肺鳞癌病人的独立预后因素(P<0.05),见表2。Kaplan-Meier生存曲线显示,肺鳞癌病人中高表达CRYAB的预后不佳(图3)。
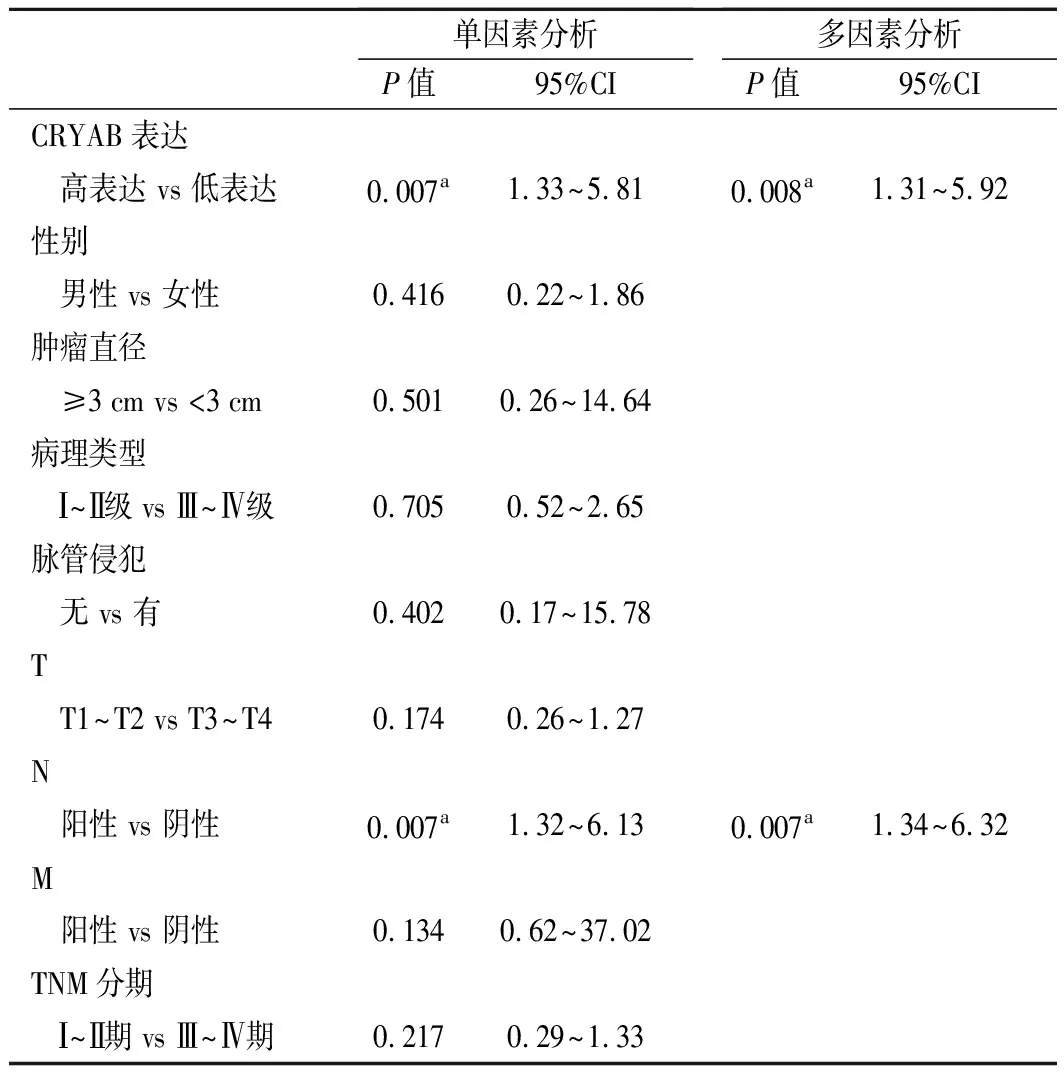
表2 单因素及多因素Cox回归分析预后相关因素

图3 CRYAB及肿瘤直径与病人总生存期的关系
讨论
CRYAB最初被发现存在于眼球晶状体中,同样也在身体的其他部位,例如心脏,骨骼肌,卵巢等有表达[9]。CRYAB可作为分子伴侣,在细胞遇到外在压力如辐射和过氧化时,抑制细胞聚集,防止细胞变性,促进细胞存活,抑制细胞凋亡[10]。近年来,CRYAB与肿瘤发生发展的关系逐渐引起关注[4]。CRYAB可在多种恶性肿瘤异常表达,如头颈肿瘤、乳腺癌、肝癌、肾细胞癌[11-14];CRYAB可促进肿瘤细胞增殖、侵袭和迁移等恶性生物学行为[15];CRYAB高表达的肿瘤病人预后不佳[10]。而关于CRYAB在肿瘤中的作用机制研究亦逐渐深入,Huang等[16]报道,CRYAB可诱导肝癌细胞上皮间质转化,并通过激活ERK1/2/Fra-1/slug信号通路介导索拉非尼耐药;Guo等[17]报道CRYAB可影响M2型肿瘤相关巨噬细胞的极化并促进非小细胞肺癌转移;Ruan等[18]报道,CRYAB可通过促进血管内皮生长因子(VEGF)表达并诱发乳腺癌抗血管治疗抵抗作用。
本研究首先收集了20例肺鳞癌病人的肿瘤组织及对应癌旁组织,通过qPCR检测,了解CRYAB mRNA的表达情况。结果显示,CRYAB mRNA在肺鳞癌组织中的表达水平高于癌旁正常组织,差异有统计学意义;我们进一步使用免疫组化法检测了包含59例肺鳞癌标本及其对应癌旁标本的组织芯片,结果发现CRYAB在肺鳞癌组织中的异常高表达。采用单因素及多因素风险回归模型分析59例肺鳞癌病人预后相关因素。单因素分析提示,CRYAB表达及T分期是预后不良指标;多因素分析表明,CRYAB高表达及T分期是肺鳞癌的不良预后的独立影响因素。以上结果均与关于CRYAB的多项研究结果相符,均提示CRYAB的“促肿瘤”特性并与预后不佳显著相关[7,10-11,15]。有研究表明,CRYAB在鼻咽癌中还可发挥“抑制肿瘤”作用,且CRYAB的表达和头颈部鳞癌预后无关[19-20]。这说明CRYAB在不同类型肿瘤发生发展中功能的多样性及复杂性。本实验样本量偏少,后续仍需收集更多的样本,以期获得更加可靠的实验数据。
综上所述,CRYAB在肺鳞癌组织中异常高表达,CRYAB的表达水平和肺鳞癌的肿瘤直径是肺鳞癌预后的独立危险因素。CRYAB标志物的发现,可为肺鳞癌的诊疗提供新的研究方向。

