长链非编码RNA POIR对多次传代后牙周膜干细胞成骨分化功能的影响
邵 馨,王 爽,宋 扬,吴 凡,王丽颖*
(1西安交通大学口腔医院陕西省颅颌面精准医学研究重点实验室,西安 710004;2西安交通大学口腔医院正畸科;3空军第九八六医院口腔科;4空军第九八六医院心脏外科;*通讯作者,E-mail:710808434@qq.com)
牙周膜干细胞(periodontal ligament stem cells,PDLSCs)是由牙周组织分离培养的间充质干细胞,特定诱导条件下,可以分化为牙周膜组织、骨组织、血管组织和神经组织等[1]。由于PDLSCs特定的组织来源,以及明确的向牙周组织分化的潜能,自2004年一经发现,就被认为是最有牙周再生潜质的成体干细胞[2-4],目前利用PDLSCs修复牙周组织缺损已经进入临床试验阶段[5,6]。
研究表明炎症、高糖等原因会造成PDLSCs骨向分化能力下降,进一步损害PDLSCs牙周缺损修复功能[7,8]。研究中常利用无功能的智齿或正畸牙培养PDLSCs,但原代培养可获取的细胞数量有限(平均1 250个细胞),因此体外传代PDLSCs是十分重要的[9]。采用传代的方式可达到细胞数量的需求,但长期体外传代会引起间充质干细胞干性降低,这可能导致细胞再生治疗的疗效下降[10],因此本研究聚焦于多次传代培养对PDLSCs成骨分化以及牙周修复潜能的影响。
长链非编码RNAs(long noncoding RNAs, lncRNAs)是一类长度大于200个核苷酸的不编码任何蛋白质的RNA,在调控细胞生物学功能方面发挥重要作用。很多研究都阐述了lncRNA在调控PDLSCs成骨分化方面的作用[11,12]。本课题组前期研究证实,牙周炎症来源牙周膜干细胞成骨相关lncRNA(osteogenesis impairment-related of lncRNA periodontal mesenchymal stem cells from periodontitis patients, lncRNA POIR)与PDLSCs成骨分化有关,可以通过miR-182调控成骨相关靶基因FoxO1来修复炎症PDLSCs受损的成骨分化能力,在体内和体外均可促进PDLSCs的骨形成[13]。但lncRNA POIR是否参与调控多次传代后PDLSCs牙周再生潜能,尚无相关研究。本课题通过研究lncRNA POIR对多次传代后PDLSCs成骨分化功能的影响,以期提高多次传代PDLSCs牙周缺损修复能力。
1 材料与方法
1.1 主要试剂
α-MEM培养基、胎牛血清、青链霉素(Gibco,美国),0.25%胰蛋白酶、I型胶原酶(Sigma,美国),中性蛋白酶(Roche Diagnostics Gmbh,德国),Vario免疫磁珠分选器(MASC,德国),Stro-1抗体(Rnd,美国),成骨诱导液(Cyagen,美国),碱性磷酸酶(alkaline phosphatase, ALP)染色试剂盒(上海碧云天生物技术有限公司),ALP检测试剂盒(中生北控生物科技股份有限公司),茜素红染液(陕西中晖赫彩生物医药科技有限公司),sh-lncRNA POIR质粒、sh-NC质粒(上海吉凯基因有限公司),Trizol试剂盒(Invitrogen,美国),SYBR Green PCR试剂盒、逆转录试剂盒(Takara,日本),抗人矮小相关转录因子2(runt-related transcription factor 2, Runx2)、ALP、骨钙素(osteocalcin, OCN)、β-肌动蛋白(β-actin)抗体(Abcam,美国)。
1.2 牙周膜干细胞(hPDLSCs)的分离和培养
取西安交通大学口腔医院15~25岁患者因正畸需要或阻生齿拔除的无龋病、慢性牙周疾病的正畸牙或第三磨牙,本研究经西安交通大学医学部生物医学伦理委员会批准(No.2020398),所有患者均知情同意。在超净台内分离牙根中部的牙周膜组织,用3 mg/ml Ⅰ型胶原酶和4 mg/ml中性蛋白酶消化分离的组织1 h,离心后弃上清,加入含20% FBS、1%青链霉素的α-MEM培养基重悬,接种于25T培养瓶,于37 ℃、5% CO2培养箱中培养,每3 d换液1次,待细胞生长至80%左右融合率时用胰蛋白酶消化,按照1 ∶2或1 ∶3比例传代培养,记为第1代细胞。选取第2代细胞与stro-1抗体在4 ℃环境下反应20~30 min,PBS洗涤,二抗4 ℃环境下孵育20~30 min,PBS洗涤2遍。将LD管置于Vario免疫磁珠分选器中,在4 ℃条件下分离stro-1阳性细胞,即hPDLSCs细胞。取第3代、第15代、第30代细胞进行后续成骨分化相关研究,包括ALP染色、ALP活性、茜素红染色和RT-PCR,检测细胞代数对细胞成骨分化能力的影响。
1.3 ALP染色、ALP活性、茜素红染色共同检测hPDLSCs成骨分化能力
1.3.1 ALP染色 将处于对数生长期PDLSCs以5×104/孔的密度接种于12孔板,待细胞生长至70%左右融合率时,弃去原培养基,用成骨诱导培养基进行培养,每3 d换液1次。细胞成骨诱导培养7 d去除原培养基,PBS漂洗后4%多聚甲醛固定30 min,再次漂洗后用ALP染色试剂盒染色,漂洗后镜下观察。通过Image J软件检测染色所占面积并计算面积百分比,染色面积占比越大说明细胞ALP表达量越高,细胞成骨分化能力越强。
1.3.2 ALP活性 按1×103/孔的比例将细胞接种到96孔板,24 h开始成骨诱导,7 d倒掉培养液,PBS清洗3次,配置ALP活性测定工作液,添加工作液至96孔板,37 ℃环境中孵育30 min,加入显色液。酶联免疫检测仪在560 nm波长条件下检测,记录数据。吸光度越高说明细胞ALP表达量越高,细胞成骨分化能力越强。
1.3.3 茜素红染色 将处于对数生长期PDLSCs以5×104/孔的密度接种于12孔板,待细胞生长至70%左右融合率时,弃去原培养基,用成骨诱导培养基进行培养,每3 d换液1次。细胞成骨诱导培养21 d去除原培养基,PBS漂洗后4%多聚甲醛固定30 min,再次漂洗后用茜素红染液染色,漂洗后镜下观察,矿化结节红染。观察后进行茜素红染色定量,将0.5 mol/L HCl、5% SDS加入12孔板,每孔0.5 ml,室温作用30 min,吸取0.15 ml加入96孔板中,检测吸光度(405 nm)。吸光度越高说明细胞矿化结节形成越多,细胞成骨分化能力越强。
1.4 RT-PCR检测hPDLSCs中lncRNA POIR表达水平
用Trizol试剂盒提取第3代、第15代、第30代PDLSCs的总RNA,用逆转录试剂盒进行总RNA反转录合成cDNA。以cDNA为模板链,采用RT-PCR试剂盒进行扩增,分析比较lncRNA POIR随PDLSCs代数增加的变化趋势。lncRNA POIR和β-actin引物序列见表1。

表1 引物序列
1.5 细胞转染与分组
将第30代PDLSCs以5×104/孔的密度接种于12孔板,待细胞生长至60%左右融合率时将细胞分为空白对照组(不经任何处理)、无义序列转染对照组(转染sh-NC质粒)和lncRNA POIR下调组(转染sh-lncRNA POIR质粒)。将sh-NC质粒、sh-lncRNA POIR质粒分别和Lipofectamine 2000转染试剂(Invitrogen)混匀,室温静置20 min分别加入无义序列转染对照组细胞和lncRNA POIR下调组细胞中,在37 ℃、5% CO2培养箱中培养48 h用于后续成骨分化相关研究,包括ALP染色、ALP活性、茜素红染色和RT-PCR、Western blot,检测lncRNA POIR对细胞成骨分化功能的影响,并用于RT-PCR检测lncRNA POIR对miR-214的作用。sh-lncRNA POIR质粒序列:5′-CTCCCTCCATGAAGGTTTAAT-3′;sh-NC质粒序列:5′-TTCTCCGAACGTGTCACGT-3′。
1.6 ALP染色、ALP活性和茜素红染色共同检测各组PDLSCs成骨分化能力
取空白对照组、无义序列转染对照组、lncRNA POIR下调组对数生长期的PDLSCs进行ALP染色、ALP活性和茜素红染色试验,具体方法见1.3中所述。
1.7 RT-PCR和Western blot检测Runx2、ALP、OCN的表达水平
用Trizol试剂盒提取lncRNA POIR下调组、空白对照组、无义序列转染对照组PDLSCs的总RNA,用逆转录试剂盒反转录合成cDNA。以cDNA为模板链,采用RT-PCR试剂盒进行扩增,分析比较各组PDLSCs中Runx2、ALP、OCN表达水平。Runx2、ALP、OCN、β-actin引物序列见表1。
取下调组、空白对照组、无义序列转染对照组PDLSCs,加入蛋白裂解液提取总蛋白,BCA法测定蛋白浓度。各取20 μg总蛋白加热变性,依次将各个蛋白样本加入SDS-聚丙烯酰胺凝胶中电泳分离蛋白并将蛋白转膜封闭,加入一抗兔抗Runx2(稀释比1 ∶1 000)、ALP(稀释比1 ∶1 000)、OCN(稀释比1 ∶1 500)、β-actin(稀释比1 ∶2 000),4 ℃环境下过夜培养,室温环境下加入和辣根过氧化氢酶偶联的羊抗兔二抗(稀释比1 ∶2 000),孵育2 h,加入ECL进行显影曝光,β-actin作为对照。
1.8 生物信息学分析lncRNA POIR和miR-214的结合位点
应用生物信息学工具对lncRNA POIR的靶基因进行预测,分析lncRNA POIR和miR-214是否存在相似的结合位点。
1.9 RT-PCR检测lncRNA POIR对miR-214的作用
用Trizol试剂盒提取lncRNA POIR下调组、空白对照组、无义序列转染对照组PDLSCs的总RNA,用逆转录试剂盒反转录合成cDNA。以cDNA为模板链,采用RT-PCR试剂盒进行扩增,分析比较各组PDLSCs中miR-214表达水平。miR-214和β-actin引物序列见表1。
1.10 统计学分析

2 结果
2.1 多次传代后PDLSCs成骨分化能力和lncRNA POIR水平变化
茜素红染色检验成骨分化的最终产物—矿化结节,是体外实验检测成骨分化能力相对有力的证据。茜素红染色结果显示:第30代PDLSCs成骨结节形成量明显少于第15代和第3代,差异有统计学意义(P<0.05,见图1)。ALP是成熟成骨细胞的标志性酶,其在细胞中的表达量反映成骨细胞的分化程度和功能状态。ALP染色结果显示:第30代PDLSCs的ALP染色面积占比明显低于第15代和第3代,差异有统计学意义(P<0.01,见图1)。ALP活性结果显示:第30代PDLSCs的ALP活性明显低于第15代和第3代,差异有统计学意义(P<0.01,见图1)。RT-PCR检测结果显示:lncRNA POIR的表达水平随细胞代数增加呈现逐渐下降趋势,差异有统计学意义(P<0.01,见图1)。

与第3代细胞比较,#P<0.05,##P<0.01;与第15代细胞比较,*P<0.05,**P<0.01图1 多次传代后PDLSCs成骨分化能力和lncRNA POIR表达水平Figure 1 The osteogenic differentiation ability and lncRNA POIR expression level of PDLSCs after multiple passages
2.2 lncRNA POIR下调后PDLSCs成骨分化能力下降
茜素红染色结果显示:用shRNA质粒下调lncRNA POIR表达水平后,与空白对照组和无义序列转染对照组比较,lncRNA POIR下调组PDLSCs成骨结节形成明显减少(P<0.01,见图2)。ALP染色结果显示:lncRNA POIR下调组的ALP染色面积占比明显低于空白对照组和无义序列转染对照组(P<0.01,见图2)。ALP活性结果显示:lncRNA POIR下调组的ALP活性明显低于空白对照组和无义序列转染对照组(P<0.05,见图2)。

与空白对照组和无义序列转染对照组比较,*P<0.05,**P<0.01图2 lncRNA POIR下调后PDLSCs成骨分化能力Figure 2 The osteogenic differentiation ability of PDLSCs after down-regulation of lncRNA POIR
2.3 lncRNA POIR下调后PDLSCs中成骨相关基因、蛋白表达水平下降
RT-PCR和Western blot结果显示:用shRNA质粒下调lncRNA POIR表达水平后,与空白对照组和无义序列转染对照组比较,lncRNA POIR下调组PDLSCs中Runx2、ALP、OCN表达水平明显降低,差异有统计学意义(P<0.05,见图3)。

与空白对照组和无义序列转染对照组比较,*P<0.05,**P<0.01图3 lncRNA POIR下调后PDLSCs中成骨相关基因、蛋白表达水平Figure 3 Expression of osteogenic genes and proteins in PDLSCs after down-regulation of lncRNA POIR
2.4 lncRNA POIR可抑制PDLSCs中miR-214的表达
生物信息学分析结果显示:lncRNA POIR与miR-214存在结合位点(见图4)。为进一步确定lncRNA POIR与miR-214之间调控关系,利用shRNA质粒下调PDLSCs中lncRNA POIR的表达,RT-PCR结果显示:与空白对照组和无义序列转染对照组比较,lncRNA POIR下调组的miR-214的表达水平明显升高,差异有统计学意义(P<0.01,见图4)。
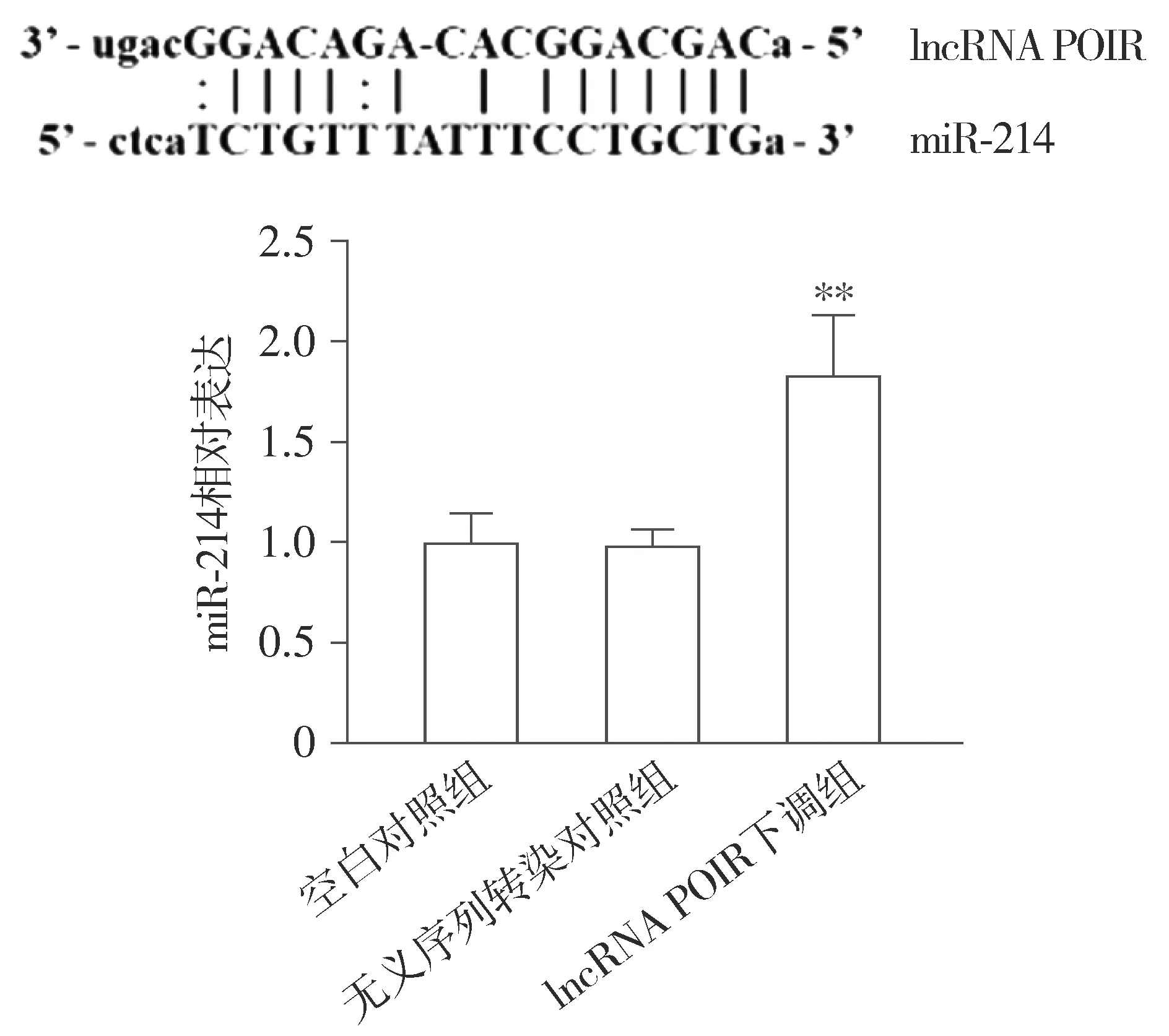
与空白对照组和无义序列转染对照组比较,**P<0.01图4 lncRNA POIR下调后PDLSCs中miR-214表达水平Figure 4 Expression of miR-214 in PDLSCs after down-regulation of lncRNA POIR
3 讨论
牙周炎是一种广泛存在的疾病,其特征是炎症引起的牙齿支持结构的进行性损伤,直到牙齿脱落,牙周组织中缺失或受损的支持组织(包括牙槽骨、牙周膜和牙骨质)的再生是牙周再生治疗的一个重要目标[14]。在牙周再生的过程中,硬组织再生是研究的重点和难点,而干细胞的成骨分化能力是评价其向牙周组织分化能力的主要指标。
已有相关研究显示干细胞的多次传代对其分化功能的影响。Zaim等[15]探究骨髓间充质干细胞(hMSCs)体外传代对神经向转分化能力的影响,发现长期传代是影响干细胞分化能力的关键系数,来自成年供体的hMSCs是在连续体外传代过程中失去其干细胞特性。Tan等[16]研究发现,长期的体外传代会导致PDLSCs衰老,可观察到衰老相关蛋白在长期传代后增加,随着传代数量增加,细胞成骨分化功能降低。本研究结果显示,相对于第3代PDLSCs,第15代和第30代PDLSCs成骨分化功能明显下降,与上述研究结论一致。
lncRNA可以参与调控PDLSCs成骨分化。Gu等[17]对比了PDLSCs成骨分化前后差异表达的lncRNA,发现共有960个lncRNA差异表达。He等[18]进一步研究证实,lncRNA TUG1通过调节靶基因Lin28A进而调控PDLSCs成骨分化。本课题组[13]前期研究显示lncRNA POIR与PDLSCs成骨分化相关,该lncRNA可以在健康微环境下和炎症微环境下正向调控PDLSCs的骨形成能力。本研究探讨了lncRNA POIR与多次传代后PDLSCs成骨分化的关系,利用质粒下调lncRNA POIR的表达。茜素红染色、ALP染色、RT-PCR和Western blot结果显示,与对照组相比,lncRNA POIR下调组PDLSCs成骨结节以及ALP活性均减少,骨形成标志物RunX2、ALP、OCN表达水平下降,说明成骨分化能力确实存在进一步下降。根据以上结果推测,多次传代会降低PDLSCs中lncRNA POIR表达水平,从而抑制PDLSCs成骨分化和牙周修复潜能,通过上调lncRNA POIR可以修复损伤的功能,但这一结果仍需动物体内实验加以证实。
miR-214是一类序列高度保守的microRNA,在细胞成骨分化过程中发挥十分重要的作用。Wang等[19]研究发现,在生理和病理条件下,成骨细胞中的miR-214都是骨形成的重要抑制剂。该研究显示,敲除miR-214基因后,去势小鼠骨质疏松症状明显改善,骨形成能力提高。Cao等[20]研究发现,miR-214在PDLSCs成骨分化过程中显著下调,抑制miR-214可促进PDLSCs的分化。根据生物信息学分析结果,lncRNA POIR与miR-214存在结合位点。利用质粒下调lncRNA POIR的表达,miR-214在PDLSCs中的表达明显升高,说明lncRNA POIR通过降低miR-214表达水平调控PDLSCs成骨分化,但仍需进一步实验证实。
综上所述,多次传代会降低PDLSCs的成骨分化水平并抑制lncRNA POIR表达,lncRNA POIR调控PDLSCs传代过程中的成骨分化功能,以上研究可以为临床应用多次传代后PDLSCs修复牙周缺损提供参考。

