大白桩菇多酚的定向液态发酵条件优化*
李艳婷,郭 尚**,王海珍,王志伟,徐莉娜,郭霄飞,刘 欣**
(1.山西农业大学 山西功能食品研究院,山西 太原 030031;2.山西农业大学 园艺学院,山西 晋中 030801)
多酚类化合物主要包括两类:一类是较大分子量的单宁和鞣质(分子量500 Da ~3 000 Da);另一类是小分子量的酚类物质,如没食子酸、花青素、鞣花酸等[1]。马铃薯、葡萄、食用菌、石榴等物质中均含有丰富的多酚类物质[2]。多酚化合物在抗氧化、抑菌、抗炎、抗癌细胞增殖及糖尿病、心血管疾病预防等方面均效果显著[3-7]。因此具有开发功能食品、特膳食品与药物的潜能,有较高的利用价值。
大白桩菇(Leucopaxillus giganteus) 属担子菌门(Basidiomycota) 伞菌目(Agricales) 白蘑科(Tricholomataceae) 白桩菇属(Leucopaxillus)[8],又名雷蘑、大青蘑,子实体大型,味道鲜美,营养丰富,还可治小儿麻疹、烦燥不安等[9-10]。此外,大白桩菇含有多糖、蛋白质、杯伞菌素等生物活性物质,具有清除过量自由基、提高免疫活性、抗肿瘤等生物学功能[11-14]。经测定,大白桩菇子实体中的多酚含量为12.64 mg·g-1[15],显著高于羊肚菌(Morchella esculenta) 10.18 mg·g-1、茶树菇(Cyclocybe aegerita)9.99 mg·g-1、黄牛肝菌(Suillellus luridus) 9.54 mg·g-1、猴头菇(Hericium erinaceus) 9.08 mg·g-1、姬松茸(Agaricus blaze)i 10.70 mg·g-1、灰树花(Grifola frondosa) 7.98 mg·g-1[16],极具研究价值。但目前对于大白桩菇多酚化合物的进一步研究尚处空白。
大白桩菇是台蘑的代表菌类之一[17]。近年来,由于当地居民的过度采摘,其产量面临着逐年缩减的威胁;另外,由于大白桩菇生长周期长,驯化难度大,目前尚未实现人工栽培。利用液体发酵获取菌丝体是一种简便、快捷的方法,具有周期短、方法简单、易于控制、成本低等特点。有研究表明,液体培养得到的菌丝体和栽培得到的食(药) 用菌子实体或菌核,不仅化学组成相似,且生理功能同样相似[18]。因此,以大白桩菇为发酵菌株,以多酚含量为指标,采用单因素(碳源、氮源、碳氮比、pH) 试验对大白桩菇液体发酵条件进行研究,在此基础上采用响应面法对富集多酚的大白桩菇液体定向发酵工艺进行优化,以获得高含量多酚物质,为今后该菌的进一步开发利用提供重要依据。
1 材料与方法
1.1 供试菌株
大白桩菇菌株,保藏于山西农业大学山西功能食品研究院。
1.2 方法
1.2.1 菌种活化与液体菌种的制备
将大白桩菇菌种接种于固体培养基(马铃薯200 g·L-1、葡萄糖20 g·L-1、琼脂粉20 g·L-1、磷酸二氢钾1 g·L-1、维生素B110 mg·L-)1,24 ℃暗培养20 d。
采用打孔器挑取直径为0.5 cm 已培养好的菌块置于液体培养基(葡萄糖35 g·L-1、蛋白胨6 g·L-1、磷酸二氢钾0.5 g·L-1、硫酸镁0.25 g·L-1、维生素B110 mg·L-)1,25 ℃、150 r·min-1摇床避光培养15 d,作为液体菌种备用。
1.2.2 不同碳源对多酚含量的影响
利用5 种碳源(C1:葡萄糖;C2:海藻糖;C3:蔗糖;C4:麦芽糖;C5:乳糖) 代替1.2.1 液体培养基中的碳源(葡萄糖),添加量的质量浓度均为35 g·L-1,配制培养基。按5%的接种量接入液体菌种,24 ℃、130 r·min-1震荡培养10 d,终止培养。用尼龙布(150 目) 分离菌丝体和发酵液,蒸馏水冲洗菌丝体3 次,60 ℃烘干至恒重,称量,记录。以不添加碳源的液体培养基为空白对照(CK1),每个配方设3 个重复。
1.2.3 不同氮源对多酚含量的影响
利用5 种氮源(N1:蛋白胨;N2:牛肉浸膏;N3:酵母粉;N4:硫酸铵;N5:麸皮) 代替1.2.1液体培养基中的氮源(蛋白胨),添加量的质量浓度均为6 g·L-1,配制培养基。接种及培养方法与1.2.2相同。以不添加氮源的液体培养基为空白对照(CK2),每个配方设3 个重复。
1.2.4 不同碳氮比对多酚含量的影响
以葡萄糖(含碳量40%) 为碳源,以蛋白胨(含氮量16%) 为氮源,在其他成分不变的条件下,通过调整葡萄糖的添加量使培养基中碳氮比分别为2.5 ∶1、10 ∶1、20 ∶1、30 ∶1、40 ∶1、50 ∶1,每个配方设3 个重复。
1.2.5 不同pH 对多酚含量的影响
以葡萄糖为碳源,以蛋白胨为氮源,在其他成分不变的条件下,调整培养基pH 分别为4、5、6、7、8、9,每个配方设3 个重复。
1.2.6 菌丝体提取液的制备
将干燥后的菌丝体进行研磨,过60 目筛;精确称取0.5 g,加入20 倍体积的水,设置温度80 ℃,在超声波中提取1 h;5 000 r·min-1离心10 min,取上清液,即为水提液;重复提取,合并2 次的水提液。
沉淀物加入20 倍体积的无水乙醇,设置温度为60 ℃在超声波中提取1 h;5 000 r·min-1离心10 min,取上清液,即为醇提液;重复提取,合并2 次的醇提液。
1.2.7 发酵液中菌丝体多酚含量
采用福林酚法对菌丝体多酚含量进行测定[19];根据测定结果,计算发酵液中大白桩菇菌丝体多酚的含量。发酵液中菌丝体多酚质量浓度(ρp,mg·L-1) 的计算公式为:

式中:Ap为大白桩菇菌丝体多酚含量(mg·g-1);ρm为干燥后大白桩菇菌丝体的质量浓度(g·L-1)。
1.2.8 响应面优化液体培养方案
在单因素试验的基础上,分别选取碳源(葡萄糖)、氮源(蛋白胨)、pH 为考察对象,以发酵液中菌丝体总多酚的质量浓度为响应值,利用Design-Expert 8.0 软件设计3 因素3 水平试验,每个试验设置3 个重复。响应面3 因素3 水平试验设计见表1。

表1 响应面试验设计Tab.1 The test design of response surface
2 结果与分析
2.1 单因素试验结果
2.1.1 碳源对大白桩菇菌丝体及多酚的影响
液体发酵过程中,不同的碳源对干燥后大白桩菇菌丝体的质量浓度及其多酚含量的影响见图1。
由图1A 可知,与C6(CK1) 相比,其他5 种碳源均能提高大白桩菇的菌丝体质量浓度;其中C2海藻糖是积累菌丝体质量的最佳碳源,此时菌丝体质量浓度为5.17 g·L-1;其次为C1 葡萄糖和C3 蔗糖。如图1B 所示,C1 葡萄糖有利于菌丝体多酚物质的积累,菌丝体水提多酚含量为8.15 mg·g-1,菌丝体醇提多酚含量为0.92 mg·g-1,菌丝体总多酚含量为9.07 mg·g-1;其次为C3 蔗糖和C4 麦芽糖。综合试验结果进行计算,C1~C5 发酵液中大白桩菇菌丝体水提多酚质量浓度分别为39.97 mg·L-1、9.10 mg·L-1、14.01 mg·L-1、9.25 mg·L-1、3.25 mg·L-1,C6(CK1) 为0.69 mg·L-1;菌丝体总多酚质量浓度分别为44.49 mg·L-1、11.28 mg·L-1、18.55 mg·L-1、11.89 mg·L-1、4.89 mg·L-1,C6(CK1) 为0.73 mg·L-1。综上所述,最适合水提多酚及总多酚积累的碳源为葡萄糖,显著高于其他4 种碳源及对照,多酚积累从高到低的碳源排序为葡萄糖>蔗糖>麦芽糖>海藻糖>乳糖。
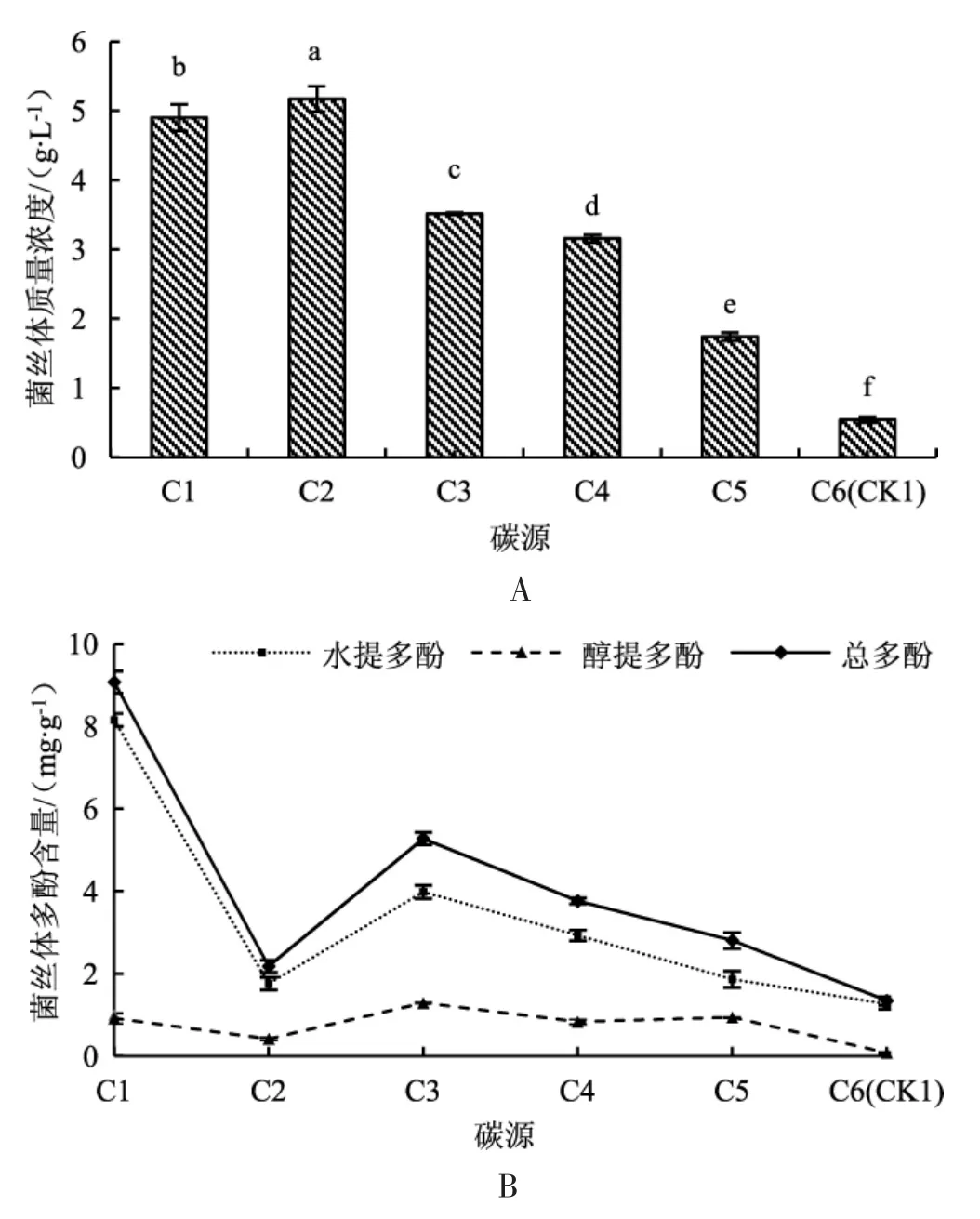
图1 不同碳源培养条件下大白桩菇干燥菌丝体的质量浓度(A) 及其多酚含量(B)Fig.1 Mass concentration (A) and polyphenol content (B)of dried mycelia of Leucopaxillus giganteus under different carbon source culture conditions
2.1.2 氮源对大白桩菇菌丝体及多酚的影响
液体发酵过程中,不同氮源对干燥后大白桩菇菌丝体的质量浓度及其多酚含量的影响见图2。
由图2A 可知,与N6(CK2) 相比,5 种氮源均能提高大白桩菇的菌丝体质量浓度;其中N2 牛肉浸膏和N4 硫酸铵能显著提高大白桩菇菌丝体质量,二者无显著性差异;其次为N1 蛋白胨。如图2B 所示,N1 蛋白胨有利于菌丝体多酚物质的积累,菌丝体水提多酚含量为9.23 mg·g-1,菌丝体醇提多酚含量为2.21 mg·g-1,其次为N4 硫酸铵。综合试验结果,经计算N1~N5 发酵液中大白桩菇菌丝体水提多酚的质量浓度分别为38.23 mg·L-1、19.22 mg·L-1、18.54 mg·L-1、40.75 mg·L-1、7.90 mg·L-1,N6(CK2) 为0.96 mg·L-1;总多酚的质量浓度分别为47.41 mg·L-1、27.53 mg·L-1、21.51 mg·L-1、46.33 mg·L-1、9.29 mg·L-1,N6(CK2) 为3.23 mg·L-1。综上所述,最适合水提多酚积累的氮源为硫酸铵,其次为蛋白胨,二者之间差异不显著,但显著高于其他3 种氮源及对照;最适合总多酚积累的氮源为蛋白胨,其次为硫酸铵,二者之间差异不显著,但极显著高于其他3 种氮源及对照,总多酚积累从高到低的氮源排序为蛋白胨>硫酸铵>牛肉浸膏>酵母粉>麸皮。

图2 不同氮源培养条件下大白桩菇干燥菌丝体的质量浓度(A) 及其多酚含量(B)Fig.2 Mass concentration (A) and polyphenol content (B)of dried mycelia of Leucopaxillus giganteus under different nitrogen source culture conditions
2.1.3 碳氮比对大白桩菇菌丝体及多酚的影响
液体发酵过程中,不同的碳氮比对干燥后大白桩菇菌丝体的质量浓度及其多酚含量的影响见图3。

图3 不同碳氮比培养条件下大白桩菇干燥菌丝体的质量浓度(A) 及其多酚含量(B)Fig.3 Mass concentration (A) and polyphenol content (B)of dried mycelia of Leucopaxillus giganteus under different carbon-nitrogen ratio culture conditions
由图3A 可知,碳氮比为10 ∶1 时菌丝体质量达到最大,随着碳氮比的增大,菌丝体质量整体呈下降的趋势;这可能是因为碳源含量过高,造成了富营养状态,抑制了菌丝体的生长。如图3B 所示,随着碳氮比的增大,多酚含量呈先上升后下降的趋势;碳氮比为20∶1 时菌丝体多酚的积累达最大,此时菌丝体水提多酚含量为8.37 mg·g-1,菌丝体醇提多酚含量为3.35 mg·g-1。综合试验结果,经计算碳氮比从2.5 ∶1 到50 ∶1 的发酵液中大白桩菇菌丝体水提多酚的质量浓度分别为16.80 mg·L-1、22.20 mg·L-1、19.00 mg·L-1、21.24 mg·L-1、14.80 mg·L-1和8.93 mg·L-1;总多酚的质量浓度分别为25.72 mg·L-1、38.32 mg·L-1、27.08 mg·L-1、34.62 mg·L-1、20.24 mg·L-1和15.21 mg·L-1。综上所述,最适合水提多酚积累的碳氮比为10 ∶1,其次为30 ∶1 和20 ∶1,三者之间差异不显著,但极显著高于其他3 种碳氮比;最适合总多酚积累的碳氮比为10 ∶1,其次为30 ∶1,极显著高于其他4 种碳氮比,总多酚积累从高到低的碳氮比排序为10 ∶1 >30 ∶1 >20 ∶1 >2.5 ∶1 >40 ∶1 >50 ∶1。葡萄糖的含碳量为40%,蛋白胨的含氮量为16%,总多酚积累最多的葡萄糖与蛋白胨的质量比值为4 ∶1。
2.1.4 pH 对大白桩菇菌丝体及多酚的影响
液体发酵过程中,不同pH 对干燥后大白桩菇菌丝体的质量浓度及其多酚含量的影响见图4。
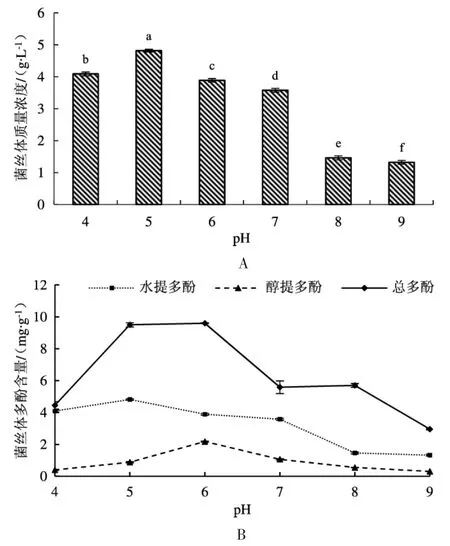
图4 不同pH 培养条件下大白桩菇干燥菌丝体的质量浓度(A) 及其多酚含量(B)Fig.4 Mass concentration (A) and polyphenol content (B)of dried mycelia of Leucopaxillus giganteus under different pH culture conditions
由图4A 可知,pH 为5 时菌丝体质量达到最大,其质量浓度为4.82 g·L-1;随着pH 的增大或是减小,菌丝体质量均呈下降趋势;因此,pH 5 最有利于菌丝体质量的积累。如图4B 所示,pH 为5 时也有利于菌丝体多酚的积累,菌丝体水提多酚含量为8.62 mg·g-1,菌丝体醇提多酚含量为0.88 mg·g-1,其次是pH 6。综合试验结果进行计算,当pH 为4~9 时,发酵液中大白桩菇菌丝体水提多酚的质量浓度分别为16.56 mg·L-1、41.54 mg·L-1、28.86 mg·L-1、16.19 mg·L-1、7.54 mg·L-1和3.51 mg·L-1、;总多酚的 质 量 浓 度 分 别 为18.19 mg·L-1、45.77 mg·L-1、37.32 mg·L-1、19.98 mg·L-1、8.34 mg·L-1和3.91 mg·L-1。综上所述,pH 为5 时最适合水提多酚及总多酚的积累,且显著高于其他5 个pH 培养条件;总多酚积累从高到低的排序为pH 5 >pH 6 >pH 7 >pH 4 >pH 8 >pH 9。
2.2 响应面试验优化
2.2.1 响应面实验设计与结果
在单因素试验的基础上,以发酵液中总多酚质量浓度作为响应值,对葡萄糖(A)、蛋白胨(B)、pH(C) 3 个因素进行3 因素3 水平的Box-Behnken试验,试验设计及结果见表2。
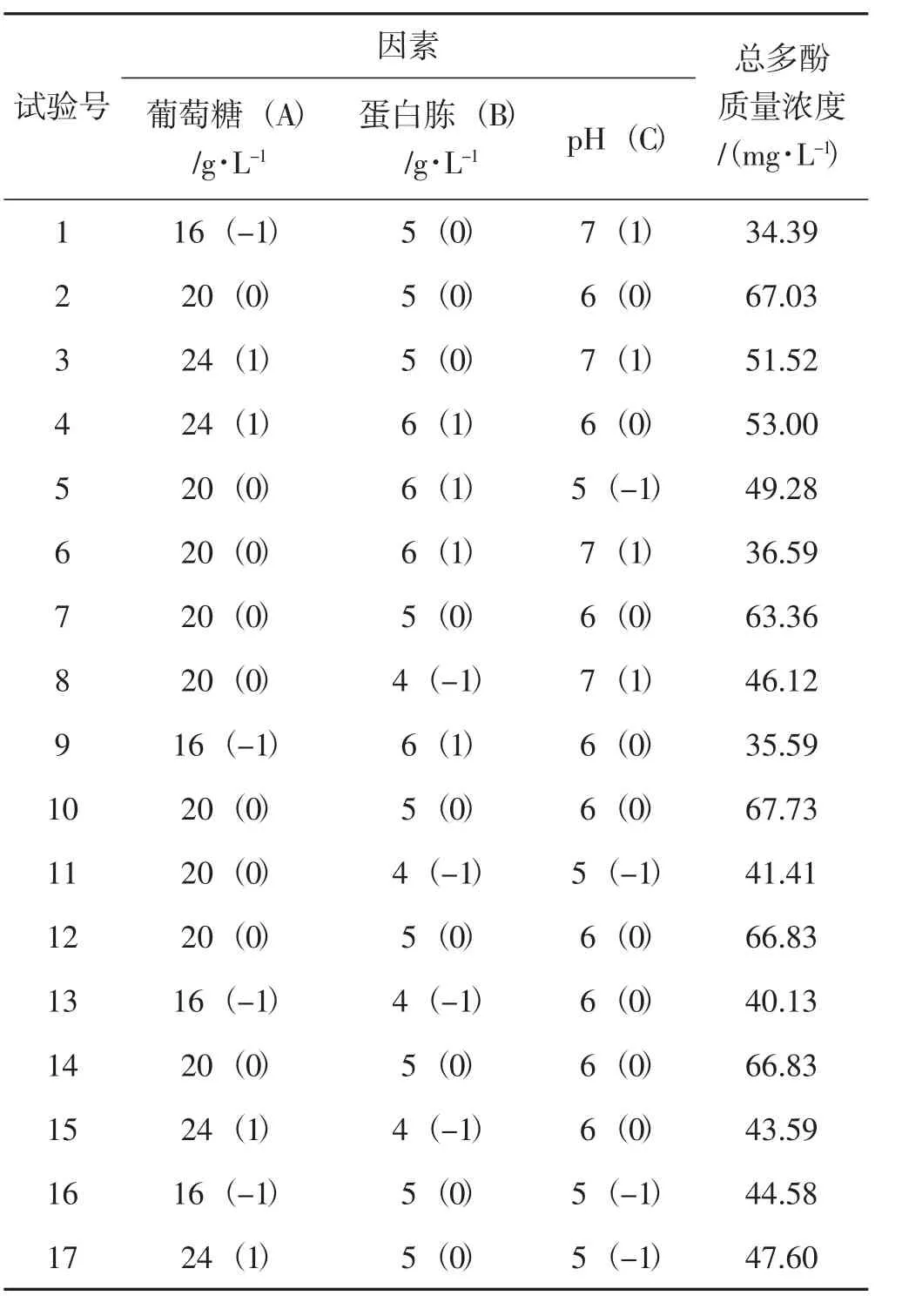
表2 响应面试验设计因素水平及结果Tab.2 Response surface test design and factor level
如表2 所示,根据各因素水平的结果,使用Design-expert 8.0 软件进行拟合,发酵液中总多酚质量浓度(Y,mg·L-1) 的回归方程为:
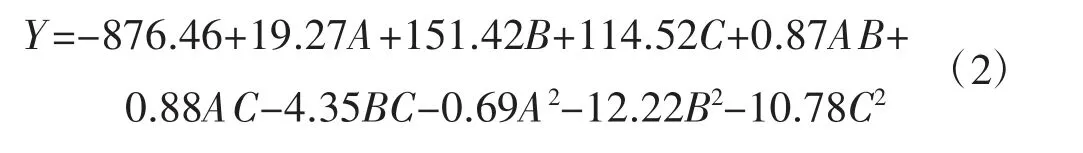
将各因素使用Design-expert 8.0 软件对试验结果进行统计分析,见表3。

表3 二次回归方程方差分析Tab.3 ANOVA of quadratic regression equation
由表3 可知,模型P 值<0.01,说明该模型有意义且达到了极显著水平;失拟项P=0.620 5(P>0.05),不显著,表明该方程合理可靠。一次项A 对结果影响极显著(P<0.01),B 对结果影响显著(P<0.05),C 对结果影响不显著(P>0.05);交互项AB、AC、AB 对结果影响均极显著(P<0.01);二次项A2、B2、C2对结果影响极显著(P<0.01)。3 个单因素对发酵液中菌丝体总多酚质量浓度的影响主次顺序为A>C>B,即葡萄糖>pH>蛋白胨。
2.2.2 响应面分析
根据分析结果及方程建立响应面,可直观反映影响多酚质量浓度的3 个因素两两之间的交互作用,见图5。
如图5 所示,随着葡萄糖、蛋白胨、pH 的增加,多酚质量浓度均出现先升高后降低的趋势,且均出现极值,与方差分析结果一致。

图5 葡萄糖、蛋白胨和pH 两两交互的响应面曲线Fig.5 Response surface curve of glucose, peptone and pH interacting in pairs
由响应面法分析得出的最佳培养方案中各组分的质量浓度分别为:葡萄糖22.40 g·L-1、蛋白胨6.12 g·L-1、磷酸二氢钾0.5 g·L-1、硫酸镁0.25 g·L-1、维生素B110 mg·L-1,pH 4.95。在此配方下进行5次验证试验,得出大白桩菇菌丝体发酵培养后总多酚的质量浓度为59.98 mg·L-1,与预测值(65.57 mg·L-1)接近,证明该培养方案是有效可行的。
3 讨论与结论
食用菌属于异养生物,主要由培养基提供生长所需的营养物质,如碳源、氮源、无机盐、生长因子等[20-21]。此外,液体发酵过程中培养基的pH、摇床转速、培养温度、接种量等都会影响食用菌菌丝体的生长与发育。
碳源是食用菌最重要的营养源之一,为食用菌的生长发育提供能量[22],大白桩菇液体发酵过程中均能利用供试的5 种碳源,对菌丝体多酚质量浓度的影响从大到小的顺序依次为葡萄糖、蔗糖、麦芽糖、海藻糖、乳糖。葡萄糖有利于菌丝体多酚物质的积累,这与Barros 等[23]研究结果一致。氮源是菌丝生长过程中必需的营养物质[24],大白桩菇液体发酵过程中均能利用供试的5 种氮源,对菌丝体多酚质量浓度的影响从大到小的顺序依次为蛋白胨、硫酸铵、牛肉浸膏、酵母粉、麸皮。这与王谦等[25]的研究结果不一致,可能是由于采用的计算方法、培养方式不同以及培养基中的微量元素存在差异。液体发酵培养基可提供菌丝生长所需的各种营养物质,且适宜的营养比例可促进菌丝生长及次生代谢产物的积累。大白桩菇在液态发酵过程中,当碳氮比为10 ∶1 时,菌丝体质量、密度均能达到最大值。另外,由于培养液的pH 会随着培养时间的增加发生变化,试验中的pH 均为灭菌前所调试的初始pH,在初始pH 为5 时菌丝体质量可达最大,所含总多酚含最也高,因此大白桩菇液态发酵菌丝体多酚积累的最适pH 为5。
食用菌在液体发酵过程中会产生多种生物活性物质,主要来自于其胞内、胞外浸出液和发酵过程中产生的次级代谢产物,某些活性物质的含量可能远高出子实体中的含量[26]。多酚类是食用菌代谢产物中最重要的组分之一,具有显著的抗炎效果[27]。大白桩菇在液体发酵过程中,获得最高菌丝体产量的培养基配方并不一定能积累到最大含量的多酚物质,表明了同一个培养基配方不能同时兼顾发酵产物中高菌丝体产量与高活性物质含量的获得,这与林群英等[28]研究结果相一致。
试验结果表明,葡萄糖、蛋白胨、pH 为5、碳氮比为10 ∶1(即葡萄糖和蛋白胨的质量比为4 ∶1)有利于菌丝体多酚物质的积累。在单因素试验的基础上,结合响应面分析法优化大白桩菇液体发酵工艺以获得其更高多酚含量的菌丝体,其最佳配方为:葡萄糖22.40 g·L-1、蛋白胨6.12 g·L-1、磷酸二氢钾0.5 g·L-1、硫酸镁0.25 g·L-1、维生素B110 mg·L-1,pH 4.95。
试验尚未对发酵周期进行研究,许多研究表明不同发酵时长对菌丝体质量及次级代谢产物的积累存在着显著的影响,今后可在该方面进行深入研究,为大白桩菇及其多酚的开发利用提供更详尽的参考依据。

