骨肉瘤组织中微小RNA-650的表达变化及其意义
杜壮文, 欧阳帆, 曾繁宽
(海南省琼海市人民医院, 海南 琼海 571400)
骨肉瘤(osteosarcoma,OS)是一种常见的原发、高度恶化的骨恶性肿瘤,好发于青少年及儿童,局限性OS患者5年生存率为70%,复发转移患者5年生存率不到20%[1]。尽管OS临床治疗手段不断改进,但是术后复发、转移率较高,生存状况仍不容乐观。微小RNA(micro RNA,miRNA)具有调控细胞生长、分化、增殖、凋亡等作用,参与恶性肿瘤发病过程,其中多种miRNA已被证实参与骨肉瘤发生和发展。miR-650在不同的肿瘤中表现出不同的调控作用,在胶质瘤中miR-650表达下调,转染miR-650后细胞增殖活性明显下降,miR-650缺乏可上调FAM83F表达促进肿瘤细胞增殖[2]。在非小细胞肺癌中miR-650表达上调,miR-650通过靶向生长抑制因子4(ING4),调控Wnt-1/β-连环蛋白信号通路促进癌细胞的增殖和侵袭[3]。目前miR-650与OS临床病理参数和预后暂无文献报道,鉴于此,本研究针对miR-650在OS的表达特点,分析其临床意义。
1 资料与方法
1.1研究对象:选择2016年1月至2018年12月琼海市人民医收治的80例OS患者,其中男52例,女28例,年龄9~17(13.26±3.19)岁,肿瘤部位:股骨远端27例,胫骨近端28例,肱骨近端21例,其他4例。肿瘤直径2~7(5.19±2.35)cm,Enneking分期:Ⅰ期24例,Ⅱ期41例,Ⅲ期15例,淋巴结转移15例,远处转移19例。纳入标准:①均行外科保肢手术治疗,术后病理组织学诊断为OS;②患者均首次入院纠正,术前未接受放化疗等其他免疫靶向治疗;③临床基线资料、病理资料及随访数据完整。排除标准:①脂肪肉瘤,纤维肉瘤,或合并其他部位原发肿瘤;②慢性化脓性骨髓炎,骨折、骨结核;③中断随访者。患者及其家属均知情同意签署同意书。
1.2miR-650表达检测:取手术切除瘤组织及瘤旁组织(距肿瘤组织边缘≥5cm)标本,组织研磨仪研磨后加入裂解液混匀,TRIzol试剂(美国Ambio公司)提取总RNA,M-MLV逆转录酶(Epicentre公司)将其逆转录为cDNA。取2μL cDNA样品,CFX96实时荧光PCR仪(美国Bio-Rad)做3次平行试验,以GAPDH RNA为内参,2-ΔΔCt计算miR-650相对表达量miR-650表达,取3次试验平均值。引物合成及序列测定由上海基康公司完成。见表1。

表1 引物序列反应条件和体系
1.3随访:所有患者均定期接受电话随访3年,统计随访期间生存情况,生存期定义为接受手术日期到全因死亡或随访结束时间。

2 结 果
2.1骨肉瘤、瘤旁组织miR-650表达比较:骨肉瘤组织与瘤旁组织miR-650相对表达量分别为5.03±1.19、1.02±0.36,骨肉瘤组织miR-650相对表达量明显高于瘤旁组织(t=28.849,P<0.001)。
2.2miR-650表达与骨肉瘤患者病理参数的关系:miR-650表达Enneking分期 Ⅲ期、淋巴结转移、远处转移有关(P<0.001),见表2。
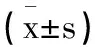
表2 miR-650表达与骨肉瘤患者病理参数的关系
2.3生存分析:随访期间死亡36例,制作生存曲线(见图1),经Log Rank检验miR-650高表达组(miR-650≥5.03,42例)OS患者3年生存率为40.48%(17/42),低于miR-650低表达组(miR-650<5.03,38例)的71.05%(27/38)(Log Rank 2=7.103,P=0.008)。
2.4COX回归分析:以OS患者预后为因变量(1=死亡,0=存活),年龄(赋值:连续性变量)、性别(赋值:0=男,1=女)、肿瘤部位(赋值:0=其它,1=骨远端,胫骨近端,肱骨近端)、肿瘤直径(赋值:0=<5cm,1=≥5cm)、Enneking分期(赋值:0=Ⅰ、Ⅱ期,1=Ⅲ期)、淋巴转移(赋值:0=否,1=是)、远处转移(赋值:0=否,1=是)、miR-650(赋值:0=miR-650<5.03,1=miR-650≥5.03)。分别采用单因素和多因素COX风险比例回归分析影响OS患者预后的因素,最终结果显示淋巴转移、远处转移、miR-650≥5.03是OS患者死亡的危险因素(P<0.01),见表3、4。
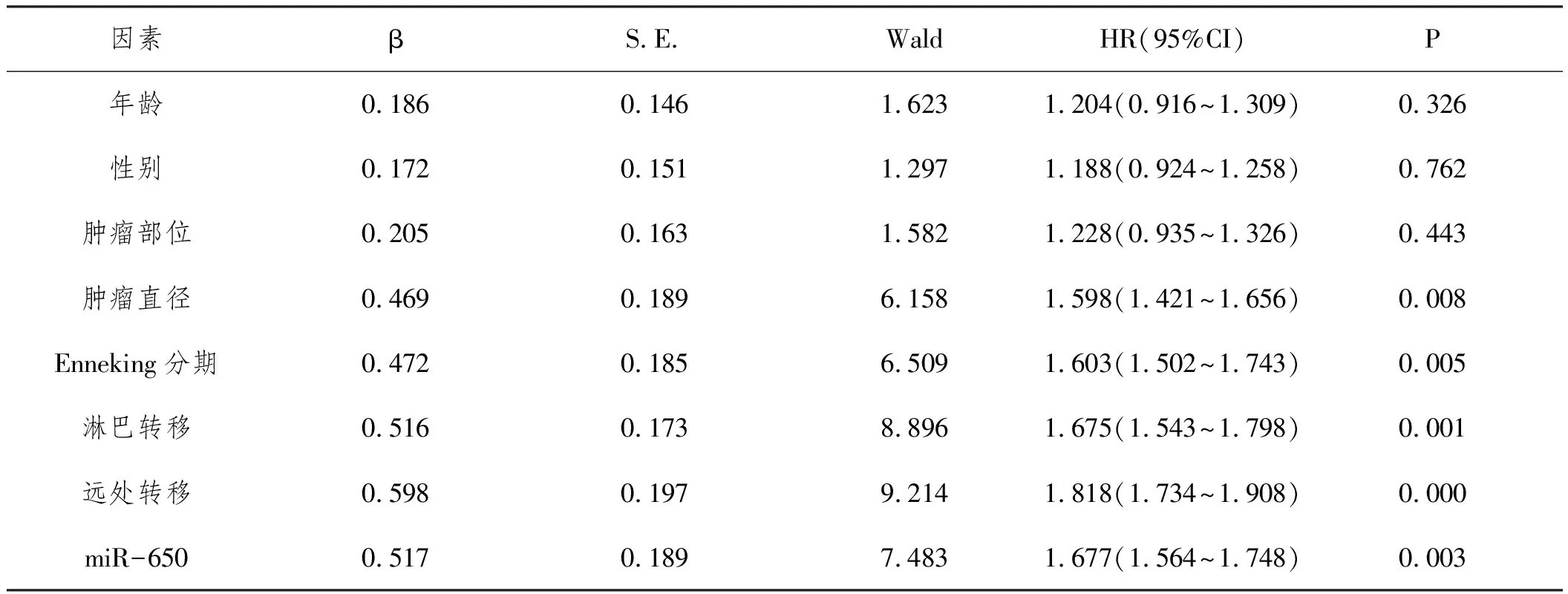
表3 影响OS患者预后的单因素COX回归分析

表4 影响OS患者预后的多因素COX回归分析
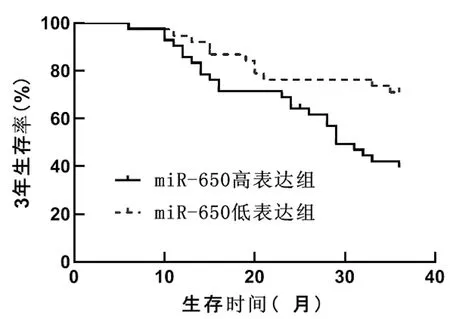
图1 OS患者术后3年生存曲线
3 讨 论
OS是威胁青少年健康和生命安全的常见骨原发恶性肿瘤,以早期肺转移和低生存率为特征。目前OS发病机制尚未完全阐明,缺乏有效的治疗手段,即便接受手术和(或)化疗患者预后依然较差,因此寻找OS诊断和治疗的潜在生物标志物和靶点十分重要。
miRNA是一类由20-25个核苷酸组成的非编码单链RNA,具有翻译、基因调控、转录后调控等作用,通过降解或抑制信使RNA参与恶性肿瘤细胞增殖分化和凋亡过程。越来越多研究表明miRNA在OS发病机制中发挥作用,其中miR-188-5p通过靶向降解CCNT2抑制骨肉瘤细胞的增殖能力[4],miR-98-5p通过下调细胞分裂周期25调控细胞周期抑制骨肉瘤恶性增殖和进展[5]。miR-650最早被发现于人类结直肠中,通过调控靶基因表达介导细胞活性,在不同的肿瘤中表现出不同的调控作用。现有报道显示miR-650在肝细胞癌中表达上调,通过靶向肿瘤抑制蛋白激酶2(LATS2)参与癌细胞增殖、迁移和侵袭[6]。慢性淋巴细胞白血病患者miR-650也呈高表达,且与Binet分期、IGHV、P53基因畸变有关,miR-650通过调控肿瘤抑制基因NDRG2抑制细胞凋亡[7]。而在结肠癌中miR-650表达下调,发挥抑制癌细胞生长和侵袭作用,miR-650可能通过靶向AKT2蛋白抑制AKT通路诱导上皮型钙黏附素(E-cadherin)表达,抑制细胞迁移和侵袭[8]。
然而miR-650与OS临床病理参数和预后的相关报道十分少见,本研究发现miR-650在骨肉瘤组织中高表达,提示miR-650在OS中可能发挥促癌基因作用。通过分析miR-650与临床病理参数关系发现miR-650表达与OS患者Enneking分期、淋巴结转移、远处转移有关,提示miR-650过表达可能诱导OS细胞恶性增殖、侵袭和转移,miR-650参与OS病情恶性进展过程。推测miR-650参与OS的发病机制为:①miR-650通过下调靶基因ING4表达参与肿瘤炎症反应调节,ING4作为一种肿瘤抑制蛋白,其表达受抑制后可通过调节核转录因子-κB(NF-κB)活性诱导白细胞介素6(IL-6)的转录和分泌,IL-6促进细胞间黏附分子-1表达,调节成骨细胞和破骨细胞分化参与OS发病过程,因此miR-650可能通过ING4/NF-κB/IL-6轴参与OS发病机制[9]。②miR-650过表达通过抑制ING4表达促使OS细胞快速增殖[10]。③miR-650与ADP-核糖基化因子-1(ARF1)mRNA靶向结合,ARF具有调节肌动蛋白细胞骨架重塑、质膜重组和囊泡转运等过程[11],是囊泡运输过程中通过分泌通路早期区隔的关键分子开关[12],参与侵袭性乳腺癌侵袭转移和上皮间质转化过程以及OS破骨细胞分化过程和OS肿瘤微环境改变过程[13],因此推测miR-650可能通过调控ARF1表达促进OS细胞上皮间质转化诱导OS瘤细胞增殖,Enneking分期增加以及淋巴结和远处转移。通过随访调查发现,miR-650高表达与OS患者低生存率有关,COX风险比例回归分析示miR-650高表达是OS患者预后不良的危险因素,可能与miR-650高表达促使OS细胞增殖、侵袭、转移,导致肿瘤复发转移有关,提示miR-650可以作为判断OS患者预后情况的一项指标。miR-650在人体组织中表达稳定,却对基因表达和调控具有关键作用,与骨肉瘤其它肿瘤标志物比较,可更敏感地反映肿瘤发生和进展,是骨肉瘤颇具前景的生物学指标。
综上所述,骨肉瘤组织中miR-650呈高表达,miR-650表达与OS患者Enneking分期、淋巴结转移、远处转移有关,miR-650高表达是OS预后不良的危险因素。miR-650有望作为OS预后预测的潜在标志物和治疗的潜在靶点。

