CXCL1/CXCR2在坏死性小肠结肠炎新生大鼠肠脑组织中的表达及意义
何 玲, 侯 丽, 赵 婧
(川北医学院附属医院儿科, 四川 南充 637000)
坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是一种常见的早产儿肠道急症,主要表现是小肠结肠斑片状坏死,由于早期症状体征不典型,传统实验室检测缺乏特异性,往往容易漏诊,具有较高的死亡率[1]。目前研究表明,NEC与早产、感染、缺氧等多因素有关,但其具体调控机制仍不清楚[2]。有研究表明,NEC与神经系统发育异常密切相关,且NEC患儿病情越重,神经系统发育结局越差[3,4]。其原因可能与肠道炎症反应导致脑损伤有关。趋化因子与其受体结合,在细胞生长、增殖、分化、凋亡等病理改变中发挥重要作用,是参与炎症反应的重要介质。CXCL1/CXCR2是趋化因子及其受体家族中常见的亚群。研究已证实,CXCL1/CXCR2在参与了肠道炎症的调控过程[5],但是否对NEC所致的脑损伤是否具有调控作用尚无报道。本研究旨在通过构建新生大鼠NEC模型,检测其肠、脑组织中CXCL1、CXCR2表达的变化,探讨CXCL1/CXCR2在NEC及其相关脑损伤中的作用。
1 资料与方法
1.1实验动物:本研究已通过川北医学院动物实验伦理审查。购自川北医学院实验动物中心SPF(Specific Pathogen Free) 级即将临产的 SD大鼠孕鼠于川北医学院实验动物中心大鼠专用饲养间由专业人员喂养等待自然分娩,大鼠实验动物许可证号:SYSK(川)2018-076,实验对象为出生1日龄的新生SD大鼠43只(1只不明原因死亡),雌雄不限。
1.2实验分组及NEC模型建立:按随机配对原则将新生鼠分为实验组(21只)和对照组(21只)。NEC模型建立参照以往经典的造模方式[6]。实验组通过葡聚糖硫酸钠盐(Dextran Sulfate Sodium Salt,DSS)处理,将DSS加入生理盐水中配制成3%溶液,每次每只新生鼠灌胃量为0.1mL,所有新生大鼠每天同一时间开始灌胃,间隔 3h 灌胃一次,每天4次,共灌胃3d。同时空白对照组给与生理盐水灌胃,剂量及时间同DSS实验组。
1.3标本取材:两组新生鼠分别于灌胃后3h、24h、72h时,采用断头处死新生鼠留取全脑及全肠组织(每个时间点各组各取6只,另于72h各组各取3只作病理组织检测),具体步骤如下:七氟烷吸入麻醉,断头,剪开头皮,拨开颅骨,露出大脑,于视神经及脑干处游离出全脑组织,装于标本盒中。自腹正中线打开腹腔,分离肠系膜及血管,取出整个肠道立刻放置于提前准备好的4℃无菌生理盐水中清洗。取脑、肠组织装于标本盒中,放于液氮中速冻10min后,放入-80℃冰箱保存。作病理组织检测的标本取下后置于装有50mL 4%PFA (多聚甲醛)的标本盒中,放入冰箱中冷藏保存24~48h备用。分别对脑、肠组织进行病理切片,通过苏木精-伊红染色后,每只新生鼠随机选取一张肠、脑组织切片(共6张),在光镜下(肠组织×100倍,脑组织×400倍)随机5个视野进行观察。
1.4CXCL1及CXCR2蛋白含量检测:应用蛋白质印迹法即Western Blot检测实验组及对照组新生鼠灌胃后3h、24h、72h时全脑、全肠组织CXCL1及CXCR2蛋白含量(各组各时间点各6只)。分别于冰箱中取大鼠脑、肠样本,然后向每管加入RIPA裂解液(按照质量比大鼠脑、肠:裂解液=1∶10),裂解;收集裂解液,离心;离心完后取上清液,用BCA蛋白定量试剂盒测定蛋白浓度。制备SDS-PAGE凝胶后,上样,转膜,封闭。加入一抗(浓度:CXCL1 1∶1000;CXCR2 1∶1000;β-actin 1∶100000),4℃过夜孵育。次日用TBST进行快速摇洗5min×3次后,加入二抗(稀释浓度:1∶5000),室温孵育2~3h。洗膜、显影、定影、曝光,凝胶成像系统分析,GelPro软件进行图像处理,Graphpad Prism 6、Photoshop软件绘图。

2 结 果
2.1两组新生大鼠肠、脑组织的病理改变:大体观察,与对照组比较,实验组大鼠肠组织肠道肿胀,肠腔积气明显,肠壁变薄(图1);HE染色发现,与对照组比较,实验组肠组织绒毛有受损、脱落和坏死,肠腺体紊乱、缺失,黏膜下及肌层有水肿、分离,基底变薄,有一定数量的炎症细胞浸润;肠道组织病理评分均超过2分(图2)。实验组脑组织细胞层次结构不清,室周白质多孔、疏松,胶质细胞减少(图3)。

图1 对照组(A)和实验组(B)新生大鼠肠组织大体病理变化
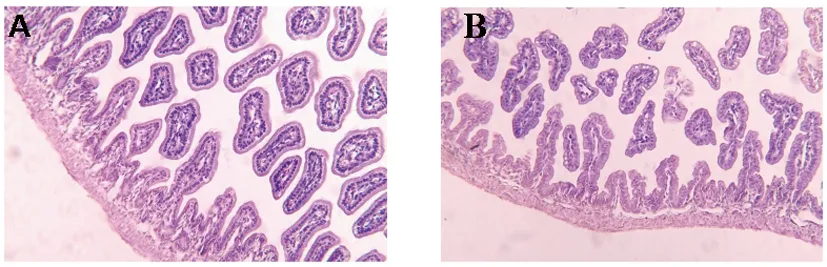
图2 对照组(A)和实验组(B)新生大鼠光镜下(100×)肠组织病理变化
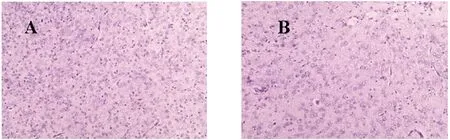
图3 对照组(A)和实验组(B)新生鼠光镜下(400×)脑组织病理变化
2.2两组新生鼠肠、脑组织中CXCL1、CXCR2蛋白表达情况
2.2.1两组新生鼠肠组织中CXCL1、CXCR2蛋白表达情况:与对照组相比,实验组新生鼠肠组织中CXCL1蛋白含量在灌胃后3h、72h均高于对照组,差异有统计学意义(F=9.476,P<0.05),而灌胃后24h时差异无统计学意义(P>0.05);与对照组相比,实验组新生鼠肠组织中CXCR2蛋白含量在灌胃后3h、24h、72h差异均无统计学意义(F=2.012,P>0.05),见图4。

图4 两组新生鼠肠组织中CXCL1、CXCR2蛋白含量
2.2.2两组新生鼠脑组织中CXCL1、CXCR2蛋白表达情况:与对照组相比,实验组新生鼠脑组织中CXCL1蛋白含量在灌胃后3h、24h差异均无统计学意义(均P>0.05);而在灌胃后72h,DSS处理组新生鼠脑组织中CXCL1蛋白含量明显升高,差异有统计学意义(F=35.767,P<0.05);与对照组相比,实验组新生鼠脑组织中CXCR2蛋白含量在灌胃后3h、24h、72h均高于对照组,差异有统计学意义(F=50.083,均P<0.05),见图5。

图5 两组新生鼠脑组织中CXCL1、CXCR2蛋白含量
3 讨 论
NEC是早产儿最严重的胃肠道疾病,也是早产儿最常见的死亡原因之一。研究报道,新生儿重症监护病房中NEC发生率约为7%,死亡率为10~30%,存活的部分患儿远期仍遗留神经系统并发症[7]。Biouss G等实验表明新生鼠NEC与脑损伤有关,且脑损伤严重程度与NEC严重程度相关,而抑制炎症反应可以减轻NEC导致的不良神经系统预后[8]。NEC患儿发生脑损伤的病因复杂,系多因素所致,其分子机制水平研究是目前的研究热点。CXCL1是重要的中性粒细胞趋化因子,CXCR2是其受体,它们参与炎症、神经元生长发育、少突胶质细胞增殖、迁移等,在肠、脑发育及损伤中均有重要作用[9]。在动物实验绒毛膜羊膜炎中CXCL1/CXCR2信号通路异常通过胎盘-胎儿-脑轴导致围产期脑损伤。
本研究结果显示经3%DSS灌胃P1大鼠可成功构建NEC模型;同时灌胃后72h,实验组新生鼠脑组织出现病理损伤表现,以脑室周围白质明显,表明肠道炎症之后继发了脑损伤。灌胃后3h、72h时,实验组肠组织中CXCL1蛋白表达较对照组升高,但在灌胃24h时升高不明显,可能与肠道自身修复机制有关。在灌胃后72h,实验组新生鼠脑组织CXCL1蛋白表达较对照组明显增高,但在灌胃后3h、24h升高不明显,说明脑组织中的炎症表达较肠组织有延迟,也证实了NEC相关的脑组织炎症继发于肠道炎症之后,这可能与外周炎症反应、炎症因子通过肠脑轴导致脑组织炎症反应过程相关,同时也表明,CXCL1参与了NEC相关性脑损伤。灌胃后3h、24h、72h,实验组肠组织中CXCR2表达较对照组差异无显著性,与既往研究报道一致,分析原因,可能与CXCR2主要表达分布有关,CXCR2主要表达于外周中性粒细胞及少突胶质细胞、神经元细胞等;也可能与外周血液系统可能是肠脑轴中免疫调节的重要介质有关。以往研究发现,在脑卒中患者以及全身应用LPS和单侧颈动脉结扎动物模型中均发现脑组织中CXCL1和CXCR2表达增高[10]。抑制CXCR2可减轻中性粒细胞迁移入脑、减轻脑损伤[11]。说明,CXCR2在脑损伤中发挥着重要的作用,我们的研究也发现,灌胃后3h、24h、72h实验组脑组织中CXCR2表达增高,表明CXCR2参与了NEC相关损伤。
本研究未对肠、脑组织中CXCL1/CXCR2在转录水平进行分析;未进一步对CXCR2受体进行阻断实验;也未检测其在成熟大鼠的表达情况及检测外周和中枢中性粒细胞、神经系统损伤相关胶质细胞活化情况等,在将来的实验中可以进一步深入研究。
综上所述,CXCL1/CXCR2在新生鼠NEC及其所致脑损伤中发挥作用,但其具体作用机制尚不明确,有待于进一步研究。CXCL1/CXCR2信号通路可能成为临床治疗的新靶点,减轻NEC后炎症反应及其继发性脑损伤,改善神经系统发育结局。

