数字PCR技术检测感染者尿液中SARS-CoV-2的方法研究
王志彬,罗 庆,李宝林,唐 敏,张 章,刘靳波
西南医科大学附属医院医学检验部(泸州 646000)
2019 年12 月武汉爆发由新型冠状病毒引发的肺炎,并迅速在全国蔓延[1],其传播速度超过2003年爆发的“非典”[2]。2020 年1 月10 日,世界卫生组织(World Health Organization,WHO)将该病原体命名为2019-nCoV(2019 novel coronavirus),2 月11 日,国际病毒分类委员会(International Committee on Taxonomy of Viruses,ICTV)正式宣布该病毒为严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)。
SARS-CoV-2 为正义链、单链线状RNA 冠状病毒[3],该病毒典型特征之一为无症状传播[4],传染者和被传染者在感染初期可能无症状[5],使得防控难度加大。疫情发生以来,中国政府及时采取强有力、高效能的措施使得疫情得到初步控制,但截至目前,SARS-CoV-2在许多国家和地区仍在快速传播和蔓延。感染者的及时确诊是疫情防控的关键一环,目前临床诊断主要基于临床病史、胸部CT和病毒核酸检测[6-7]。相较于临床症状的出现,核酸检测结果在促进感染者隔离、治疗、出院以及评估感染活动中起重要作用。根据WHO 诊疗指南,目前诊断SARS-CoV-2 感染的金标准是基于实时荧光定量PCR(RT-qPCR)技术的检测结果,但由于RT-qPCR 技术本身的灵敏性较低,加之标本取材差异大等,许多低拷贝病毒核酸感染者不能在一次核酸检测中检出,给疫情防控带来巨大挑战[8]。
微滴式数字PCR(droplet digital PCR,ddPCR)的工作原理是由微滴发生器将20 μL RT-qPCR反应体系分割成约20 000 个油包水的液滴单独进行PCR 反应,再通过微滴分析仪对每个油滴进行荧光信号采集,采用泊松分布概率函数计算起始模板的拷贝数[9]。与RTqPCR相比,ddPCR不需要绘制标准曲线即可实现绝对定量,对低拷贝核酸检出具有优势[10]。咽拭子等取样工作给医护人员带来暴露风险,尤其当防疫物资紧缺时。如果能通过尿液等标本代替咽拭子等进行核酸检测,将大大降低医护人员的暴露风险。研究报告指出,阳性病人尿液中含有SARS-CoV-2 核酸[11]。本研究针对5 例咽拭子阳性标本,同时进行ddPCR 和RT-qPCR实验,比较了两种技术在准确性和灵敏度上的差别,建立了最佳ddPCR 反应体系和反应程序;同时为了开发定量标本的采集方法进而应用于临床检验系统,使用ddPCR 技术检测了另外12 例阳性病人的尿液标本,评价了以尿液作为检验样本的可行性。
1 材料与方法
1.1 标本采取
2019 年12 月25 日至2020 年3 月4 日期间在西南医科大学附属医院发热门诊就诊病人和有武汉接触史的人群进行了SARS-CoV-2 病毒检测,共收集到阳性标本17份(均属不同病人),其中包括咽拭子标本5份,尿液标本(随机尿)12 份。病人纳入标准依据《新型冠状病毒肺炎诊疗方案(试行第七版)》[12]中病原学检测标准:标本收集之前病人尚未接受药物治疗以及其他治疗,标本收集后RT-PCR检测结果阳性。
1.2 仪器与试剂
仪器:EX3600 核酸自动提取仪(上海之江生物科技股份有限公司)、Bio-Rad CFX96 实时荧光定量PCR仪(美国Bio-rad 公司)、Bio-Rad QX200 微滴式数字PCR系统(美国Bio-rad公司)。
试剂:Bio-Rad Droplet Generation Oil(美国Bio-rad公司)、Bio-Rad Droplet Reader Oil(美国Bio-rad公司)、Bio-Rad 2×ddPCR supermix for probes(美国Bio-rad 公司)、引物(中国生工)、探针(中国生工)、新型冠状病毒2019-nCoV 核酸检测试剂盒(上海之江生物科技股份有限公司)。
1.3 方法
本文的方法学研究主要参照康凤凤等[13]和黄斐等[14]的报道,并参考2012 年6 月美国临床和实验室标准研究院颁布的EP17-A2文件[15]。
1.3.1 核酸提取 咽拭子SARS-CoV-2 RNA的提取:取3 倍于咽拭子体积的4%NaOH 溶液,加入咽拭子采集管中液化30 min,液化过程中每10 min振荡一次,直至样本无拉丝。取1 mL 液化后样本于13 000 rpm 离心10 min,弃上清后用生理盐水洗涤,13 000 rpm 离心10 min,留取300 μL 上清,弃除多余的上清后将剩余的300 μL上清与沉淀混匀,将混合物吸入到EX3600核酸自动提取仪配套的核酸提取预装板A 孔中(一次性可以提取36个标本),将预装版置于设备固定位置,启动核酸提取程序提取核酸。
尿液SARS-CoV-2 RNA 的提取:取尿液1.5 mL,8 000 rpm 离心5 min,弃上清1.2 mL,剩余混匀后进行核酸提取,具体步骤同上。
1.3.2 标准质粒制备与稀释 CDC-阳性质粒V2,全长2 983 bp,载体pUC57,由生工生物工程(上海)股份有限公司合成。标准质粒起始浓度为7.84×1010copies/μL。用ddH2O 将标准质粒做10 倍系列稀释,共7 个浓度(7.84×107copies/μL~7.84×101copies/μL)。
1.3.3 引物和探针 引物序列采用国家微生物科学数据中心(National Microbiology Data Center,NMDC)公布的信息,目的序列为新冠肺炎SARS-CoV-2 病毒核壳蛋白(nucleoprotein,N)基因,序列信息见表1。

表1 SARS-CoV-2病毒核壳蛋白基因引物信息Table 1 Primer information of SARS-CoV-2 virus nucleocapsid protein gene
1.3.4 ddPCR 反应体系和条件优化 进行ddPCR 之前,通过温度梯度PCR,设置51 ℃~62 ℃之间不同的温度对退火温度进行优化。使用Bio-Rad QX200微滴式数字PCR 系统进行实验,具体操作步骤参照实验仪器及试剂说明书,略有改动,主要包括PCR反应体系制备(见表2)、微滴发生、PCR 反应程序设定和微滴信号检测等。

表2 ddPCR反应体系Table 2 ddPCR reaction system
将上述反应体系混匀后加入微滴发生卡中间一排,在微滴发生卡Oil标志列加入70 μL微滴生成油,及时盖好专用胶垫后将微滴发生卡水平放置在微滴发生器的槽中制备油滴,待指示灯亮后取出微滴发生卡,将droplet 列微滴(约45 μL)全部转入96 孔板,封铝膜后置于PCR 仪中进行扩增。扩增程序为:95 ℃10 min,94 ℃30 s,60 ℃1 min,温度变化设置为2 ℃,共40个循环;扩增结束后98 ℃酶失活10 min。每个模板设置2个技术重复。扩增结束后,将96孔板放入微滴读取仪中检测探针信号,并使用QuantaSoft 软件(Bio-Rad,USA)分析数据。
1.3.5 假病毒样本的ddPCR 扩增 假病毒、阳性对照和阴性对照均来自新型冠状病毒2019-nCoV核酸检测试剂盒(上海之江生物科技股份有限公司)。假病毒标准溶液浓度为108copies/mL,分别稀释为105copies/μL、104copies/μL、103copies/μL、102copies/μL、10 copies/μL和1 copies/μL,共6个浓度进行重复性实验。假病毒核酸稀释后,在最佳反应条件下进行ddPCR扩增。每次反应中设置一个阴性对照和一个空白对照。将反应体系离心混匀,放入微滴发生卡中,通过微滴发生器产生微滴,之后将制备好的微滴(水、油分层)缓慢加入96孔板,进行PCR反应。反应程序同上,每个假病毒标本均做3个相同模板的平行反应。
1.3.6 空白限评估 空白限评估(limit of blank,LOB):参照黄斐等[14]的研究方法,检测8份(3次重复)不同浓度阴性样本核酸中SARS-CoV-2 的拷贝数,计算应用该检测平台可能出现的假阳性微滴数及概率大小。
1.3.7 统计学分析 本研究采用SPSS17.0 软件进行统计学分析,实验所得数据以均数±标准差表示,采用两组独立实验的t检验方法比较两组间差异性。
2 结果
2.1 阳性质控制备与引物特异性验证
通过温度梯度PCR,退火温度设为51℃~62 ℃,确定引物的最佳退火温度为60 ℃。以稀释后的7个不同浓度质粒为模板,以核壳蛋白基因序列为目的基因,验证引物特异性并确定阳性质控的最佳浓度。RT-qPCR结果显示见图1,每两个相邻浓度模板之间扩增曲线相差约3.3个循环,除模板浓度(编号g)(7.84×101copies/μL)的Ct 值大于30 之外,其余各浓度模板扩增曲线扩增效率良好。阴性对照无扩增,表明该体系无污染。

图1 不同浓度CDC-阳性质粒V2模板扩增曲线Figure 1 Amplification curve of CDC-positive plasmid V2 template at different concentrations
不同浓度质粒模板经40个循环扩增后,溶解曲线为单峰见图2,无引物二聚体及其它非特异性扩增,表明引物特异性良好,能用于SARS-CoV-2的检验。

图2 不同浓度CDC-阳性质粒V2模板溶解曲线Figure 2 Template dissolution curves of CDC-positive plasmid V2 at different concentrations
2.2 ddPCR反应检测结果的精密度评价
以上述7 个不同浓度的阳性质粒为模板进行ddPCR 反应。结果显示,以阳性质粒为模板(3.92 ×104copies/μL)进行ddPCR 扩增,微滴发生器生成的微滴数大于10 000,见图3。在阴性对照中,无阳性液滴生成,表明反应体系和微滴发生程序正常,能满足基本扩增和检测。

图3 ddPCR方法扩增CDC-阳性质粒V2模板一维散点图Figure 3 One dimensional scatter diagram of CDC-positive plasmid V2 template amplified by ddPCR
ddPCR 可靠性检测结果显示:所有反应中油滴总数均超过10 000,最低数量为11 343,最高数量为15 136,表明该数字PCR 平台运转良好,微滴生成数量能够满足泊松分布函数。与质粒模板的理论浓度相比,ddPCR检测结果较理论值偏低,见表3。两个机械重复之间相比较,ddPCR 结果重复性较好。ddPCR 检测结果的变异系数CV值介于0.04~12.09,表明ddPCR检测结果的准确度较好。
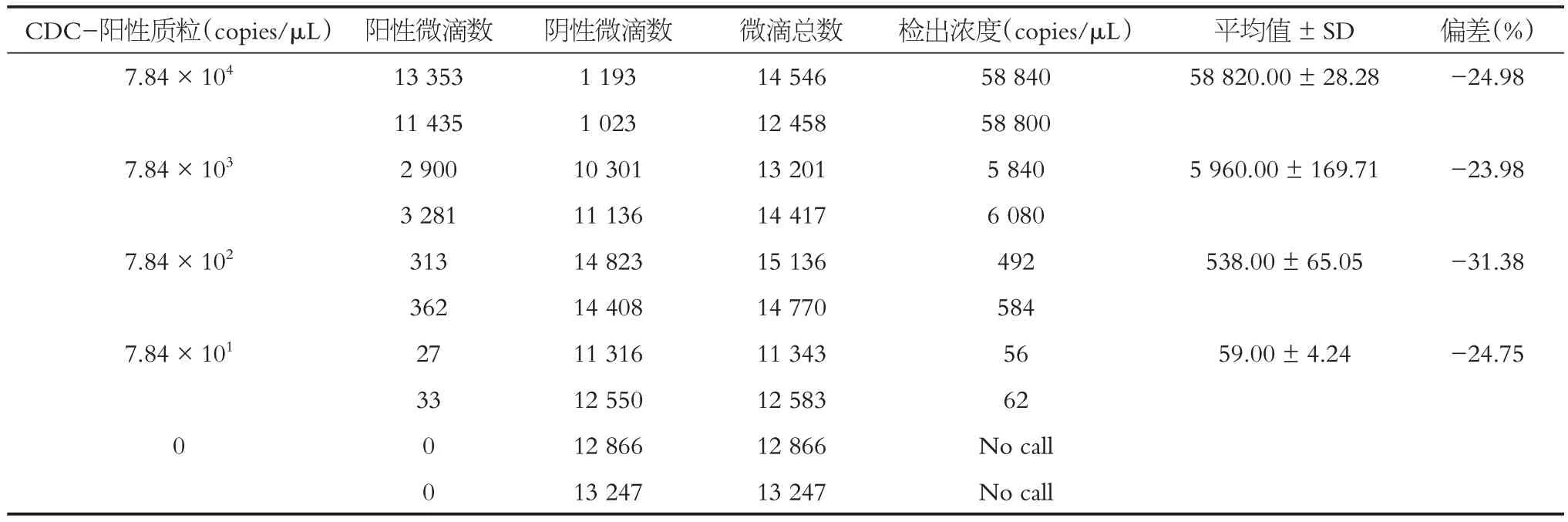
表3 核壳蛋白基因的ddPCR精密度检验Table 3 ddPCR precision test of nucleoprotein gene
以ddPCR检出结果和质粒标准浓度之间做相关性分析,结果显示两者之间具有极强的相关性,两者之间的线性关系见图4,ddPCR 检出结果与理论值呈极度正相关,ddPCR 结果正确可靠。当模板浓度超过7.84×105copies/μL 时,微滴分析仪读取不到阴性微滴,全部体系均为阳性微滴,超过机器检出限,导致读取结果错误,ddPCR检测上限应低于7.84×105copies/μL。

图4 ddPCR方法与RT-qPCR之间的线性相关性Figure 4 Linear correlation between ddPCR and RT-qPCR
2.3 ddPCR反应与RT-qPCR反应组间重复
将标准质粒的7 个浓度稀释液作为模板,以核壳蛋白(nucleoprotein,N)基因为为目的序列设计引物,进行RT-qPCR 反应,构建的标准曲线为:y=-3.317lgx+39.831,线性相关系数为R2=0.999,y为Ct值,x为浓度(copies/μL)。根据此标准曲线,通过对未知样本测定的Ct 值便可得出样本中SARS-CoV-2 的起始拷贝数,见表4。

表4 ddPCR与RT-qPCR之间的组间重复Table 4 Intergroup duplication between ddPCR and RT-qPCR
2.4 ddPCR反应重复性和可报告范围
在重复性分析实验中,ddPCR 定量检测中CV最小值为2.31%,最大值为38.35%,结果表明,ddPCR 方法具有较好的重复性。不同浓度假病毒方法间重复实验结果表明,该平台系统偏差为-17.33%~-3.80%,见表5。在重复性实验中,使用ddPCR检测到的所有结果均未超出假病毒标准品的理论浓度,表现出较高的一致性。

表5 不同浓度假病毒样本ddPCR方法组间重复Table 5 The ddPCR method of pseudovirus samples with different concentrations were repeated between groups
2.5 空白限评估
ddPCR 检测阴性标本核酸中SARS-CoV-2 拷贝数,结果发现不同浓度(随机)样本产生的微滴数在11 101~14 805之间,阳性微滴数>1即判断为假阳性,在本实验中该平台假阳性出现概率为1/24。LOB最大估计值为0.09 copies/μL。
2.6 尿液标本中SARS-CoV-2拷贝数检测
为了能使标本量化检测,同时避免咽拭子等取样工作带来的暴露风险,本研究尝试用尿液检测SARSCoV-2。12份尿液标本全部来自确诊病人。临床上使用某公司生产的核酸检测试剂盒检测病人痰液SARS-CoV-2阳性,而检测尿液结果全部为阴性,表明尿液中该病毒核酸为低拷贝。
使用ddPCR 检测这12 份尿液样本,其灵敏度增加,共9例检出,3例未检出,检出率为75%。所检出浓度范围为5.4 copies/μL~30 copies/μL。
从图5、图6 可以看出,阴性对照均无阳性微滴检出,阳性对照分别检出阳性微滴数2 226和2 561,分别对应检出浓度为4 520 copies/μL和5 500 copies/μL。

图5 尿液标本1~6号检测结果Figure 5 Detection results of urine samples 1~6
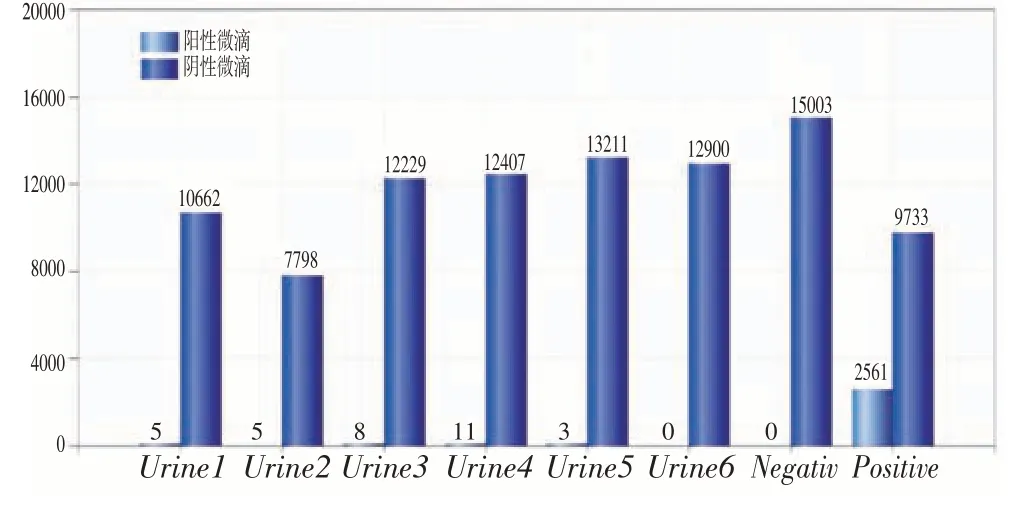
图6 尿液标本7~12号检测结果Figure 6 Detection results of urine samples 7~12
尿液标本同时使用RT-qPCR 和ddPCR进行检测,结果12 份尿液标本使用ddPCR 技术检出9 份,使用RT-qPCR 检出0 份,表明ddPCR 方法在低拷贝核酸定量检测中具有明显优势。
3 讨论
SARS-CoV-2 爆发以来,中国政府及时采取强有力的防控措施,使得疫情得到初步控制。但是,SARSCoV-2在许多国家和地区还有蔓延趋势。研究报告表明,关于该病毒的致病性、遗传特征等方面的认知相对缺乏[15],因此很难在短时间内制定一套有效的治疗方案,而快速诊断疑似病人并采取隔离防控措施,成为疫情防控的关键。
SARS-CoV-2 传播能力强而且存在无症状感染的特性。相比于CT(computed tomography)或抗体检测,核酸检测克服了滞后性,同时也是目前临床上感染者确诊和出院的主要依据[16]。但核酸检测易出现假阴性,标本采集部位、方法以及RNA 提取等过程均是SARS-CoV-2 病毒核酸检测出现假阴性的原因[8]。另外,RT-qPCR由于其检出限的限制,在临床上的应用弊端日渐突出,加之不同公司生产的试剂盒质量差别很大,致使许多疑似病例甚至阳性感染者无法在第一时间检出阳性结果,从而导致诊断延迟,给疫情防控带来巨大挑战。
ddPCR 技术优势明显,是继常规PCR 技术发展起来的一项精密检测技术,最初ddPCR 技术被用来分离单基因[17-18],在临床检验中使用较少。有报道指出,当ddPCR 应用于检测系统时,能够检测到低至0.001%的突变基因,相比于RT-qPCR,灵敏性提高1 000 倍[19]。赵欣[20]的研究结果显示,ddPCR 在临床样本定量检测时其检出率高于RT-qPCR,这与本研究得出结果相同。本研究中,RT-qPCR 可检出4 号咽拭子中1.41 copies/μL的SARS-CoV-2,却无法检出尿液中5.4~30 copies/μL(ddPCR检出值)的SARS-CoV-2。假设上述两种方法检出值都在真值范围内,这一现象无法仅仅以“尿液中该病毒核酸为低拷贝”作出解释。回到RT-qPCR 检测,在临床上针对新冠病毒的“判阳”是依据Ct值大小,如第九版新冠肺炎诊疗方案中明确规定连续两次新冠核酸检测Ct 值≥35 即可解除隔离或出院。在本研究中,4 号咽拭子中核酸浓度1.41 copies/μL 对应的Ct 值为36.03,通过常规PCR 技术检测应该判定为阴性,而ddPCR 与之相对应的检测结果为37.00 copies/μL。由此可见,ddPCR 检测可以补充RT-qPCR 检测结果,而RT-qPCR 不能补充ddPCR 的检测结果。因此,当ddPCR 检测结果为5.4~30 copies/μL 时,RT-qPCR 无法检出就得到了很好的解释。RT-qPCR检出浓度是根据Ct value带入标准曲线计算所得,为理论值,4号咽拭子Ct 值两次重复均超过35,随着Ct 值增大,结果准确性降低,国家微生物科学数据中心指南(https://nmdc.cn/nCoV)表明当RT-qPCR 结果大于37,为不准确。ddPCR将含有核酸分子的反应体系分隔成“油包水”的小液滴,在模板量适当的前提下,确保每个小液滴最多包含一条核酸分子,经PCR扩增后,利用微滴检测仪对每个微滴进行逐个扫描检测,有荧光信号的微滴判读为“1”,没有荧光信号的微滴判读为“0”,最后根据泊松分布原理及阳性微滴的个数,分析软件即可给出靶分子的绝对起始拷贝数及浓度,这个浓度的准确性有待进一步探讨,赵欣在其硕士论文中也表示,RT-qPCR的定量值始终比ddPCR高10倍,推测其原因可能是标准质粒浓度被高估所致[20]。
临床上核酸检测SARS-CoV-2的取样主要包括鼻咽拭子、口咽拭子、痰液等,当感染者病毒载量低时不能取到阳性标本,加之医护人员取样操作带来的差异,导致所取样本无法量化,也是核酸检测假阴性的原因之一。同时,咽拭子取样操作使得医护人员暴露风险增加,在防护物资紧缺时增加医护人员的感染风险。有研究表明新型冠状病毒还会导致不同程度的心理抑郁[21],因此快速、准确检出病毒,是疫情防控关键的一环。本研究开发新的取样方法和标本内容,以尿液为实验材料,定量至1.5 mL进行实验,以期在保证阳性检出率的同时,更加安全的进行传染性疾病的取样工作,更完整地鉴定感染病例并避免交叉感染。
在低拷贝核酸样本的检测中,ddPCR 技术与RTqPCR相比具有显著的优势[22-24]。临床上根据检测结果进行的确诊,不同试剂盒厂家建议只需满足在同一份标本中SARS-CoV-2 的ORF1ab基因及核壳蛋白基因至少1 个靶标特异性RT-PCR 检测结果为阳性即可,并且有研究报告指出,在检测SARS 冠状病毒时,ORF1b基因和核壳蛋白基因具有相似的准确性[25],因此本研究主要以核壳蛋白基因为靶序列。虽然本研究证实,单拷贝核酸通过ddPCR 技术检测具有优越的灵敏性,但本研究依然存在局限性。①由于泸州本地阳性病例较少,使得本研究样本量不够大,重复性不好;②ddPCR 仪器操作要求较高,很容易在不同的加样孔之间造成污染;③ddPCR 检测成本较RT-qPCR 技术高,普及困难。本研究的结果显示,12例痰液检测为阳性的感染者尿液标本,RT-qPCR检出0例,表明尿液中病毒载量低。ddPCR 技术检出9 例,表明ddPCR 技术在低载量病毒核酸检测过程中具明显优势,这也为其他重大传染性疾病的检出提供新的思路与方法,其自动化程度是值得继续研究与开发的方向。
4 结论
在低拷贝核酸样本的检测中,ddPCR 技术与RTqPCR相比,ddPCR技术在低载量病毒核酸检测过程中具有明显优势。这一结果也为其他类似的重大传染性疾病的检出提供了新的思路与方法。
(利益冲突:无)
——一道江苏高考题的奥秘解读和拓展

