胰高血糖素样肽-1受体激动剂和钠葡萄糖共转运体-2抑制剂的中枢神经系统靶点
文 松,董梅园,许程琳,李彦彦,金建兰,龚 敏,周里钢,2
1.上海市浦东医院(复旦大学附属浦东医院)内分泌科(上海 201399);2.上海市血管病变调控与重塑重点实验室(上海 201399)
肥胖症和2 型糖尿病是复杂的慢性疾病,两者的发病和治疗又是密不可分的。肥胖患病率的增加,在一定程度上是由于全球食品供应的增加,为人们提供了无处不在的美味、高能量食品。高能量美食往往通过激活大脑食欲控制回路,通过增强食物寻求、进食动机和进食愉悦感来驱动贪食症和体重增加。行为疗法(饮食和生活方式的改变)是肥胖和2型糖尿病的首选治疗方法,但它往往无法实现有意义的减肥。此外,通过这种方式减肥的人会通过生物调节逐渐恢复体重。从生物学的角度来讲,人类为了维持正常的体内生理功能和活动,需要从食物中获取能量。食物的摄入可以受到饥饿、进食频率和应激压力等条件的影响。病态的贪食和肥胖反映了有机体无法有效地维持能量平衡[1]。虽然越来越多的科研证据提示2 型糖尿病的发病和许多基因的变异(genetic variations)、基因拷贝数目的变异(copy number variations),以及基因修饰—DNA 甲基化和组蛋白修饰等相关[2],但肥胖、代谢综合征仍是2 型糖尿病形成的最主要的原因,同时肥胖的治疗,也是在没有明确2 型糖尿病的具体基因病因之前,最直接和最有效的临床治疗方式[3-4]。在生物体中,能量平衡相关的生理和行为由神经和体液系统所控制。由于临床上治疗2 型糖尿病和肥胖症的困难性,阐明中枢神经系统(central nervous system,CNS)能量平衡机制和确定CNS 中的治疗关键靶点是目前肥胖及2型糖尿病治疗的热点。本文旨在总结:①作用在CNS上控制饮食和肥胖的关键位点;②目前临床使用的最新和有效的药物,GLP-1RA和SGLT-2i是如何通过中枢神经系统的能量平衡机制和控制交感神经的机制改善肥胖及慢性心衰的。本文通过讨论GLP-1RA 和SGLT-2i治疗引起中枢神经系统回路的激活,展示其有望成为肥胖和2型糖尿病的治疗药物。
1 中枢神经系统对能量和代谢的调节
能量代谢的调节涉及有机体的能量稳态和高级神经活动如奖赏行为的调节机制。其包括神经和体液内分泌、肠道、肝脏、棕色脂肪组织(brown adipose tissue,BAT)以及骨骼肌肉,正是通过这些系统的相互作用,机体能够有效控制进食,维持内环境的稳态,故本文将从这几方面探讨能量代谢的调节。而其中下丘脑的众多核团是主要的能量稳态调节中枢,由内侧区和外侧区组成。内侧区由前、中、后3组神经元组成。弓状核(arcuate nucleus,ARC)、腹内侧核(ventromedial hypothalamic nucleus,VMN)、背内侧核(dorsomedial hypothalamic nucleus,DMN)、室 旁 核(paraventricular nucleus,PVN)、视交叉上核(suprachiasmatic nucleus,SCN)位于下丘脑内侧区,其中ARC、VMN和DMN位于中部,PVN 和SCN 位于前区。外侧区的外侧下丘脑区(lateral hypothalamic area,LHA)神经核成为了下丘脑与其他部位联络的神经纤维出口[5],见图1。
1.1 下丘脑弓状核(ARC)在能量代谢的调节中心作用
控制能量稳态的中枢主要位于下丘脑及脑干,主要由下丘脑内的核团控制,如弓状核(ARC)和室旁核(PVN)(见图1)。来自血液循环中的激素分子,如瘦素、胰岛素、GLP-1[6-7],以及营养物质[8],如脂肪酸可以通过下丘脑弓状核等附近的不完整的BBB,影响这些特殊核团内神经元对能量摄入和储存的信息感知,从而调节进食行为。此外,来自胃肠道迷走神经的传入信息可以将食物消化、胃肠运动信息传至脑干的孤束核,再由孤束核投射至下丘脑,因此我们可以感受到饱腹感或饥饿感,从而停止或增加进食[9]。然而,高级神经活动可以影响我们摄入行为,如通过奖励机制促进或抑制。比如,人们普遍认为,可口的食物会导致我们对食物“成瘾”而摄入更多,并且即使当一个人感到很饱或者能量满足时,仍然控制不了进食,如果长期持续这种状态,超越稳态饮食的享乐行为可能会导致体重增加及过度肥胖[10]。
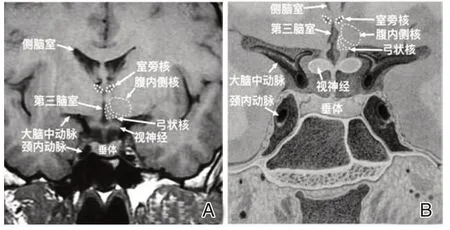
图1 下丘脑神经核团-弓状核、腹内侧核和室旁核的解剖位置Figure 1 The anatomical location of the critical hypothalamic nuclei —the arcuate,ventromedial,and paraventricular nuclei
食物摄入可以由两种相反的行为强烈驱动,厌食效应抑制进食和促食欲效应刺激食物摄入。解剖学和生理学证据表明下丘脑内的两个主要不同的细胞系列[11]:表达神经肽Y(neuropeptide Y,NPY)和刺鼠相关肽(agouti-related peptide,AgRP)的促食欲神经元,表达前阿片-黑色素皮质素(proopiomelanocortin,POMC)和可卡因-苯丙胺调节转录物(cocaine-and-amphetamine regulated transcript,CART)的厌食神经元。下丘脑内POMC/CART 或NPY/AgRP 神经元的活动导致了厌食或促进食欲作用。POMC 神经元表达肽α-MSH,有导致厌食作用,通过对POMC的转录后处理,与PVN等处的二级神经元上的黑素皮质素受体3/4(melanocortin receptor-3/4,MCR3/MCR4)结合会影响新陈代谢,从而诱导厌食效应。一项研究表明,具有获得性MC4R突变的MC4R基因敲除小鼠或人类个体与早发性严重肥胖相关。CART在ARC内与POMC共表达,抑制食物摄入,调节能量消耗。当CART 呈递给二级神经元时,可以促进饱足感产生。注射CART 可减少啮齿类动物的进食,使用CART 抗血清治疗可减少吞咽不足。类似的,CART基因的突变或多态性与肥胖发病率的增加有关。我们之前的研究[12]表明,表达5羟色胺2C受体(serotonin receptor-2,5-HT2CR)的POMC神经元可被(serotonin,5-HT)激活,从而改善葡萄糖代谢。其活化可触发从前体POMC 衍生的α-MSH 的产生增加。α-MSH作用于分布在脊髓中间外侧核(intermediolateral nucleus,IML)内的MCR4,此处含有交感节前神经元,通过激动MCR4可以改善胰岛素靶器官,如骨骼肌、肝脏、脂肪组织的胰岛素敏感性。
1.2 下丘脑腹内侧核(VMH)、杏仁核(amygdala)与血糖平衡有关
正常情况下,血糖受到升糖激素和胰岛素调节,VMH 包含葡萄糖兴奋神经元(glucose excited neuron,GE)与葡萄糖抑制神经元(glucose inhibited neuron,GI),低血糖使GI兴奋,启动反调节系统(counterregulatory response system),如下丘脑-垂体-肾上腺(HPA)轴、交感肾上腺髓质系统、胰高血糖素等,使肝糖原分解,促进糖异生,防止血糖进一步下降;而高血糖时GI抑制而GE 兴奋,减少糖异生和升糖激素分泌,从而使血糖维持平衡,研究显示这与葡萄糖激酶(glucose kinase,GK)、ATP 敏感的钾离子通道(KATP)、AMP 激活地蛋白激酶(AMP activated protein kinase,AMPK)和一氧化氮(NO)等物质的参与有关[13-15]。我们发现低血糖反调节反应受到上一级神经中枢杏仁核的影响[16]。糖尿病低血糖症定义为出现低血糖症状并且血糖低于3.9 mmol/L,而晚期糖尿病或1 型糖尿病病人可能因为长期低血糖环境,产生低血糖不敏感,甚至低于3.9 mmol/L也不产生低血糖反应,我们称之为“低血糖相关自主神经调节障碍”(hypoglycemic associated autonomic failure,HAAF),研究显示除了与胰岛功能改变有关外,也与VMH 调节障碍有关,这些病人的糖尿病状态俗称“脆性糖尿病”(brittle diabetes)[17]。
1.3 前脑纹状体的多巴胺释放与奖赏系统及糖尿病外科代谢手术机制
奖赏机制途径通过多巴胺(dopamine,DA)信号传导发挥促进食物摄入的作用。有研究认为,病态肥胖现象可能是由于长期摄入过量可口食物导致多巴胺受体2(D2r)表达降低所致[18-19]。另一项研究发现,肥胖者的贪食症可能反映了食物奖励的“喜欢”(liking)和“想要”(wanting)之间平衡的改变[20]。TSAI等独立发现的腹侧被盖区域(ventra tegmental area,VTA)是成瘾中的重要核团,其解剖位置靠近红核与黑质,并且存在较多的多巴胺能与5-HT 能神经元,主要成瘾相关的通路包括从VTA 至前额叶皮质的中脑皮质通路(mesocortical pathway),以及从VTA 至腹侧纹状体中脑边缘系统通路(meso-limbic pathway)[21]。VTA 的多巴胺及(γ-aminobutyric acid,GABA)神经通路与奖赏的调节有关[22-24]。最新的研究表明:啮齿动物腹侧纹状体接受来自近端空肠营养神经信号的投射,背侧纹状体则接受十二指肠的营养神经投射,参与奖赏促进进食[25]。而十二指肠空肠旁路手术(duodenal-jejunal bypass,DJB)能消除十二指肠的糖诱导的背侧纹状体多巴胺释放的影响,抑制葡萄糖的摄入,其中背侧纹状体含有表达多巴胺D1 受体的神经元,通过光遗传学的方法可激活这些神经元,模拟糖诱导的多巴胺释放,逆转DJB 手术对进食的抑制;另外,耶鲁大学的研究者们发现,胃肠的迷走神经传入信号并非是左右对称的,其中,背外侧臂旁核(parabrachial nucleus)连接右侧迷走性感觉性神经节至黑质,研究揭示一种通路由右侧结状神经节,臂旁核-黑质通路和背侧纹状体构成,是促胆囊收缩素(CCK)作用于食欲的必需的环节[26]。
1.4 肠道、肝脏、脂肪组织以及骨骼肌肉在能量代谢中的作用
人类的消化系统存在丰富的弥散神经内分泌系统,含有摄取胺前体脱羧细胞(APUD),多种与进食有关的内分泌激素产生于胃肠道,包括促进食欲的胃饥饿素(ghrelin),抑制食欲的胰高血糖素样肽-1(GLP-1)、促胆囊收缩素(cholecystokinin,CCK)、酪酪肽(peptide YY,PYY)和葡萄糖依赖性促胰岛素多肽(glucose dependent insulinotropic peptide,GIP)等;这些激素既可以通过局部迷走神经传递至孤束核(NTS),也可以通过血液循环到达下丘脑影响进食和体重[27]。消化道摄入食物后释放的胃肠道信号,如GLP-1,对中枢神经系统能量和代谢的调节起着重要的负反馈作用,即消化道释放的肠道激素构成了决定结束进食的重要因素。这些信号被称为饱足信号,包括胃机械反应、肠道食物能量检测和肠道肽激素释放,如GLP-1、肽YY(PYY3-36)、胆囊收缩素(CCK)等。尽管操纵GLP-1等单个信号的水平可以对摄食、体重和血糖控制产生影响,但各种胃肠道、全身和中枢信号的综合作用共同介导了食物摄入抑制的内源性控制。最近热门研究肠道菌群(microbiota)也与能量调节及多种精神神经系统疾病、自身免疫性疾病发病相关[28],其内毒素(LPS)可以产生低度炎症,肥胖与非肥胖人群肠道菌群报道有显著差别,与代谢综合征相关[29-30];但目前肠道菌群对代谢和疾病的贡献大小、补充益生元对预防糖尿病的作用尚存争议。
肝脏是人体代谢的中枢。大部分肠道激素以及胰岛素都会受到肝脏的首过消除,外源的胰岛素或GLP-1与机体内源性的激素最后的生理作用是否存在区别,这值得进一步的研究探索。非酒精性脂肪肝,现称“代谢相关性脂肪肝病”(metabolic-associated fatty liver disease,MAFLD)也与胰岛素抵抗、2 型糖尿病、痛风的发生密切相关[31-32]。我们发现肝脏产生的成纤维细胞生长因子21(fibroblast growth factor-21,FGF21)可以调节动物的体重及代谢[33]。
脂肪组织划分包括棕色、米色以及白色脂肪组织,其中白色脂肪组织可以产生能量代谢有关因子,作用于下丘脑,如瘦素(leptin)、脂联素(adiponectin)以及炎症因子,目前一致认为脂肪组织炎症(adipose tissue inflammation)与胰岛素抵抗、高血压发生相关[34-36]。儿童或幼年动物富含棕色脂肪组织,过去一直认为与产热和减重有关,其受到中枢交感神经的支配,GLP-1受体激动剂可通过解偶联蛋白(UCP-1)促进棕色脂肪组织产热,达到体重减轻的作用[37]。米色脂肪组织虽然在正常基础情况下含有少量的UCP-1,但在运动后骨骼肌产生的鸢尾素(irisin)或寒冷刺激后可以诱导其表达增加,促进白色脂肪组织分解及棕色化,因此在代谢中具有重要意义[38]。
近年来陆续有研究表明骨骼和肌肉也属于内分泌器官,已发现多种骨骼产生的因子对糖代谢具有重要作用[39],有的甚至可以影响中枢神经系统MCR4[39],如骨骼中的骨钙素(osteocalcin)具有促进胰岛素分泌,改善胰岛素抵抗作用,而我们在临床研究中发现不管是1型还是2 型糖尿病人,尤其是在酮症酸中毒情况下血骨钙素水平偏低,提示骨骼活动与糖代谢有着密切联系。骨骼肌可以产生多种肌肉因子(myokines),如irisin 和follistatins,尤其是在运动锻炼后表达增加,可以显著改善糖代谢[40]。
2 中枢神经系统对心血管自主神经系统的调节
心血管活动受到自主神经系统(autonomic nervous system)调节,该系统广泛分布于下丘脑、脑干、中脑、杏仁核以及皮层等区域。研究发现参与高血压及心衰的RAAS 系统组分可以表达于中枢神经系统,胶质细胞参与的炎症反应与高血压的病理生理过程相关[41]。心血管自主神经活动调节的相关核团包括:①参与高级活动控制的岛叶(insular cortex)和内侧前额叶(medial prefrontal cortex);②情绪状态相关的杏仁核中央核团(central nucleus of amygdala)、终纹床核(bed nucleus of stria terminalis);③下丘脑启动和协调自主神经活动、神经内分泌、行为反应和压力反应,下丘脑在心血管活动调节意义已有大量研究证明[42],包括ARC及PVN,其中PVN 与心血管活动调节既包括至脑干的交感神经途径,也包括至垂体前部与后部的神经内分泌途径;④中脑导水管周围灰质(periaqueductal gray,PAG),与自主神经、痛觉控制、压力相关、侵略性、生殖相关食物行为有关;⑤脑桥臂旁Kolliker-Fuse核,传递内脏感觉信息至前脑,与呼吸、循环相关;⑥内脏感觉传递的孤束核(NTS);⑦延髓中间网状区域尤其是腹外侧延髓(VLM),包含自主神经的前运动神经元,调节心血管、呼吸运动。这些核团的活动构成机体即时的状态,受到呼吸、睡眠觉醒、情绪状态、注意力等影响[43]。
3 GLP-1RA和SGLT-2可以通过血脑屏障
血脑屏障(BBB)是维持中枢神经系统(CNS)正常生理状态和代谢的动态屏障,但它也抑制某些药物进入CNS 影响治疗效果。在肥胖症和2 型糖尿病病人中,BBB 密闭结构是动态变化甚至受损的[44-45],因此SGLT2i 和GLP-1RA 这两种药物有可能在这种情况下通过BBB,作用于下丘脑、脑干等相同的中枢神经系统通路,但是它们的控制模式可能不同[1,46]。目前的基础和临床研究表明,GLP-1RA能穿过BBB直接或间接作用于其受体,不仅可以降低血糖水平,还可以治疗中枢神经系统疾病。利拉鲁肽、艾塞肽和利昔那肽等GLP-1RA,已被证明通过被动扩散穿过BBB[47-49];司美格鲁肽不能直接穿过正常的BBB,但可以与血清白蛋白结合,并通过脑室壁的室管膜Tanycyte细胞摄取[50]。目前虽然SGLT-2i类药物通过BBB直接的动力学证据尚处于研究中,但已有间接研究表明其在患有神经疾病如癫痫、帕金森、Alzheimer、脑卒中的病人中具有神经保护作用。
4 GLP-1 受体激动剂(GLP-1RA)治疗肥胖和2型糖尿病的神经内分泌靶点
人类的肠道L 细胞可自然分泌GLP-1[51],容易被DPP-IV 降解,只有很少部分通过血液循环到达BBB,可能通过局部的迷走神经传入影响脑干的孤束核,释放脑源性GLP-1,但目前对内源性GLP-1 是否属于激素的本质尚存争议[52]。KASTIN 等[53]观察和分析了静脉注射同位素标记的125I-[Ser8]GLP-1在ICR小鼠脑内流入率,发现标记的GLP-1 的快速流入脑实质属于一种被动扩散。许多研究也发现中枢神经系统存在GLP-1 或是其代谢物的表达证据,尤其是脑干和嗅球存在GLP-1 的表达,而GLP-1 受体(GLP-1r)可以在脑内尤其是ARC 广泛地分布[54],表明肠源性GLP-1 可能经被动转运通过BBB影响摄食中枢,但作用可能不强。生理情况下,肠源性GLP-1 易被DPP-IV 降解,半衰期不足2 min,而药理浓度的GLP-1不会完全被BBB血管内皮细胞上的DPP-IV 降解,从而可以大量进入脑实质,这也部分解释了通过抑制DPP-IV 的药物西格列汀、利格列汀等一类药物对体重和食欲微弱影响的原因。但也有研究表明[55],GLP-1 只有在与GLP-1r 结合时才能进入大脑:GLP-1r介导的转运分布在脑室周器(CVO)和下丘脑的其他部分,通过含窗孔毛细血管,和一种特殊的室管膜细胞伸长细胞(tanycyte)介导的转运。因此GLP-1 靶向中枢核团可能存在多种机制,见图2。

图2 两种降糖新药的作用靶点比较Figure 2 Comparisons of the targets of two novel hypoglycemic medications
GLP-1进入中枢神经系统后可以作用于与能量稳态有关的多种核团[46,56-57],如ARC[55]、PVN[58]、NTS[59],影响进食、体重、产热等能量平衡,而GLP-1 同时亦可影响奖赏中枢,如VTA、纹状体、海马等[60-62],继而可以影响食物的动机、成瘾、偏好等行为,调节能量的摄入。近几年,科学家们围绕GLP-1 如何影响能量代谢的核团进行了大量研究,主要是从消化系统迷走神经传入、激活交感神经系统途径,或GLP-1 通过下丘脑不完整的BBB 对下丘脑诸核团产生影响两方面探讨GLP-1 的机理及靶点。但目前被更多接受的观点可能是GLP-1 通过多种途径影响中枢神经系统[50]。GLP-1r 在ARC 激动导致的摄食和体重改变目前发现主要是通过影响POMC[55]与NPY[63]神经元的活动,而通过膜片钳电生理实验发现GLP-1RA 可以通过受体及下游带有TRPC5混合离子通道的谷氨酸能神经元信号提高并兴奋POMC 神经元,同时通过带有ATP 敏感钾离子通道(KATP)和TRPC5 的GABA 神经元抑制NPY神经元的兴奋性从而促进POMC 的活动[64];也有研究提示激动支配POMC 的突触前胞膜上的GLP-1r 可以促进POMC 的激活[65]。POMC 释放的α-MSH 可以影响5-HT 摄食有关的信号通路调节能量摄入。有研究显示T2D 病人下丘脑PVN 等区域的GLP-1r 表达明显下降[66],这提示PVN 的GLP-1 信号减弱与T2D 的病理机制相关,PVN除了接受其它代谢途径的信号[67],以及上级神经元的传入信号外[58,68],激动PVN 的GLP-1r 可以通过增加CRH 神经元的依赖PKA 通路途径信号,促进GluA1 AMPA 磷酸化及神经元胞膜的AMPA 受体表达,而PVN 的催产素、CRH 释放以及交感神经等活动可以抑制进食[69]。NTS接收消化道迷走神经GLP-1等信号的传入,已有实验证明迷走神经阻滞或是选择性迷走神经传入神经损伤能减弱外周注射GLP-1 的进食效应[70],而通过c-Fos 表达研究发现某些代谢信号改变如长期高脂饮食,可能会损害迷走神经对GLP-1的敏感性[71]。此外,NTS 旁的室周器AP 具有不完整的BBB,高度血管化[72],同时也表达GLP-1r,而尾端孤束核表达GLP-1,却不表达GLP-1r,我们推测脑部孤束核处的GLP-1 可能在外周注射GLP-1 激活迷走神经后介导了部分的减少进食作用,损毁这些室周器能减弱艾塞那肽诱导的孤束核c-Fos 表达,而迷走神经切除并不影响最后区的c-Fos 表达[73]。此外,通过组织学研究发现脊髓的IML 存在GLP-1r,并且可受NTS 的支配,而IML 可以影响靶代谢器官如肝脏、胰腺、骨骼肌等功能活动,是GLP-1 调节代谢器官的重要神经通路[12,74-75]。
5 SGLT-2i调节心血管交感神经活动的神经内分泌靶点
SGLT-2i最早来源于苹果树皮提取物根皮苷,其主要靶点是SGLT-1和SGLT-2,前者主要在小肠分布,以继发性主动转运方式吸收葡萄糖,而肾脏近曲小管大量分布的SGLT-2主要负责原尿中90%葡萄糖重吸收,但根皮苷选择性低,不良反应较多;目前改良的SGLT-2i 主要作用于SGLT-2,和少量的SGLT-1[76],由于不依赖于胰岛素,因此可以有效的排糖和促进体重减轻。SGLT-2i 在众多的临床试验中被证明能显著改善慢性心衰和减少心血管3P-MACE事件[77],除了渗透性利尿作用,还可能与有效改善心衰的神经内分泌状态有关,如抑制交感神经过度激活,抑制RAAS激活[78]。肾脏近曲小管的SGLT-2 表达量与机体的交感活性强度成正比,在多数肥胖和2型糖尿病病人或动物模型中,可以发现交感过度激活状态,以及SGLT-2在肾近曲小管过表达[79],这说明肥胖和2型糖尿病病人体内存在交感过度激活状态,而SGLT-2i 可以减少这种状态并防止并发症出现。目前对SGLT-2i作用于中枢交感神经系统的研究不多,但也有不少数据支持这种猜测,如SGLT-2i 可以改善药物所致癫痫发作[80],改善中枢下丘脑等处的神经炎症,减轻代谢综合征表现。SA-NGUANMOO等[81]同样发现达格列净能通过改善中枢线粒体氧化应激及胰岛素信号,影响炎症及凋亡,并且可以改善认知功能衰退,如恢复海马的突触可塑性,炎症信号、胰岛素信号的改善是海马功能改善的主要原因,促进认知功能恢复的同时也可能通过HPA轴降低血皮质醇的浓度,一定程度上影响代谢综合征导致的认知功能受损及血压波动[82]。也有研究提示当将SGLT-2i 输入老鼠的脑部后,可以明显促进进食代偿能量不足[83],也与产热神经通路的调节改变有关[84]。SGLT-2i 对心血管活动的调节具有明显的中枢效应,如有研究发现,使用鲁格列净可以改善SHRcp 大鼠的血压节律[85],可能机制是影响下丘脑视上核活动;而现有间接研究提示SGLT-2i 可以改善诸如Alzheimer、帕金森等退行性疾病,病理机制包括影响Alzheimer胆碱酯酶活性[86],通过对接研究发现SGLT-2i也可能影响帕金森病A2A腺苷受体[87];在这类疾病中,脑部的BBB可能因为氧化应激等活动出现结构改变,因此SGLT-2i 在这种状态下有极大可能性通过受损的BBB[88]。此外研究也提示SGLT-2i 可以影响肠道菌群的改变,影响脑肠轴GLP-1、Ghrelin 等激素分泌,改善代谢综合征和心血管系统获益[89]。
我们之前的研究发现中枢SGLT-2 可以分布于下丘脑、中脑、杏仁核、脑干等与自主神经活动相关的区域,SGLT-2i达格列净可以改变小鼠的血压、心率,激活脑部c-Fos 表达[90]。SGLT-2i 具有分子小、脂溶性特点,可能通过BBB。而SGLT-2i 改善心衰的神经内分泌机制仍不甚清楚,有待进一步研究。
6 小结
本文主要总结了2型糖尿病发病的神经内分泌机制,而两种降糖新药可以改善相关的神经内分泌状态,与传统的降糖药物不同,GLP-1RA 主要影响肥胖的中枢代谢有关的靶点,而SGLT-2i 则主要针对心血管交感神经活动。通过介绍能量代谢与心血管活动调节,以及两种降糖药物的神经内分泌靶点,希望有助于更多靶向药物的研发。
(利益冲突:无)

