单孔胸腔镜在右上肺段切除中的临床应用
胡 智,戴天阳
西南医科大学附属医院胸外科(泸州 646000)
胸腔镜手术(video-assisted thoracic surgery,VATS)最早于二十世纪初在临床上应用于肺部疾病治疗。SWANSON 等[1]首次通过RCT 试验确认胸腔镜肺叶切除在临床上的可行性。而单孔胸腔镜技术(uniportal video-assisted thoracic surgery,UVATS)是胸腔镜进一步微创化的表现。单孔胸腔镜最初用于肺叶楔形切除[2],之后单孔胸腔镜在肺叶、全肺、支气管袖、肺动脉袖式切除重建等术式中逐步开始应用[3-8]。近年来随着胸腔镜手术的经验积累和器械改进,单孔胸腔镜在全球范围内逐渐兴起,随着JCOG0802等临床试验数据公布及肺癌早筛的普及,肺段以及联合亚段切除术在临床应用日趋广泛,但肺段切除术在解剖和操作方面的要求有别于过往[9-10]。本文通过分享国内外研究经验,以2021 年1 月至6 月于西南医科大学附属医院胸外科行右肺上叶S1、S2、S3 段切除术的病人为例介绍完全单孔肺段切除的流程、技巧及一些单孔胸腔镜思考,希望对此类手术的开展提供一定的借鉴和参考。
1 资料与方法
1.1 临床资料
病人共16 例,其中男7 例、女9 例,中位年龄52.5(36~68)岁。术前常规采用胸部高分辨薄层CT及三维重建检查,明确病变大小、性质、位置,并完成对靶段切除范围、段门支气管及血管分支变异情况的评估。以结节最大直径≤2 cm,磨玻璃病变(groundglassopacity,GGO)成分≥50%作为手术指征。术前完成肿瘤转移排查,常规行血实验室检测、心肺功能评估,对于高龄(≥70岁)和/或合并高血压、糖尿病、冠脉钙化明显的病人行冠状动脉造影检查。病人一般资料见表1。

表1 病人一般资料Table 1 General information of patients
1.2 手术方法
病人取健侧卧位,静脉吸入复合全麻。术者,扶镜手居于病人腹侧,助手居于病人背侧。切口取腋后线第5 肋间(3~4 cm),放置保护套,切口后缘垂直置30度胸腔镜,助手扶住肺叶牵拉钳。手术入路:S1段切除通常经奇静脉弓下入路;S2 段切除经后纵膈上叶支气管入路;S3段切除一般打开水平裂,经肺静脉入路。靶段结构解剖处理:①S1段切除:于奇静脉下缘打开纵膈胸膜显露肺门,游离V1a+b(肺静脉最上分支并向肺尖走形)并切断;进一步往深面解剖显露A1 和A3,优先切断A1 腹侧分支,血管以丝线或Hem-o-lock 结扎后超声刀离断。解剖上叶支气管向后纵隔背侧确认B1和B2 分叉,分离后依据支气管粗细选择适宜钉舱离断,膨胀萎陷确定S1 边界,沿V1b 和V2a,膨胀萎缩线切割。②S2 段切除:暴露中心静脉,向腹侧、外周牵拉V2,切断沿上叶下缘走形的V2t,进一步往深面解剖显露A2 的后升支,显露离断A2 后段升支后辨识B2 与B3。膨胀萎陷确定S2边界,沿V2a和V2c,膨胀萎缩线切割。③S3 段切除:打开纵膈胸膜显露肺门,识别V1b,进一步往深面解剖中央静脉,并向外周游离,依次显露V3b、V3a和V2c,离断V3b,辨别A1和A3,A3一般走行于V1b腹侧。离断A3后,分离B3前面的淋巴结并予以显露B3 离断。膨胀萎陷确定S3 边界,沿V1b 和V2c,膨胀萎缩线切割。段间平面在靶段门结构离断后,沿静脉或支气管向肺实质游离,经麻醉师纯氧鼓肺后自然萎陷,约20 min 左右以直线切割缝合器配合超声刀裁剪段间平面,术毕切口上下肋间以罗哌卡因行肋间神经阻滞,放置胸腔引流管连接负压引流球或水封瓶,手术结束。
2 结果
2.1 手术结果
16例病人均在单孔操作下顺利完成,无术中中转。13 例病人为单个病灶,3 例合并同侧病灶同期行手术切除,中位手术时间145(80~205)min,中位术中出血量50(20~150)mL,中位术后胸管留置时间3(3~12)d,中位术后住院时间4(4~8)d,病灶中位最大直径1.1(0.8~1.8)cm。术后病理:原位腺癌(adenocarcinoma in situ,AIS) 8 例、微浸润癌(minimally invasive adenocarcinoma,MIA)7 例、浸润癌(invasive adenocarcinoma,IA)1 例。中位采样淋巴结3(1~9)个。术后并发症包括:1例病人持续少量肺漏气,带管出院,出院后1 w返院拔管。全组无围术期死亡,病人手术结果详见表2。
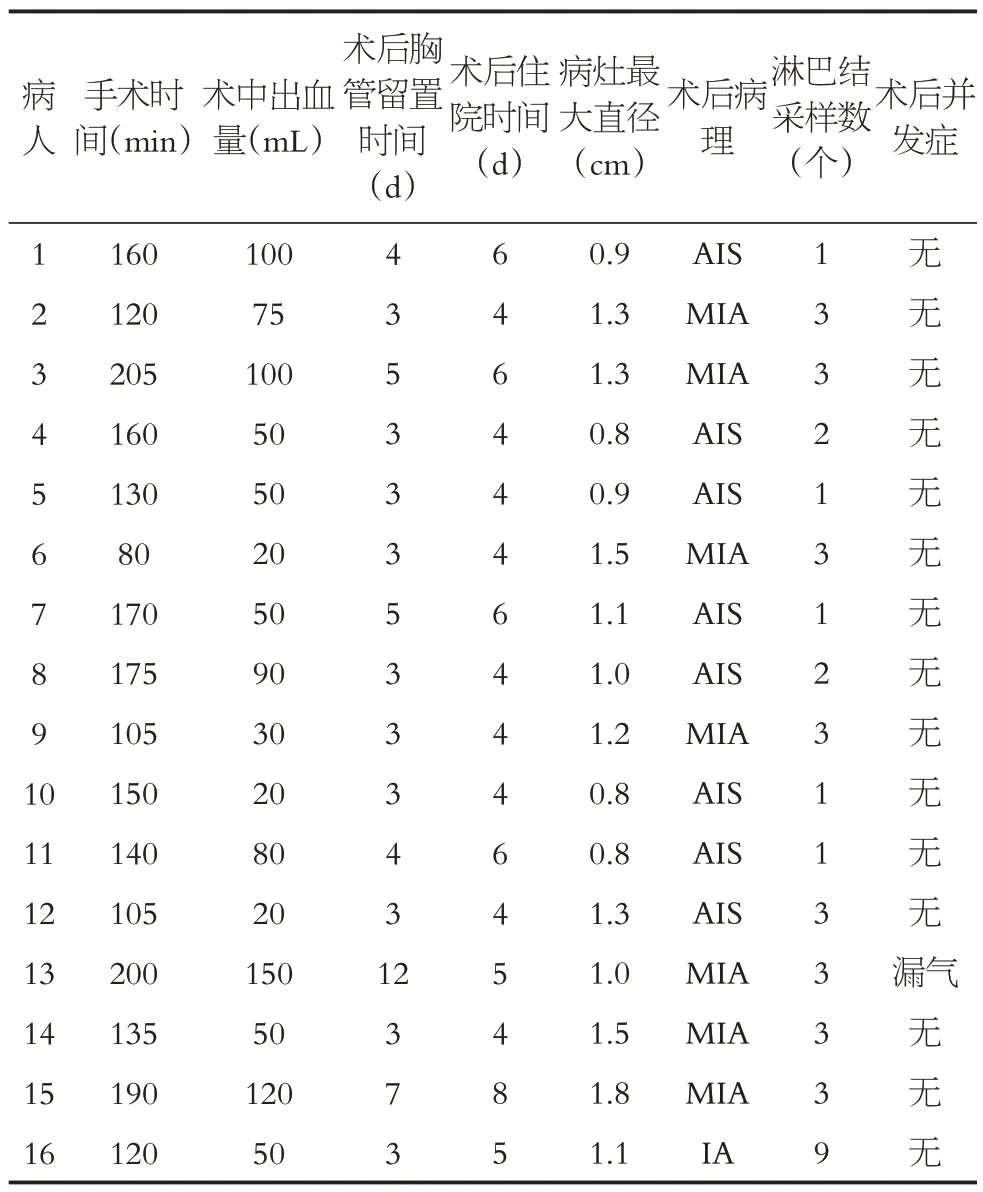
表2 病人手术结果Table 2 Surgical results
2.2 右上肺段解剖辨识及手术处理
A1 和A3 段动脉分支源于肺动脉上干,A2 上行动脉起源于叶间动脉,84%的病人存在A2 反支。NAGASHIMA[11]曾用三维重建技术将右肺上叶动脉走行进行了总结分类(见图1),其中上干型:右肺动脉的第一支;下干型:右主肺动脉的第二支,起源于动脉的纵隔面,位于肺动脉上干至中叶的近端区域之间;升支型:起源于右肺动脉的叶间部分,通常从第一中叶动脉的远端分支。上干型(Tr.sup)+升支型(A.asc)占71.9%。下干型(Tr.inf)占17.1%,并可进一步分为两个类型,Tr.sup+Tr.Inf+A.asc(13.7 %)和Tr.sup +Tr.inf(3.4%)。单纯上干型(Tr.sup)占9.9%。

图1 右上肺动脉各支走行模式图[11]Figure 1 Types of branching in the right upper lobe arteries
如果A1 分支和A2 反支难以区分,应保留A1 背侧分支,因为它可能是A2反支。确认不是A2反支后,首先理断A1腹侧分支。右上肺支气管分为B1、B2和B3,走行大体可分为三类:三叉型(B1、B2、B3独立走行)最常见,占44.1%;双叉型占29.3%,包含三个亚型:B3和B1+2 占14.4 %,B2 和B1+3 占8.8 %,B1 和B2+3 占6.1%;B1 缺失型(B2+BX1a 和B3+BX1b)占4.9%,B2缺失型(B1+BX2a 和B3+BX2b)占2.3%;四分型(B1a+B1b+B2+B3)极为少见,仅占0.8%。右上肺支气管各支走行分类见图2。

图2 右上肺支气管各支走行模式图[11]Figure 2 Types of branching of the right upper lobe bronchus
当计划S2 或S3 节段切除术时,辨识B2 和B3 尤其重要,手术中应将肺叶牵向腹侧,寻找V2a+b,可以观察到B2 走形于V2a+b 前,而B3 走形于V2a+b 后,这有助于暴露B2和B3。段间静脉源于尖段V1和中央静脉V.cent。V1b(S1和S3的段间静脉)和V2a(S1和S2的段间静脉)走行于S3和S2段。事实上现阶段的膨胀萎陷是基于静脉回流,而非支气管边界。右上肺段切除中,多采用肺门静脉入路,SHIMIZU[12]曾总结了右上肺静脉分支走行归纳为四类(见图3):前干合并中心静脉型(Anterior with Central)约占80%,而前干合并中心静脉型(Anterior with Central)根据前干组成可分成Iab 和Ib两种亚型;单纯前干型(V1-2汇入V.ant)约占12%;单纯中心静脉型(V1-2汇入V.cent)约占7%。

图3 右上肺静脉各支走行模式图[12]Figure 3 Types of branching of right upper lobe veins
Iab 亚型:前干收纳V1a 和V1b,V2c(S2 和S3 的段间静脉)汇入中心静脉,V1b(S1和S3的段间静脉)流入V.ant。Ib 亚型:前干仅收纳V1b,V2c(S2 和S3 的段间静脉)汇入中心静脉,V1b(S1和S3的段间静脉)流入V.ant。当计划S1或S3节段切除术时,有必要肺门向远端游离,以确定V1b。在中央型中,VX1b(S1和S3的段间静脉)流入V.cent,经叶间裂显露中心静脉就显得十分重要,尤其对于S1和S2切除,VX1b在V2c外侧流入V.cent,还是在V2c中央侧流入V.cent。当S1或S2节段切除计划用于此型时,如果V2c 被错误地识别为V.cent,则无法识别V2a(实际上是VX2a),因为V2a 流入V.ant。V1b(S1 和S3 的段间静脉)流入V.ant,当计划S1或S3 节段切除术时,有必要肺门向远端游离,以确定V1b。V3a和V2c术中容易辨识错误,一般根据其与V.cent的汇入角度加以辅助鉴别。V2c位于斜裂后上侧,走行常与V2a+b 伴行,V3a 起源于V.cent,走行垂直进入肺裂中央。
3 讨论
解剖性肺段及肺叶切除术研究方面,单孔胸腔镜肺段切除过程中,解剖变异度大是手术难点[13-14]。手术切除流程可结合传统开胸和VATS经验,首先从肺裂入路,建立隧道离端叶间裂,解剖靶段血管[15-16]。难点在肺裂融合的处理,牛玲莉等[17]介绍单向式切除的理念可供学习。
AL-AMERI等[18]回顾分析了瑞典卡罗琳斯卡大学医院2016年至2018年肺癌病人资料,发现单孔淋巴结清扫的阳性率和多孔没有差别(0.8% VS 1.4%)。MATSUURA 等[19]通过PSM 分析2017 年至2020 年胸腔镜资料,发现单孔淋巴结清扫数量不低于多孔。本团队总结发现手术过程中应充分松解肺门、纵隔结缔组织;在离端支气管前,肺叶牵拉便于显露7、10 组淋巴结,尤其对于7组淋巴结,助手应牵拉肺叶朝向前纵隔使隆突区域扩大、变浅,同时用弯头吸引器适当推挡周围血管、食管;而对于2R、4R 组淋巴结,首先从奇静脉弓下方紧贴腔静脉后气管表面解剖,弯头吸引器则将奇静脉弓挑起,直至解剖至弓上再打开上纵隔胸膜,再用吸引器弧面将大块淋巴结结缔组织推挡至后纵隔,逐步显露切除2R、4R组淋巴结。
单孔胸腔镜对血管的解剖离端是手术成败的关键。软质束带穿过血管间隙或段支气管后牵拉束带后置入切割缝合器,可以解决单孔角度受限的问题[20]。我们体会:血管牵引与切割器的放置呈反向作用,极易撕裂出现术中出血,应极为谨慎。而对于大血管离端,切割路径远端充分解剖极为重要,同时切割器头端安装鹰嘴可以降低难度。估计出血可能或段门粘连的情况,可预先阻断肺动脉后进行解剖。肺段术后漏气是常见的并发症之一。刘磊等[21]报道了铥激光处理肺组织切割,这说明铥激光技术在防止肺断端漏气方面具有足够的安全性。我们体会肺段裁剪过程中,对段门的充分松解,实现段裂降维切割处理,可以有效减少肺漏气的发生。胸腔镜术后疼痛是术后常见的并发症。TOSI[22]利用意大利VATS数据库资料,回顾分析了临床I-II期NSCLC肺叶切除术病人单孔VATS和三孔VATS的临床资料,发现单孔VATS肺叶切除术在术后第2、3 d具有较高的(中度/重度)疼痛风险。PERNA等[23]开展了一项比较单孔VATS 和多孔VATS 肺叶切除术的随机单中心研究,结果发现前3 d的视觉模拟疼痛评分中位数没有显示出统计上的显著差异(分别为P=0.58、P=0.64、P=0.85);同样,前3 d吗啡使用的中位数也没有显示出统计上的显著差异(分别为P=0.72、P=0.81、P=0.64)。以上研究结果提示单孔VATS 并没有在减少术后疼痛方面体现优势。本研究团队术中使用切口保护套,器械也多以垂直位进入胸腔操作,术毕采取肋间神经直视下神经阻滞,术后采用静脉、口服以及外用止痛贴等进行镇痛。我们认为不应当简单以切口数目来预测术后疼痛程度,单孔微创下多模式镇痛才是病人获益途径。周健等[24]对2 112 例围术期单孔与三孔胸腔镜肺叶临床资料进行匹配分析发现,两者在围术期效果方面并没有显著差异。MAGOULIOTIS等[25]开展的荟萃分析结果显示单孔VATS 的并发症发生率更低[OR=0.76(95%CI:0.62~0.93),P=0.008],胸管持续时间、住院时间显著缩短,但术后疼痛程度未发现显著差异。
4 结论
通过对国内外经验以及本团队的实践总结,我们认为单孔VATS 是安全、可行的,但仍缺乏前瞻性多中心研究。手术处理上,支气管变异度较大,切除前应做三维规划,术中标准操作流程仍有待进一步规范。入路根据肺裂发育,静脉优势特点来选择。段间静脉变异较大,在一定程度上增加了手术难度。
(利益冲突:无)

