维生素D3对非酒精性脂肪性肝病大鼠血脂代谢的影响
赵文欣,李佳潞,项 恋,程 磊,张晶晶,杜庭婉,马 玲
西南医科大学公共卫生学院营养与食品卫生学教研室(泸州 646000)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种受代谢、基因、环境和肠道微生物等多种因素调节的代谢应激性肝脏疾病,主要表现为肝脏脂肪沉积与炎症坏死等[1]。NAFLD 患病率不仅在欧美等发达国家逐年上升,在我国发病率亦逐年上升,目前NAFLD 已经超越病毒性肝炎成为全球患病率最高的慢性肝病[2],是威胁全世界人民健康的重大公共卫生问题。2008 年至2018 年共10 年间,我国NAFLD 患病率从18%增长至29.2%,预计2030 年患病人数将增至3.1458 亿例;同期北美患病率为18.8%,在超重人群中患病率为28%;在意大利,78.8%的代谢综合征病人存在NAFLD[1,3-5]。维生素D 是一种脂溶性维生素,分为维生素D2和维生素D3,主要参与调节机体钙、磷代谢和糖脂代谢。经膳食摄入或皮肤合成的维生素D3在肝脏被羟化为25(OH)D3后释放入血,经由维生素D 结合蛋白携带进入肾脏进一步被羟化为活性1,25(OH)2D3并重新释放入血,到达相应靶器官发挥生物学效应。人群研究发现,维生素D 缺乏是NAFLD 的一项危险因素[6-8],其缺乏时可加重肝脏的胰岛素抵抗(insulin resistance,IR)、脂质沉淀、坏死性炎症和进展性纤维化等,这可能经由下调参与脂质代谢的维生素D受体(vitamin D receptor,VDR)的表达[9],及下调肝脏中与氧化应激、炎症反应相关基因的表达而实现[10-11]。故本研究采用维生素D3干预高脂饮食诱导建立的NAFLD 模型大鼠,探究其是否可以改善NAFLD的脂质代谢和肝细胞损伤情况。
1 材料和方法
1.1 实验动物
SPF 级雄性Wistar 大鼠48 只,5 w 龄,体重140~150 g,由成都达硕实验动物有限公司供应,实验单位使用许可证号:SYXK(川)2018-065,实验动物生产许可证号:SCXK(川)2015-030。大鼠饲养于西南医科大学实验动物中心屏障系统,环境温度19 ℃~26 ℃、湿度40%~70%、12 h/12 h明暗交替,自由摄食饮水,每3 d更换一次垫料。动物实验方案得到了西南医科大学动物伦理委员会的批准许可。
1.2 实验饲料
高脂饲料及标准对照饲料均由北京博泰宏达生物技术有限公司提供。高脂饲料HDOO1 配方为:25.4%脂肪,2%胆固醇,24.2%蛋白质,42.1%碳水化合物,5.8%粗纤维,1.7%钙,1.1%磷;能量占比4.7 kcal/gm。标准对照饲料配方为:4.5%脂肪,21.1%蛋白质,60.6%碳水化合物,7.7%粗纤维,1.8%钙,1.2%磷;能量占比3.6 kcal/gm。
1.3 试剂与仪器
1.3.1 试剂与试剂盒 维生素D3(粉剂,67-97-0,美国Sigma);玉米油(8001-30-7,上海阿拉丁生化科技股份有限公司);游离脂肪酸试剂盒(比色法,A042-1-1,南京建成生物工程研究所);甘油三酯试剂盒(微板法,A110-1-1,南京建成生物工程研究所);25(OH)D3的ELISA试剂盒(E-EL-0015c,Elabscience)。
1.3.2 仪器 全自动生化分析仪(日本Olympus AU680);转轮式切片机(徕卡-2016,德国);TSJ-Ⅱ型全自动封闭式组织脱水机(常州市中威电子仪器有限公司);BMJ-Ⅲ型包埋机(常州郊区中威电子仪器厂);PHY-Ⅲ型病理组织漂烘仪(常州市中威电子仪器有限公司);数码三目摄像显微镜(BA400Digital,麦克奥迪实业集团有限公司);生物显微镜CX40(配数码相机)等。
1.4 大鼠造模、动物分组及干预
大鼠适应性喂养1 w后根据体重进行分层,按随机数字大小进行分笼,分为对照组(CON 组,n=16)和模型组(HFD 组,n=32),分别应用标准对照饲料和高脂饲料喂养6 w,第6 w末两组分别解剖8只大鼠,以观察到肝组织HE 染色切片中脂肪变性的肝细胞占单位面积的1/3 以上和血液生化指标中TC 和TG 水平较CON组明显增加[12]作为判断造模成功的指标,剩下的HFD组分别以8 只为一组分成3 个处理组,分别是模型组(HFD 组,n=8)、干预组(HFD+VD3组,n=8)、溶媒对照组(HFD+Oil组,n=8),各组给予饲料的方式和时间不变,自由摄食、饮水。第7~13 w 每日16:00,维生素D3干预组以浓度为2.5 μg/mL 溶于玉米油的维生素D3[12.5 μg/(kg·bw)]灌胃,溶媒对照组直接灌胃玉米油[5 mL/(kg·bw)],干预期间观察大鼠生命体征及体重变化。
1.5 动物处置和样本制备
标准对照饲料和高脂饲料喂养至第6 w时,所有大鼠禁食不禁水12 h,次日从CON 组和HFD 组各随机抽取8 只大鼠采用戊巴比妥钠[1 g/(kg·bw)]麻醉,心脏取血,血清离心后于-80 ℃贮存,收集肝脏并称量湿重,取肝最大叶的同一部位,肝组织与多聚甲醛溶液(1:10)常温固定保存,待病理组织观察。维生素D3干预至第13 w时以同样方法收集血清和肝脏。
1.6 体重、肝重、肝脏指数测定
从实验开始到结束,所有大鼠每隔1 d 测一次体重。取肝脏,用预冷的生理盐水清洗后,滤纸拭干,采用万分之一天平称量肝重,Lee’s指数=[体重(g)1/3×1 000]/体长(cm),肝脏指数(%)=肝脏重量(g)/体重(g)×100%。
1.7 血生化指标及TG、FFA和25(OH)D3含量的测定
采用Olympus AU680 全自动生化分析仪测定血清生化指标:总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C),肝功能指标:天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)水平。采用甘油三酯试剂盒与游离脂肪酸试剂盒测定肝脏组织的甘油三酯(TG)与游离脂肪酸(FFA)含量。采用ELISA 试剂盒测定血清25(OH)D3含量。所有操作按说明书进行。
1.8 肝脏组织病理检查
委托成都里来生物科技有限公司进行肝脏组织HE染色并镜检观察肝脏组织病理学改变。
1.9 统计学方法
采用SPSS 25.0软件对实验数据进行统计分析,结果以均数±标准差()描述,满足参数检验条件的用方差分析(多组间)或t检验(两组间),α=0.05。
2 结果
2.1 高脂饮食干预6 w 对大鼠血脂、病理组织形态学的影响
2.1.1 高脂饮食干预6 w对大鼠血脂的影响 高脂饮食干预6 w 后,HFD 组血清TG、TC 和LDL-C 水平较CON组均显著增高(P<0.05),血清HDL-C水平较对照组略有提高,但差异无统计学意义(P>0.05),见表1、图1。
表1 高脂饮食干预6 w对大鼠血脂的影响(,n=8)Table 1 Effects of high-fat diet intervention for 6 weeks on bloods lipids in rats(,n=8)
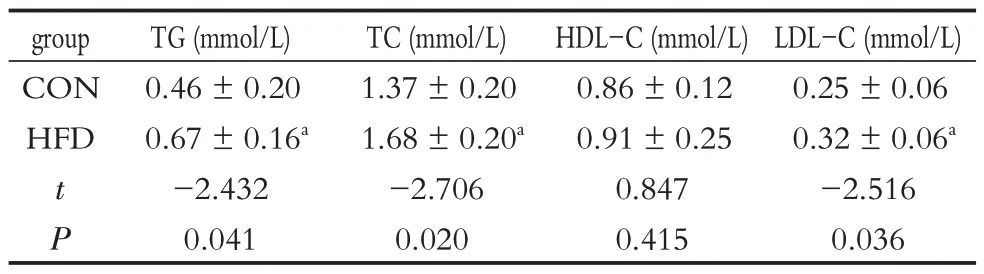
表1 高脂饮食干预6 w对大鼠血脂的影响(,n=8)Table 1 Effects of high-fat diet intervention for 6 weeks on bloods lipids in rats(,n=8)
注:a表示与CON组相比,P <0.05

图1 高脂饮食干预6 w对大鼠血脂的影响(,n=8)Figure 1 Effects of high-fat diet intervention for 6 weeks on blood lipids in rats(,n=8)
2.1.2 高脂饮食干预6 w 对大鼠病理学形态的影响HE染色后,显微镜下可观察到CON组肝脏组织结构较为清晰,被膜完整,肝小叶分叶不明显,肝细胞呈放射状排列,少量肝细胞内可见圆形透明脂滴,其他未见明显病理改变;HFD组肝小叶分叶不明显,脂肪变性的肝细胞占单位面积的1/3以上,见变性细胞胞质内大量圆形透明脂滴聚集,脂滴大小不等,肝细胞气球样变,门管区周围或肝小叶内不等量的肝细胞小灶状坏死及少量炎细胞浸润,成模率达到100%,见图2~5。
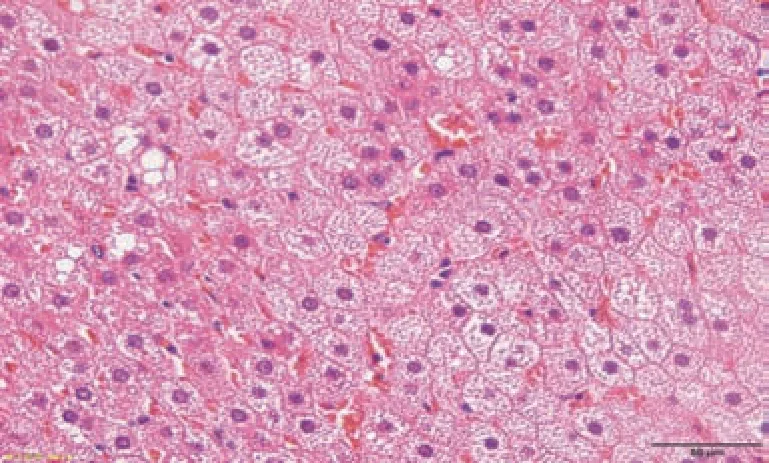
图2 高脂饮食干预6 w肝脏HE染色:CON(×200)Figure 2 Liver HE staining after high-fat diet intervention for 6w:CON(×200)
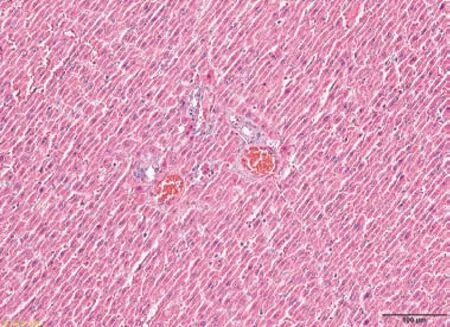
图3 高脂饮食干预6 w肝脏HE染色:HFD(×200)Figure 3 Liver HE staining after high-fat diet intervention for 6w:HFD(×200)

图4 高脂饮食干预6 w肝脏HE染色:CON(×400)Figure 4 Liver HE staining after high-fat diet intervention for 6w:CON(×400)

图5 高脂饮食干预6 w肝脏HE染色:HFD(×400)Figure 5 Liver HE staining after high-fat diet intervention for 6w:HFD(×400)
2.2 维生素D3干预7 w 对NAFLD 大鼠血脂、肝功、病理学形态等的影响
2.2.1 维生素D3干预7 w 对NAFLD 大鼠肝重、体重、肝指数、Lee’s指数的影响 与CON组相比,HFD组大鼠体重、肝重、肝指数、Lee’s指数均显著升高(P<0.05)。与HFD+Oil 组相比,HFD+VD3组肝指数明显降低(P<0.05),Lee’s指数和肝重降低,体重上升,但差异无统计学意义(P>0.05)。与HFD组相比,HFD+VD3组上述四项指标均有降低;HFD+Oil 组肝重和体重降低,肝指数和Lee’s指数上升,但差异均无统计学意义(P>0.05)。综上,不可以忽略溶媒对于大鼠的影响,即不能用HFD组数据代替HFD+Oil 组,故后续数据仅比较HFD+Oil组与HFD+VD3组之间的差异以观察干预组所产生的效应,见表2、图6。
表2 维生素D3干预7 w对NAFLD大鼠肝重、体重、肝指数、Lee’s指数的影响(,n=8)Table 2 Effects of VD3 intervention for 7 w on liver index,body index,liver index and Lee’s index in NAFLD rats(,n=8)

表2 维生素D3干预7 w对NAFLD大鼠肝重、体重、肝指数、Lee’s指数的影响(,n=8)Table 2 Effects of VD3 intervention for 7 w on liver index,body index,liver index and Lee’s index in NAFLD rats(,n=8)
注:a表示与CON组相比,P <0.05;aa 表示与CON组相比,P <0.001;b表示与HFD+Oil组相比,P <0.05
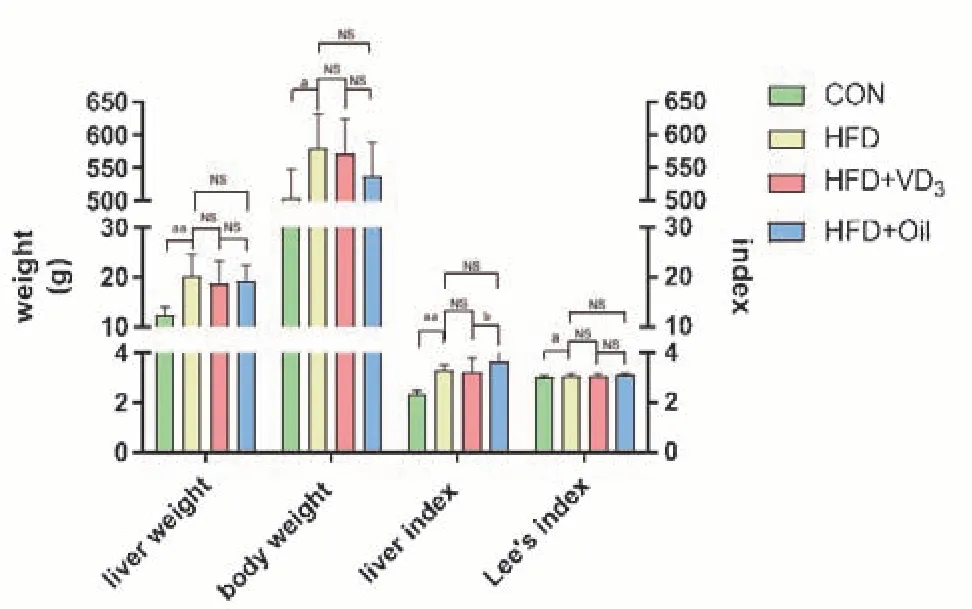
图6 维生素D3干预7 w对NAFLD大鼠肝重、体重、肝指数、Lee’s指数的影响(,n=8)Figure 6 Effects of VD3 intervention for 7 w on liver index,body index,liver index and Lee’s index in NAFLD rats(,n=8)
2.2.2 维生素D3干预7 w 对NAFLD 大鼠血脂的影响与CON 组相比,HFD 组血清TG、HDL-C 水平均显著降低(P<0.001),LDL-C水平明显升高(P<0.001),TC水平有一定程度的下降,但差异无统计学意义(P>0.05)。与HFD+Oil 组相比,HFD+VD3组血清TG、TC、LDL-C 水平均明显降低(P<0.001),HDL-C 水平有下降但差异无统计学意义(P>0.05),见表3、图7。
表3 维生素D3干预7 w对NAFLD大鼠血清TG、TC、HDL-C、LDLC的影响(,n=8)Table 3 Effects of VD3 intervention for 7 w on serum level of TG,TC,HDL-C and LDL-C in NAFLD rats(,n=8)
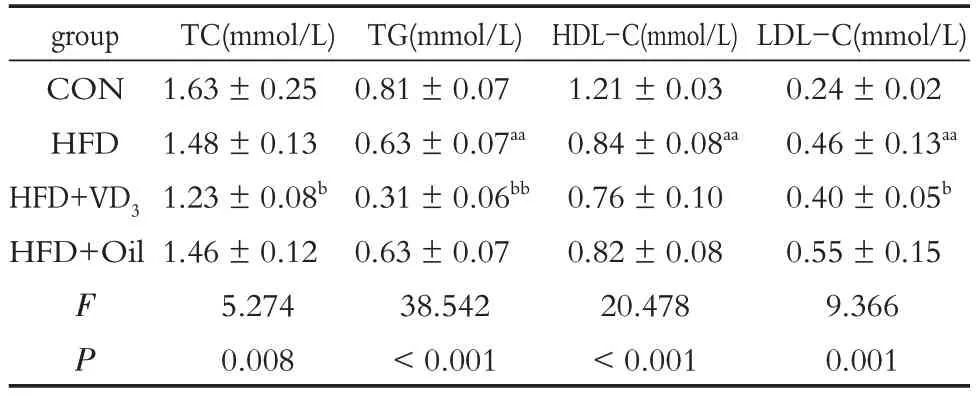
表3 维生素D3干预7 w对NAFLD大鼠血清TG、TC、HDL-C、LDLC的影响(,n=8)Table 3 Effects of VD3 intervention for 7 w on serum level of TG,TC,HDL-C and LDL-C in NAFLD rats(,n=8)
注:a 表示与CON组相比,P <0.05;aa 表示与CON组相比,P <0.001;b 表示与HFD+Oil 组相比,P <0.05;bb 表示与HFD+Oil 组相比,P <0.001

图7 维生素D3干预7 w对NAFLD大鼠血清TG、TC、HDL-C、LDL-C的影响(,n=8)Figure 7 Effects of VD3 intervention for 7 w on serum levels of TG,TC,HDL-C and LDL-C in NAFLD rats(,n=8)
2.2.3 维生素D3干预7 w 对NAFLD 大鼠肝组织脂质含量的影响与CON组相比,HFD组大鼠的肝组织TG、FFA 含量升高(P<0.05)。与HFD+Oil 组相比,HFD+VD3组上述两指标均显著降低(P<0.001),见表4、图8。
表4 维生素D3干预7 w对NAFLD大鼠肝组织TG、FFA含量的影响(,n=8)Table 4 Effects of VD3 intervention for 7 w on TG,FFA level in liver tissue of NAFLD rats(,n=8)

表4 维生素D3干预7 w对NAFLD大鼠肝组织TG、FFA含量的影响(,n=8)Table 4 Effects of VD3 intervention for 7 w on TG,FFA level in liver tissue of NAFLD rats(,n=8)
注:a 表示与CON组相比,P <0.05;aa 表示与CON组相比,P <0.001;b 表示与HFD+Oil组相比,P <0.05;bb 表示与HFD+Oil组相比,P <0.001
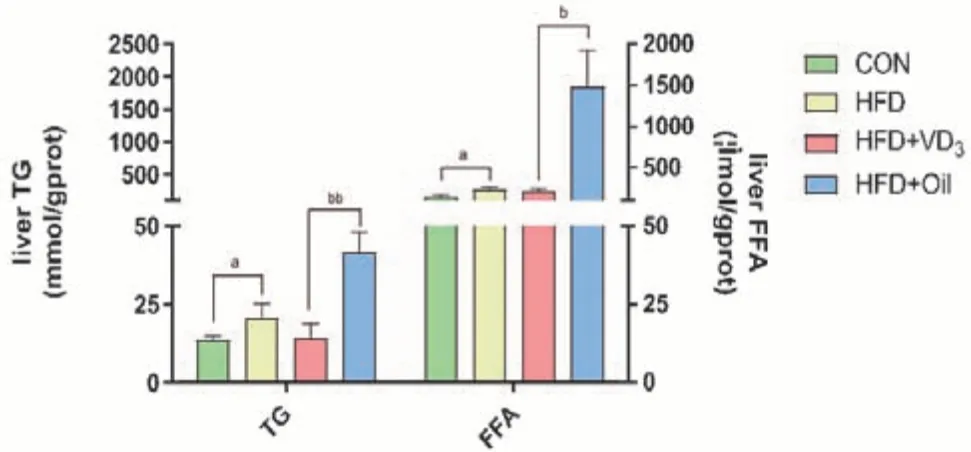
图8 维生素D3干预7 w对NAFLD大鼠肝组织TG、FFA含量的影响(,n=8)Figure 8 Effects of VD3 intervention for 7 w on TG,FFA level in liver tissue of NAFLD rats(,n=8)
2.2.4 维生素D3干预7 w对NAFLD大鼠肝功能的影响与CON 组相比,HFD 组血清AST、ALT 水平显著增高(P<0.05),AST/ALT 比值显著降低(P<0.05)。与HFD+Oil 组相比,HFD+VD3组血清AST、ALT 水平均明显降低(P<0.05),AST/ALT 比值略有上升但无统计学差异(P>0.05),见表5、图9~10。

图9 维生素D3干预7 w对NAFLD大鼠血清AST、ALT水平的影响(,n=8)Figure 9 Effects of VD3 intervention for 7 w on serum levels of AST and ALT in NAFLD rats(,n=8)
表5 维生素D3干预7 w对NAFLD大鼠血清AST、ALT、AST/ALT水平的影响(,n=8)Table 5 Effects of VD3 intervention for 7 w on serum levels of AST,ALT and AST/ALT in NAFLD rats(,n=8)
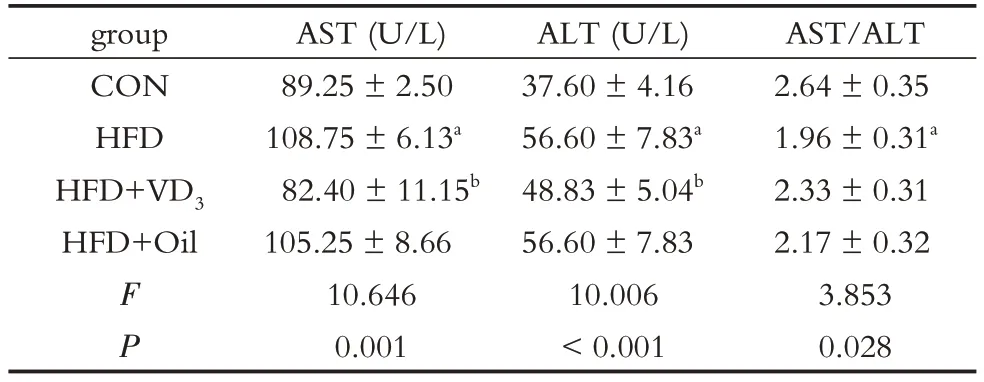
表5 维生素D3干预7 w对NAFLD大鼠血清AST、ALT、AST/ALT水平的影响(,n=8)Table 5 Effects of VD3 intervention for 7 w on serum levels of AST,ALT and AST/ALT in NAFLD rats(,n=8)
注:a 表示与CON组相比,P <0.05;b 表示与HFD+Oil组相比,P <0.05
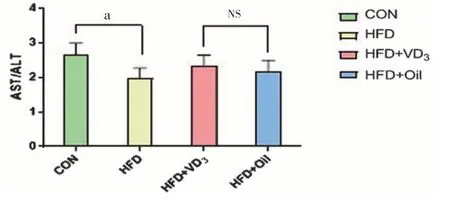
图10 维生素D3干预7 w对NAFLD大鼠血清AST/ALT水平的影响(,n=8)Figure 10 Effects of VD3 intervention for 7 w on serum levels of AST/ALT in NAFLD rats(,n=8)
2.2.5 维生素D3干预7 w对NAFLD大鼠血清维生素D的影响 与CON 组相比,HFD 组血清25(OH)D3水平显著降低(P<0.001)。与HFD+Oil 组相比,HFD+VD3组血清25(OH)D3水平显著升高(P<0.001),见表6、图11。
表6 维生素D3干预7 w对NAFLD大鼠血清25(OH)D3水平的影响(,n=8)Table 6 Effects of VD3 intervention for 7 w on serum levels of 25(OH)D3 in NAFLD rats(,n=8)

表6 维生素D3干预7 w对NAFLD大鼠血清25(OH)D3水平的影响(,n=8)Table 6 Effects of VD3 intervention for 7 w on serum levels of 25(OH)D3 in NAFLD rats(,n=8)
注:aa 表示与CON组相比,P <0.001;bb 表示与HFD+Oil组相比,P <0.001

图11 维生素D3干预7 w对NAFLD大鼠血清25(OH)D3水平的影响(,n=8)Figure 11 Effects of VD3 intervention for 7 w on serum levels of 25(OH)D3 in NAFLD rats(,n=8)
2.2.6 维生素D3干预7 w 对NAFLD 大鼠肝组织脂肪变性程度的影响CON 组肝组织未出现脂肪变性情况(0/4例),HFD组与HFD+Oil组所有大鼠均出现脂肪变性程度最高(3 级)的状态(4/4 例),HFD+VD3组所有大鼠均发生脂肪变性(4/4例),但程度不一。与CON组相比,HFD 组肝细胞炎症活动度显著提高(P<0.001)。与HFD+Oil 组相比,HFD+VD3组血清25(OH)D3水平显著降低(P<0.001),见表7。
表7 维生素D3干预7 w对NAFLD大鼠肝组织脂肪变性程度的影响(,n=4)Table 7 Effects of VD3 intervention for 7w on the degree of hepatic steatosis in NAFLD rats(,n=8)

表7 维生素D3干预7 w对NAFLD大鼠肝组织脂肪变性程度的影响(,n=4)Table 7 Effects of VD3 intervention for 7w on the degree of hepatic steatosis in NAFLD rats(,n=8)
注:aa 表示与CON 组相比,P <0.001;bb 表示与HFD+Oil 组相比,P <0.001
3 讨论
高脂饮食是NAFLD 发生发展进程中一个重要因素。本实验所采用的高脂饮食诱导建立NAFLD 大鼠模型属于营养失调性脂肪肝动物模型的一种,此方法成熟稳健、成模率高[12-14]。
1,25(OH)2D3是维生素D3的生物活性形式,由皮肤吸收或膳食摄取后经一系列转化再活化入血,进而作用于小肠、骨、肾等靶器官产生效应。队列研究[15]证实,血清维生素D 与众多血清脂质代谢产物存在强大的相关性。随着干预时间的延长,各组大鼠肝重、体重、肝指数与血清维生素D水平各有波动:HFD组除血清维生素D 浓度显著降低外,上述其余数值始终高于CON组;给予维生素D3干预后,该组大鼠血清维生素D浓度显著回升,肝指数显著降低,肝重与体重略有起伏但差异无统计学意义。上述结果表明非酒精性脂肪性肝病的确能够导致机体本身的维生素D3水平降低,而通过膳食干预补充适宜剂量的外源性维生素D3可以帮助恢复其在体内的水平,继而延缓疾病进程甚至扭转疾病转归。此外,外源性的维生素D3还能够在一定程度上缓解肝脏病变所致使的肝脏重量增加,这种重量的降低更多的发生于内脏而非全身,此现象与宋佳奇等[16]的研究结果不谋而合;而王锋[17]和张虹[18]等的研究发现,维生素D3还可以降低脂肪肝大鼠的体重,这与上述结论相悖。JAHN 等[19]的研究发现低剂量的维生素D 干预(500 IU/kg)联合高脂饮食能够显著提高大鼠肝重、体重及脂肪含量,而在高剂量干预(10 000 IU/kg)时上述指标均显著降低。究其原因,或许与维生素D3的给药剂量和时长密切相关:补充较大剂量维生素D3且时间较长情况下,可引起体重、脏器重量等减轻;而剂量和时间都相对较少的条件下,所得到的变化也就相对不显著,而两者间界限暂未可知。众多研究表明维生素D 缺乏与肥胖症密切相关,同时也可能通过下调肝脏内白介素6(IL-6)、肿瘤坏死因子α(TNF-α)的mRNA表达以抑制炎症,对NAFLD产生保护效应,但临床试验结果也如上述多项研究般不一致,故作用机制一直未被阐明确证[20]。
肝脏是机体代谢脂质的主要器官,在脂代谢过程中参与脂质摄取、储存、合成、代谢等,上述任意环节出现问题均可能引起脂质堆积、胰岛素抵抗(IR)、内质网应激等,继而诱发NAFLD[21-22]。维生素D3具有抗炎、抗纤维化、提高胰岛素敏感性等多种生物学活性[23],维生素D通过与其受体VDR结合而发挥生物学效应。余梦丽等[24]研究发现,VDR 缺乏可异常激活NF-κB 这一炎症介质引起机体多种炎症反应,同时可增加肠道肝螺杆菌(Helicobacter hepaticus,H.h)丰度及减少益生菌丰度而引起肠道菌群紊乱,进而加重肠道炎症反应、阻碍肠道对于食物的消化吸收进一步导致脂代谢紊乱。NANDI 等[25]研究发现,低维生素水平可以影响机体脂肪酸水平:增加肝脏和血浆中花生四烯酸和饱和脂肪酸等促进脂质生成的脂肪酸水平、降低血浆和肝脏中单不饱和脂肪酸等具有抗炎特性的脂肪酸水平。本研究中,维生素D3干预可显著降低NAFLD 大鼠血清TC、TG、LDL-C 水平及肝组织中TG、FFA 水平。即补充维生素D3同样可以降低FFA这类脂质合成原料的脂肪酸水平,与上述研究结论一致。故推测维生素D3参与调控脂质的合成与分解,在脂代谢紊乱时及时促进分解、抑制合成,逐渐调整回正常水平。
AST、ALT是专一性的转氨酶,主要存在于细胞内,在血清中活性很低,在肝细胞受损或细胞膜通透性增高的情况下即大量释放入血,造成血清中转氨酶活性明显升高[26-27],故血清AST、ALT、AST/ALT 水平常作为判断肝功能是否正常的指标[28]。本研究中HFD组大鼠血清AST、ALT、AST/ALT水平均显著高于CON组,提示肝细胞内皮损伤、肝功能异常,印证了上述肝细胞受损后转氨酶水平显著提高的结论[6,12]。进行维生素D3干预后,血清AST、ALT 水平显著降低,表明紊乱的肝功能得到了调整和改善,提示维生素D3对肝脏具有良好的损伤修复意义。
在维生素D3较大剂量和较长时间干预下不仅能降低NAFLD大鼠肝重,还能延缓体重的增长速度,提示维生素D3对机体代谢、脂质代谢及肝细胞损伤修复的积极调节作用。这与现有研究中病人机体血清25(OH)D3水平与脂肪肝病变严重程度呈负向相关的结论大体吻合[29],但仍出现了如对体重无显著性改变等阴性结果。由于体重、病理形态改变、炎症性变化等均属于宏观表现,是在脂代谢异常量变积累后引起的质变,猜测在尚未表现出明显症状、体征的大鼠体内可能存在基因、分子等微观层面的细小量变,后续可通过检测上述更深层次的结构探索维生素D3对NAFLD 的改善治疗机制。
4 结论
维生素D3经膳食干预能顺利对NAFLD 模型大鼠发挥效应,达到降低血清及肝组织脂质水平、阻止AST、ALT 大量入血引起血清转氨酶活性升高的作用,同时还能降低肝脏组织脂肪变性程度、改善炎症。
(利益冲突:无)

