斑马鱼SDC4基因的克隆与遗传进化分析
崔 佳 温 炟 陈广信 吴长新
Syndecans(SDCs)是细胞表面的一类硫酸乙酰肝素跨膜糖蛋白(Heparan sulfate proteoglycan, HSPG),该家族蛋白有4个结构相似成员(Syndecan-1-4)[1],广泛参与骨肉瘤、乳腺癌、胰腺癌、原发性肝癌等人类肿瘤的发生和发展[2]。SDC4作为SDCs家族中的重要蛋白,主要由胞外区、跨膜区和胞质内区域构成[3]。不同于SDC1-3在上皮细胞、神经元细胞、平滑肌细胞等特异性的细胞表达[4-5],SDC4在多种细胞中广泛表达,主要调节细胞骨架重塑、细胞增殖、细胞黏附和迁移的过程[6-7]。此外,SDC4参与多种病毒和细菌病原体的感染过程,被发现在调控炎症相关的细胞生物学过程中发挥重要作用并且与许多炎症性疾病发生有关[8-10]。但这些仅仅局限于哺乳动物的研究中,对于非哺乳动物如斑马鱼中SDC4介导的生物学功能则鲜有研究。HOFMEISTER等[11]揭示了SDC1-4四种家族蛋白在斑马鱼胚胎期脑部发育的表达模式相异,推测SDC1-4可能在斑马鱼体内有不同的生物学功能。LUO等[12]通过原位杂交研究发现SDC4在斑马鱼胚胎期广泛表达,并且影响斑马鱼胚胎神经发生过程中神经细胞的增殖。本文对斑马鱼SDC4 基因进行克隆并测序验证,分析其在斑马鱼胚胎发育前10 d的表达量差异,并且对斑马鱼SDC4、人SDC4和鼠SDC4的染色体基因连锁性与氨基酸同源性做出分析,同时构建系统发生树,为后续斑马鱼中SDC4基因功能分析奠定分子生物学基础。
1 材料与方法
1.1 质粒
pCS2+质粒(山西大学生物医学研究院保藏)。
1.2 动物
野生型斑马鱼AB、TU品系购自于国家斑马鱼资源中心(CZRC)。
1.3 主要试剂与仪器
NEBuilder HiFi Assembly Mix购自于New England Biolabs(北京)有限公司,Prime STAR Max、PrimeScript RT Master Mix反转录试剂盒购自于TaKaRa大连宝生物公司,2хRealtime PCR super SYBRgreen mix 购自于北京聚合美生物科技有限公司。
1.4 AB、TU野生型斑马鱼品系基因组全长cDNA的制备
选取发育良好的斑马鱼卵或胚体各约50个,分别置于1.5 mL的离心管(RNase free)中, 先用RNase free ddH2O 清洗3遍,再加入Trizol 溶液后组织破碎混匀,然后用三氯甲烷、异丙醇提取RNA,最后根据反转录试剂盒说明书将RNA反转录为cDNA后待用。
1.5 斑马鱼SDC4 基因的克隆
根据ensemble斑马鱼SDC4 CDS信息设计引物,上游引物为:5′-ttt gca gga tcc agc cac cAT GTT GAA AGT TTA CCT CAT G-3′,下游引物为:tgc tca cag atc cac ctc cac cTG CGT AGA TTT CTG TGG TTG GAG-3′(引物中小写字母为载体同源臂序列,大写字母为SDC4 CDS 序列),之后以受精后3 d 的TU斑马鱼基因组全长cDNA为模板进行PCR扩增,扩增产物用1.0% 琼脂糖凝胶电泳进行检测并回收。利用Gibson酶(NEBuilder HiFi Assembly Mix)将克隆的斑马鱼SDC4 CDS区与pCS2+质粒进行组装,转化入大肠杆菌DH5α中,得到的菌落阳性克隆子送往上海生工生物工程股份有限公司进行测序。
1.6 斑马鱼SDC4基因在AB、TU野生型品系中的mRNA表达量分析
设计用于qPCR的斑马鱼SDC4基因引物,上游引物为:5′-GCT CTG ATT GTG GGT GGC A-3′,下游引物为:5′-TTG GTG GGG GCT TTC TTG T-3′。内参基因选用β-actin,上游引物为:5′-CTC TTC CAG CCT TCC TTC CT-3′;下游引物为:5′-CAC CGA TCC AGA CGG AGT AT-3′。根据Realtime PCR super SYBRgreen mix试剂盒说明书配制反应体系并设置反应条件,数据处理采用与内参基因归化后用2-ΔΔCt计算。
1.7 斑马鱼SDC4基因的生物信息学分析
在ensemble和NCBI网站得到各物种SDC4 的染色体连锁基因信息和蛋白氨基酸序列,利用MegAlign软件中Clustal W方法进行氨基酸多重序列比对,并且用MEGAX软件中N-J邻接计算方法构建系统发生树。
1.8 统计学方法
运用Graphpad Prism 7.0软件对组间数据进行Student’s unpairedt-test 检验,以P<0.05为差异有统计学意义,“NS”为差异无统计学意义。
2 结果
2.1 斑马鱼SDC4基因克隆测序结果分析
通过PCR克隆技术获得斑马鱼SDC4基因的全长cDNA序列,根据测序结果显示,斑马鱼SDC4 CDS区已经成功重组入 pCS2+ 载体(见图1)。图1是载体与目的基因的5′ 与3′ 端接合位点部分测序峰图,加下划线碱基表示 pCS2+ 载体序列,未加下划线碱基表示SDC4基因序列。为了确保插入的SDC4基因能够准确表达,Kozak序列(gccacc)被选择插入目的基因起始密码子前(见图1),同时鉴于pCS2+载体中存在绿色荧光蛋白(GFP)基因,SDC4基因终止密码子在插入载体时被剔除(见图2)。

图1 pCS2+-SDC4重组载体中SDC4 CDS区5’端部分测序峰图Fig.1 Sequencing peaks figure of the 5' end of the SDC4 CDS region in the pCS2+- SDC4 recombinant vector

图2 pCS2+-SDC4重组载体中SDC4 CDS区3′端部分测序峰图Fig.2 Sequencing peaks figure of the 3' end of the SDC4 CDS region in the pCS2+- SDC4 recombinant vector
2.2 SDC4基因在AB、TU野生型斑马鱼中的表达
检测受精后1 d(1 day post-fertilization, 1 dpf)即体节发育完成期与受精后3 d(3 dpf)即幼体形成期的野生型AB、TU斑马鱼中SDC4mRNA表达情况,qRT-PCR数据结果显示:SDC4基因在野生型斑马鱼受精后前3 d无明显的差异表达[n=3,P(1 dpf)=0.808,P(3 dpf)=0.550,见图3]。
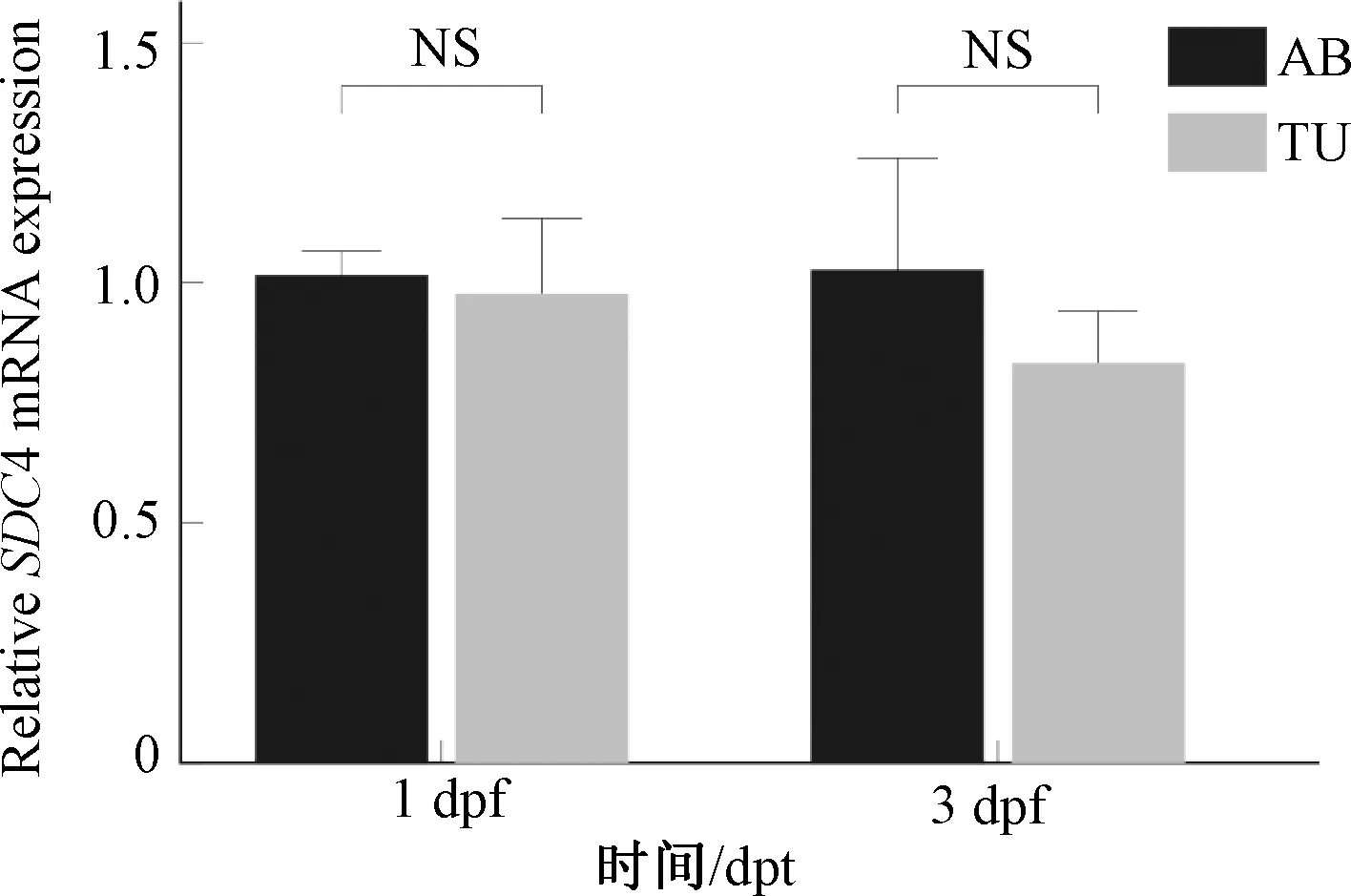
注:NS表示与AB组比较P>0.05图3 斑马鱼SDC4基因在AB与TU品系中的相对表达量Fig.3 The relative expression of zebrafish SDC4 gene in AB and TU strains
2.3 SDC4基因在TU野生型斑马鱼中的时间表达分析
通过qRT-PCR检测斑马鱼胚胎发育的前10 d内SDC4 mRNA随时间变化的趋势,SDC4 mRNA 在1 dpf 较2 dpf、3 dpf、4 dpf有相对高的表达量,差异有统计学意义[n=3,P(2 dpf)=0.015,P(3 dpf)=0.001,P(4 dpf)=0.012]。见图4。推测斑马鱼SDC4表达可能存在一定程度的母系遗传控制,但是随后SDC4 mRNA的表达量在5 dpf、6 dpf、8 dpf、10 dpf较1 dpf差异无统计学意义[n=3,P(5 dpf)=0.139,P(6 dpf)=0.998,P(8 dpf)=0.117,P(10 dpf)=0.929]。

注:*表示与1 dpf组比较P<0.05,NS表示与1 dpf组比较P>0.05图4 SDC4基因在斑马鱼胚胎发育前10 d的mRNA表达量Fig.4 Temporal expression pattern of zebrafish SDC4 gene during the first ten days embryonic development
2.4 斑马鱼SDC4、人SDC4、小鼠SDC4基因染色体连锁性分析
通过ensemble和NCBI网站可知:斑马鱼SDC4、人SDC4和小鼠SDC4基因分别位于3号、20号和2号染色体,染色体连锁基因座位示意图分析显示:人SDC4和小鼠SDC4基因位置附近的连锁基因保持了较高的相似性,但斑马鱼SDC4基因较人SDC4和小鼠SDC4的连锁基因仅MATN4与RBPJL相似(见图5)。

图5 人SDC4、小鼠SDC4和斑马鱼SDC4基因的染色体连锁基因座位图Fig.5 The chromosomally syntenic analysis diagram of human SDC4, murine SDC4 and zebrafish SDC4 genes
2.5 斑马鱼、人、小鼠SDC4氨基酸序列比对
将斑马鱼SDC4、人SDC4、小鼠SDC4氨基酸序列进行同源性比对(见图6),结果显示:斑马鱼SDC4 与人SDC4、小鼠SDC4的同源性分别为38.3%、44.2%,而人SDC4与小鼠SDC4 的同源性高达82.4%。图6显示各物种中的SDC4 蛋白在C末端即胞质内区域(Cytoplasmic domain,CD)有高的同源性:人与小鼠SDC4蛋白CD区(residues 171-198)完全一致,与斑马鱼SDC4 蛋白CD区(residues 200-207)同源性为85.70%。

图6 斑马鱼SDC4 与人、小鼠SDC4的氨基酸序列比对Fig.6 Multiple sequence alignment of zebrafish SDC4 with human and murine SDC4
2.6 SDC4蛋白的进化树分析
为了诠释SDC4蛋白在物种中的进化地位,选取了15种典型生物构建系统发生树,其中包括5种鱼类动物(Astyanaxmexicanus、Astatotilapiacalliptera、Amphiprionocellaris、Amphiprionpercula、Daniorerio)、1种爬行类动物(Aquilachrysaetoschrysaetos)与9种哺乳类动物(Bosgrunniens、Bostaurus、Canislupusfamiliarisgreatdane、Balaenopteramusculus、Canislupusfamiliarisgreatdane、Aotusnancymaae、Homosapiens、Musmusculus、Aquilachrysaetoschrysaetos)。图7所示的系统发生树基本上能够反映出物种的进化关系,相较于哺乳动物和爬行动物,斑马鱼SDC4与其他4种鱼类动物被分在了同一簇。此外,通过系统发生树揭示的物种亲缘关系可知,斑马鱼SDC4 蛋白在进化中是保守的,且是人类和其他物种SDC4的直系同源基因(见图7)。
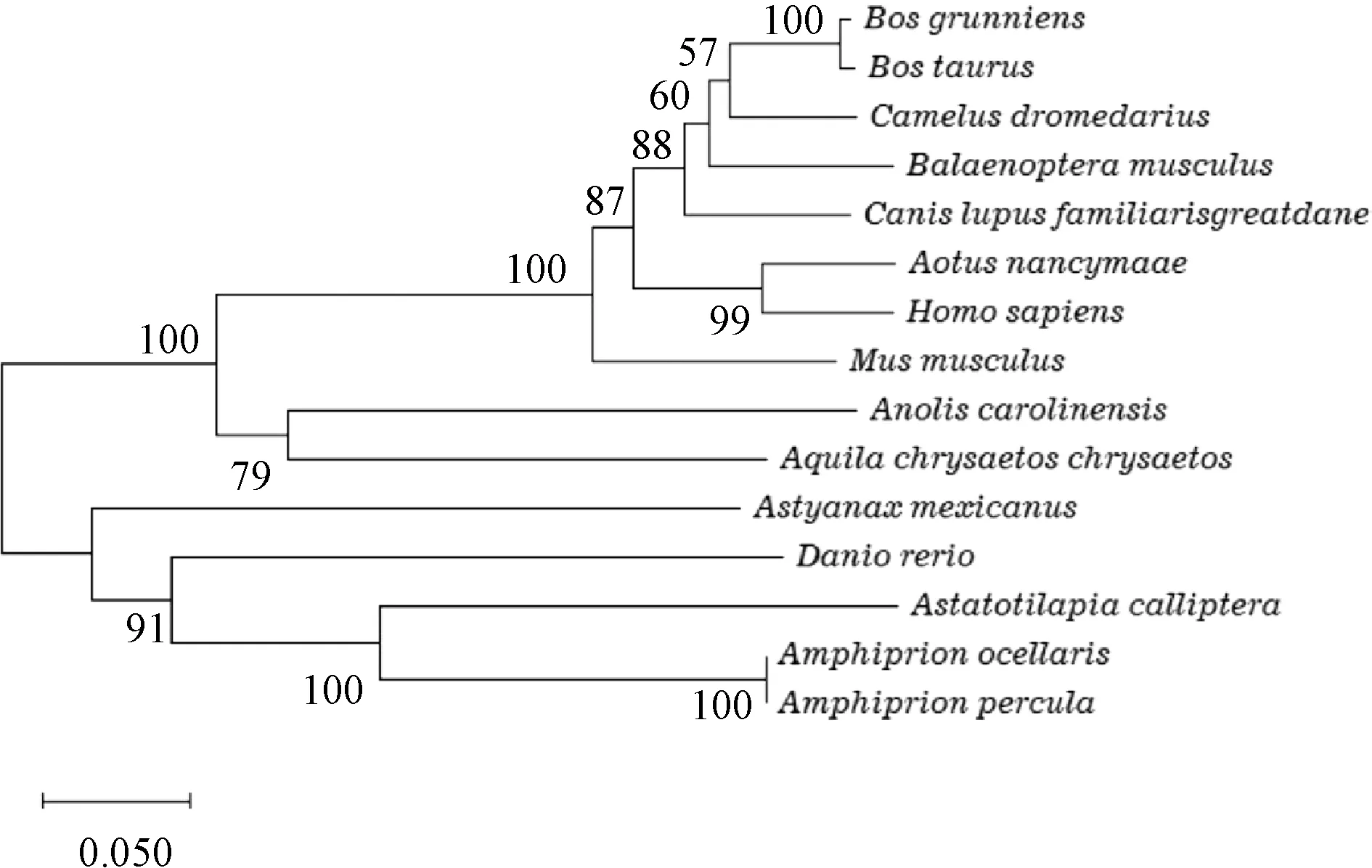
注 部分物种SDC4 UniPro蛋白数据库:Bos taurus (E1BKS1)、Camelus dromedarius(A0A4U5S0B1)、Midas cichlid (A0A3Q0S4P1)、Astyanax mexicanus(A0A3B1K6Y0)、Canis lupus familiarisgreatdane(J9NZ79)、Aotus nancymaae (A4K2X3)、Homo sapiens (P31431-1)、Mus musculus (Q35988)、Anolis carolinensis (A0A3Q1APH0)、Astatotilapia calliptera (A0A3P8PRI7)、Amphiprion percula (A0A3P8UAL5)图7 SDC4蛋白系统进化树分析Fig.7 A phylogenetic tree of SDC4 was constructed based on 15 organisms
3 讨论
SDC4是SDCs家族中重要的跨膜糖蛋白,哺乳动物SDC4蛋白研究较多地集中于细胞骨架与细胞增殖等方面,并且与某些肿瘤的形成发生相关,但是关于斑马鱼SDC4 研究则较少。目前,斑马鱼作为一种新兴的模式动物,在动物发育、疾病发生、免疫调节与药物筛选等研究方向得到了广泛的应用,加之近年来CRISPR基因编辑等反式遗传学手段的兴起,使越来越多的人类基因功能在斑马鱼中得到了验证[13-15]。本研究首先从TU野生型斑马鱼基因组cDNA中扩增了SDC4基因,测序结果显示与ensemble 网站中公布的TU斑马鱼SDC4基因序列(ENSDART00 000 083 830.5)完全一致(部分序列见图1),这为后续从反式遗传学角度在斑马鱼体内开展SDC4基因过表达、敲除或回补等实验提供了基础的分子生物学信息与材料。根据qRT-PCR结果显示,SDC4基因在1 dpf、3 dpf两个时间的斑马鱼AB和TU之间mRNA表达量基本一致,提示SDC4在实验室常用AB、TU野生型斑马鱼品系的早期胚胎发育关键阶段有相似的表达量,为后续在此两种品系中开展斑马鱼SDC4功能研究提供了基本分子生物学信息。分析斑马鱼胚胎发育期前10 d的SDC4 mRNA表达模式发现,SDC4的表达量受到一定程度的母系遗传控制,但是关于SDC4在成鱼中的表达模式及其功能需要在后续研究中进一步挖掘解释。基因染色体连锁性分析发现,人SDC4和小鼠SDC4基因有高度保守的染色体连锁性,但是斑马鱼SDC4的连锁基因已经表现出与人和小鼠的差异性。SDC4蛋白氨基酸序列比对显示:SDC4蛋白在不同物种之间有一定的保守性,但是相较于人和小鼠SDC4之间的高同源性,斑马鱼SDC4与人、小鼠SDC4的同源性则较低。因此,通过基因染色体连锁性和蛋白氨基酸序列比对发现,斑马鱼SDC4与哺乳动物SDC4虽然存在分子进化保守性,但也表现出一定程度的分子遗传差异性,进而思考斑马鱼SDC4与哺乳动物SDC4蛋白功能之间是否存在异同点。其次,根据蛋白序列中CD区的保守性,是否可以推测斑马鱼SDC4在胞内接头蛋白与信号通路激活等方面与哺乳动物细胞内相似,这些假设我们将在后期研究中展开调查。此外,本研究得到的SDC4 系统发生树有一定合理性,为推演斑马鱼SDC4的功能和进化机制提供了信息基础,但由于系统发生树中氨基酸序列数目不多、代表物种数量较少,因此得到的SDC4系统发生树只能在大体上反应近缘物种遗传物质的相似性,更多深层次的遗传进化关系需要我们进一步探究。
综上所述,本研究克隆了斑马鱼SDC4基因,并对其mRNA在不同野生型斑马鱼中的差异表达量和在胚胎发育早期随时间表达量进行了分析,之后对斑马鱼SDC4进行了基因连锁性、蛋白同源性和进化树分析,本研究为后续研究斑马鱼SDC4功能提供了基础生物材料并奠定了分子遗传学理论基础。

