香菇多糖联合奥沙利铂对EC109细胞增殖作用的研究
王微微 刘 宇 张彩云 王 丹 孙环环 霍小蕾
食管癌(Esophageal cancer,EC)是位居我国癌症发病率第4位的一种恶性肿瘤,具有恶性程度高、易转移、预后差等特点[1]。由于缺乏有效的早期诊断方法,许多患者初次诊断即为晚期,并常伴有淋巴结或远处转移[2]。在临床治疗中,首选治疗手段是手术切除和辅助化疗;对于不可手术切除的患者,全身化疗是一种关键的治疗方法[3]。铂类化疗药物单独或与其他药物联合使用,已被批准用于临床治疗[4]。奥沙利铂是治疗食管癌常用的铂类化疗药物,并可引发免疫原性细胞死亡[5-6],但化疗会引起严重的副作用和肿瘤耐药,最终可能导致化疗失败[7]。因此,寻找新型的可用于联合化疗的药物,是提高食管癌化疗疗效的关键。
随着医疗技术水平的发展,从植物中提取的天然产物联合临床药物已经越来越多的用于治疗多种癌症并发挥了重要作用,如喜树碱[8]、香菇多糖、长春花碱[9]等。香菇多糖(Lentinan,LNT)作为一类从香菇中分离的重要天然产物,是香菇中最主要和有效的生物活性成分,有研究称,香菇多糖具有抗肿瘤[10]、抗病毒[11]、抗氧化、降血糖血脂和免疫调节等多种生物活性且毒性较低[12],并已在临床治疗中作为免疫增强剂初步使用。香菇多糖与奥沙利铂(Oxaliplatin,OXA)的联合应用未见报道,本研究通过香菇多糖联合奥沙利铂作用于食管癌EC109细胞,探索其能否发挥协同增效作用,为增加香菇多糖的临床应用提供新的理论依据及实验基础,也为开发植物多糖抗肿瘤药物提供新的研究方向。
1 材料与方法
1.1 材料
细胞株:人食管癌细胞EC109(中国医学科学院协和细胞库)。药品与试剂:香菇多糖(Adooq Bioscience),奥沙利铂(山东罗欣药业集团股份有限公司),RPMI-1640培养基(美国Gibco公司),10%胎牛血清(浙江天航生物科技股份有限公司),100×青链霉素混合液(上海生工生物工程有限公司),MTT粉末(北京索莱宝科技有限公司),细胞周期检测试剂盒(上海碧云天生物科技有限公司),细胞凋亡检测试剂盒(康为世纪)。仪器:流式细胞仪(美国BD),全波长酶标仪(瑞士TECAN),二氧化碳培养箱(美国Thermo),研究级倒置式荧光显微镜(日本Nikon)。
1.2 方法
1.2.1细胞培养 人食管癌EC109细胞培养于含100 U·mL-1青链霉素和10%胎牛血清的RPMI-1640完全培养基中,置于5%CO2、37 ℃的恒温培养箱。
1.2.2MTT实验 取对数生长期的EC109细胞,以每孔5 000个接种于96孔板,待细胞贴壁,每孔中加入对应浓度的药物共培养24 h和48 h,后在每孔中加入10 μL的0.5 mg·mL-1MTT溶液于37 ℃孵育4 h,弃上清加150 μL的DMSO,最后用酶标仪在570 nm波长下测吸光度值(OD)。
1.2.3联合给药作用分析方法 采用Chou-Talalay联合用药指数法,用compusyn软件分析两药联用的最佳作用浓度。若CI<1,两药具协同作用,值越小协同作用越强;若CI=1,具累加效应;若CI>1,具拮抗作用,值越大拮抗作用越强。
1.2.4显微镜观察细胞形态和数量 取对数生长期的细胞铺板加药,NC组、OXA组(20 μg·mL-1)、LNT组(1 200 μg·mL-1)、LNT+OXA组(1 200 μg·mL-1+20 μg·mL-1),培养24 h,显微镜观察并拍照。
1.2.5细胞周期检测 选用细胞周期试剂盒检测细胞周期。取细胞铺板,处理同1.2.4,培养24 h后收集细胞,按照试剂盒操作步骤进行实验,用流式细胞仪检测分析。
1.2.6细胞凋亡检测 利用Annexin V-FITC/PI双染试剂盒检测细胞凋亡。取细胞铺板,处理同1.2.4,按照试剂盒操作步骤进行实验,用流式细胞仪检测分析,使用Flowjo软件分析数据,计算凋亡率。
1.3 统计学方法
取3次重复实验结果,实验数据均使用SPSS软件进行统计分析,计量资料采用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 LNT和OXA对EC109细胞增殖的影响
不同浓度的LNT和OXA对EC109细胞的增殖均具抑制效应,呈剂量依赖性,差异有统计学意义,见图1。
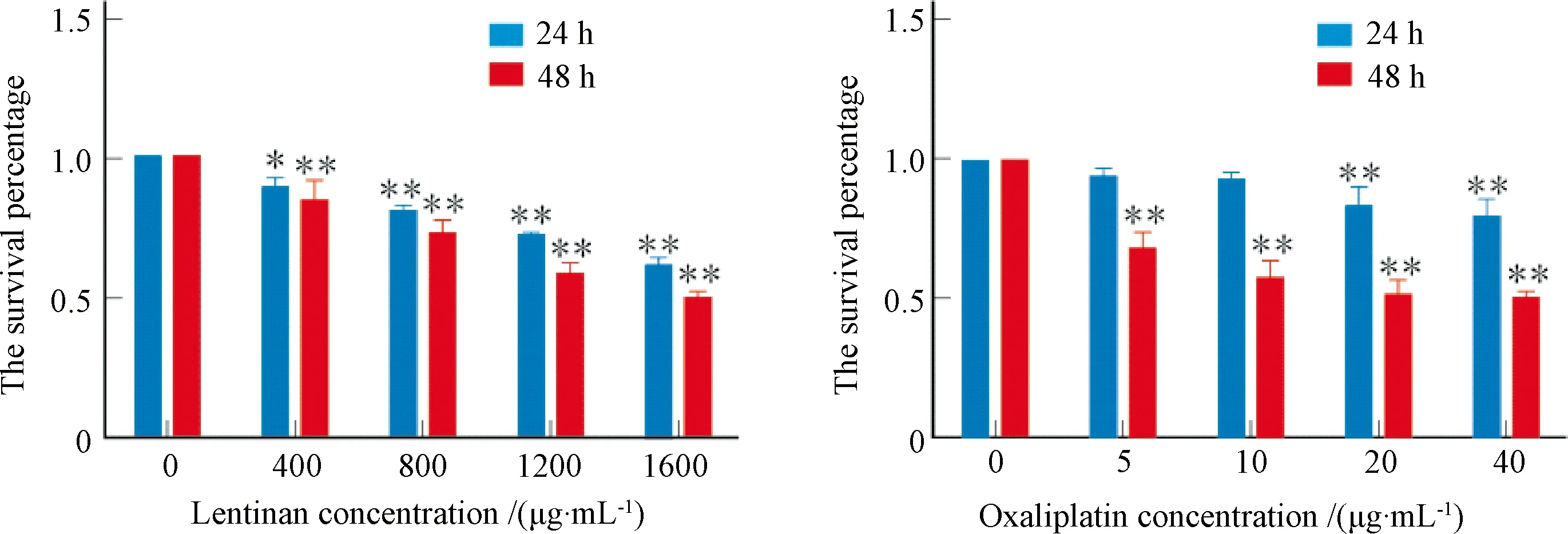
注:*P <0.05, ** P<0.01图1 香菇多糖和奥沙利铂对EC109细胞增殖的影响(n=3)Fig.1 Effect of lentinan and oxaliplatin on proliferation EC109 cells(n=3)
2.2 LNT与OXA联合用药浓度的确定
采用Chou-Talalay联合用药指数法,分别用浓度为0、400、800、1 200 μg·mL-1的LNT和浓度为0、5、10、20、40 μg·mL-1的OXA联合处理EC109细胞,经Compusyn分析(见图2、表1),LNT+OXA组多数呈现CI<1的协同抑增殖作用;部分呈现CI>1的拮抗作用。因此选择CI值最小的时间浓度组合:24 h的LNT(1 200 μg·mL-1)和OXA(20 μg·mL-1)联用进行后续实验。
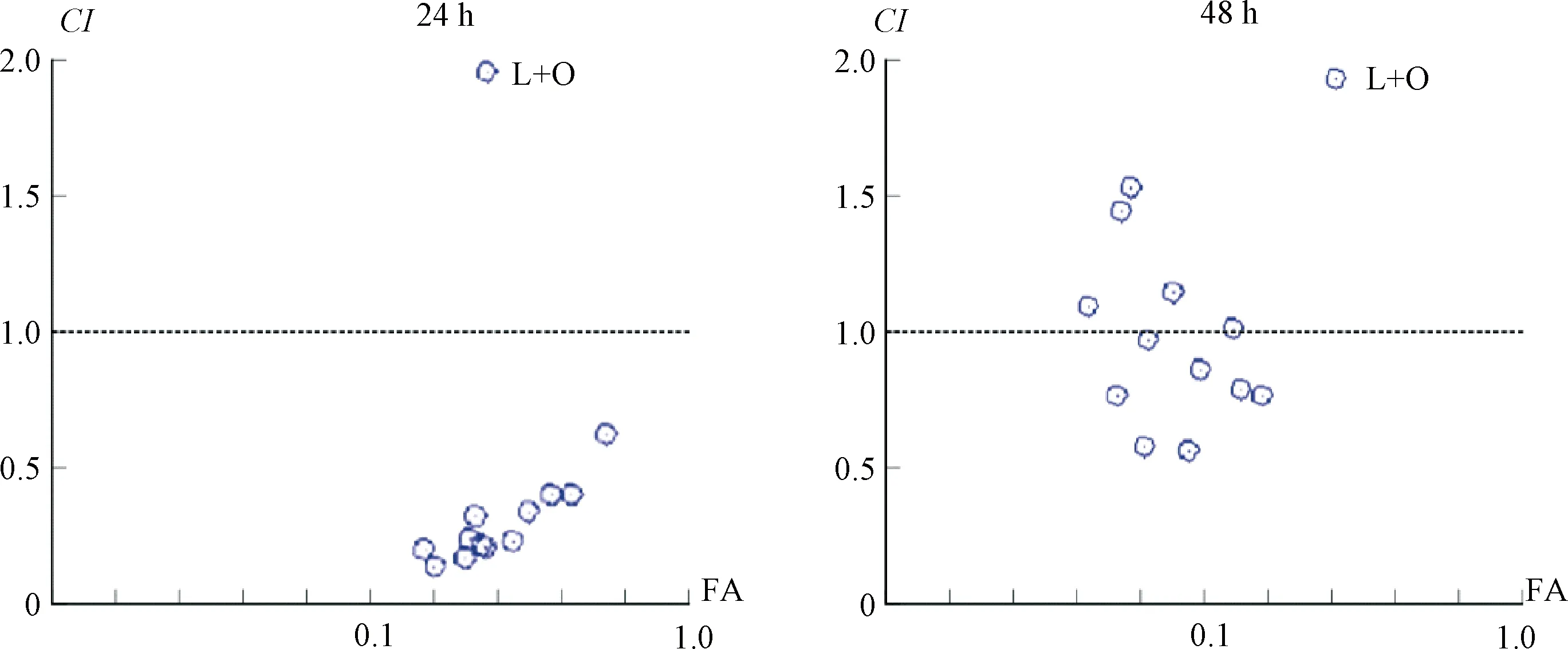
(CI<1,协同作用;CI=1,累加效应;CI>1,拮抗作用)图2 Compusyn分析LNT联合OXA对EC109细胞的影响(L代表LNT,O代表OXA)Fig.2 Compusyn analyzed the effect of LNT combined with OXA on EC109 cells
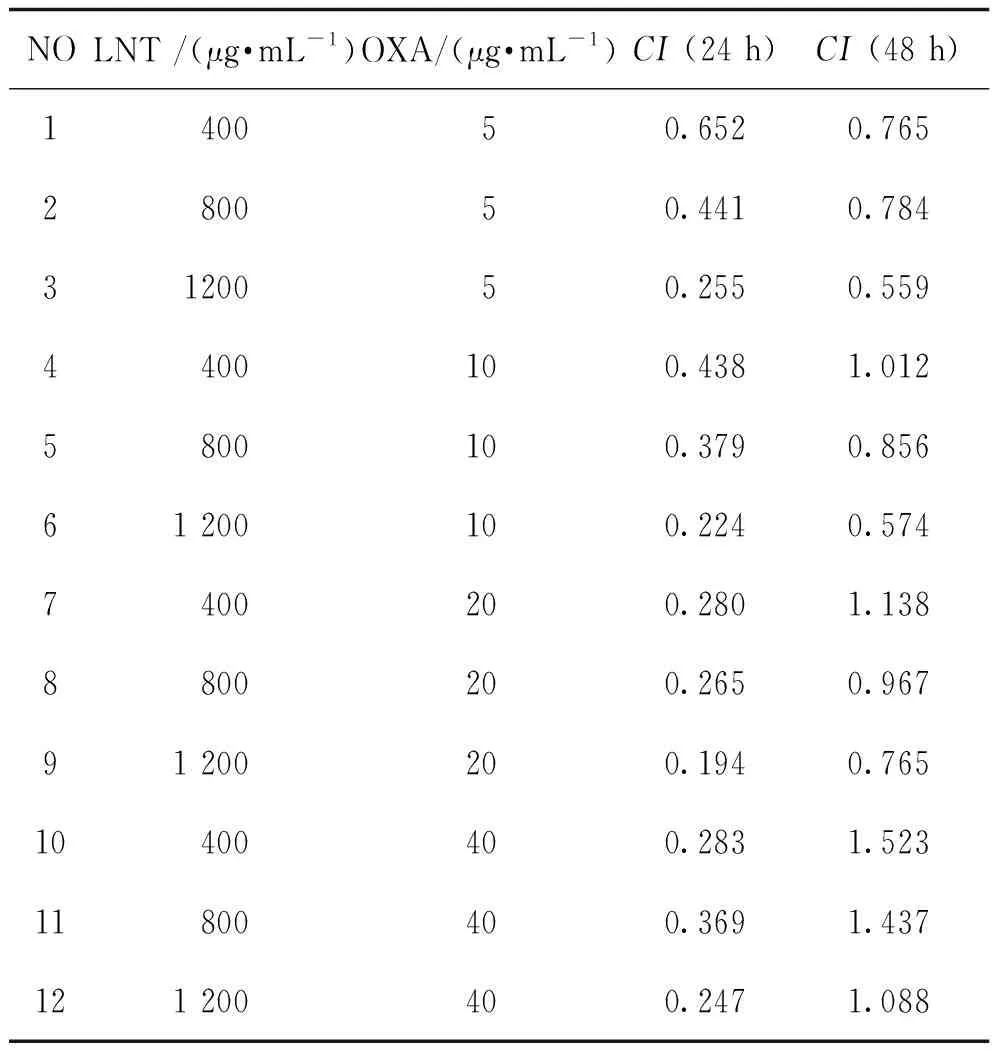
表1 Compusyn分析LNT联合OXA的CI值
2.3 LNT联合OXA对EC109细胞形态学的影响
NC组、OXA组、LNT组、LNT+OXA组处理EC109细胞24 h后,NC组细胞数量多且形态完整,细胞大小均一且密集铺展生长;OXA组细胞数量显著减少,体积变大,且部分呈圆珠状;LNT组细胞数量显著减少,部分细胞贴壁能力降低;LNT+OXA组细胞数量显著更少,体积相对较大。见图3。
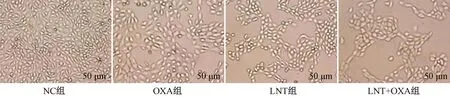
图3 LNT联合OXA对EC109细胞形态的影响Fig.3 Effect of LNT combined with OXA on morphology of EC109 cells
2.4 LNT联合OXA对EC109细胞增殖的影响
NC组、OXA组、LNT组、LNT+OXA组处理EC109细胞24 h后,与OXA组和LNT组相比,LNT+OXA组抑增殖作用明显增强。见图4。
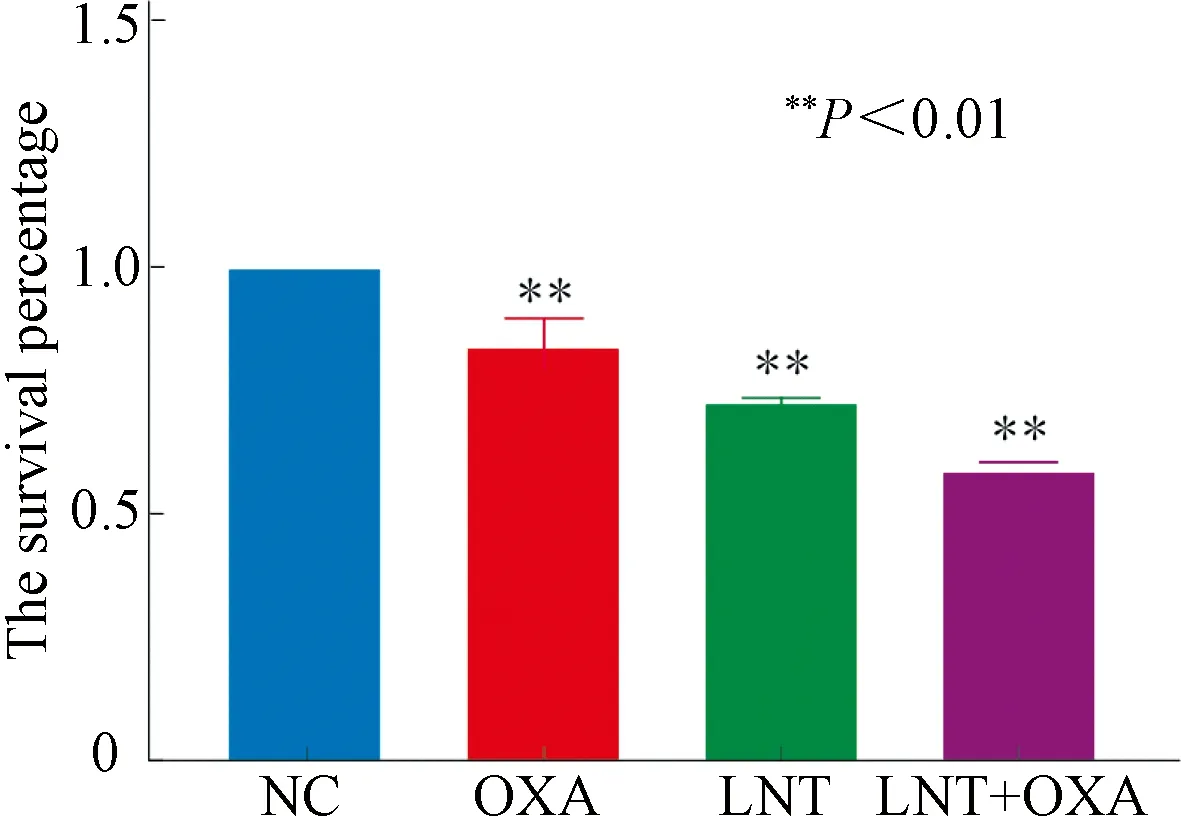
图4 LNT联合OXA对EC109细胞增殖的影响(n=3)Fig.4 Effects of LNT combined with OXA on EC109 cell proliferation(n=3)
2.5 LNT联合OXA对EC109细胞周期的影响
NC组、OXA组、LNT组、LNT+OXA组处理EC109细胞24 h后,与NC组比较,OXA组S期细胞显著增多;LNT组G1期细胞显著增多;LNT+OXA组G2期细胞增多。见表2、图5。
表2 LNT联合OXA对EC109细胞周期的影响Tab.2 Effects of LNT combined with OXA on EC109 cell
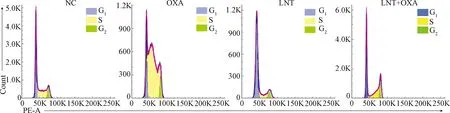
图5 LNT联合OXA对EC109细胞周期的影响Fig.5 Effects of LNT combined with OXA on EC109 cell cycle
2.6 LNT联合OXA对EC109细胞凋亡的影响
NC组、OXA组、LNT组、LNT+OXA组处理EC109细胞24 h后,与NC组、OXA组、LNT组相比,LNT+OXA联用组细胞凋亡率升高,主要表现在晚期凋亡,即Q3,差异有统计学意义。见表3、图6。
表3 LNT联合OXA对EC109细胞凋亡的影响
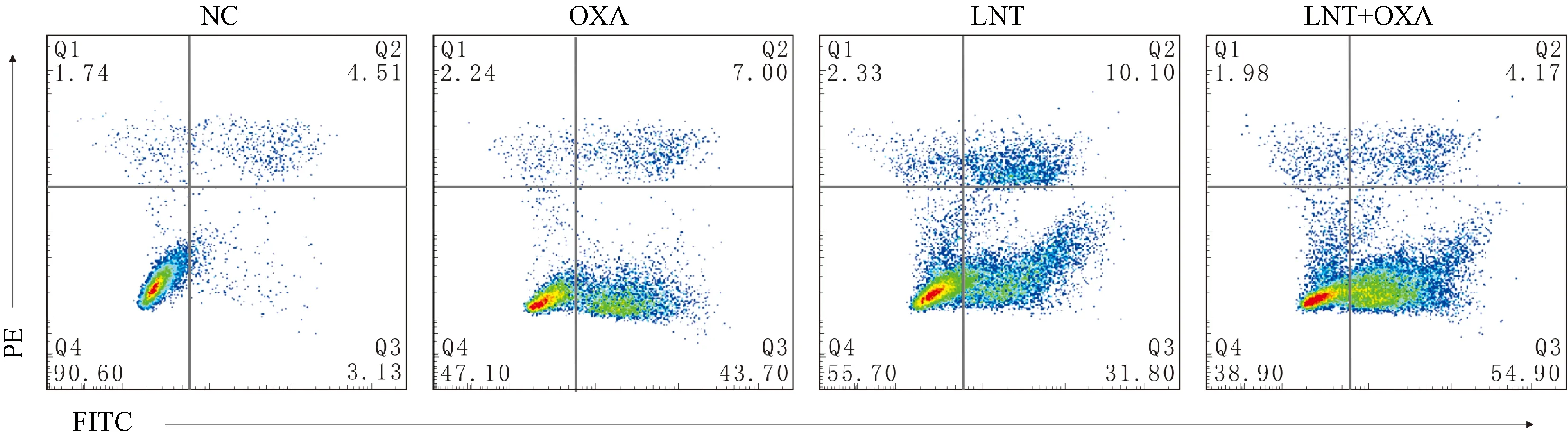
图6 LNT联合OXA对EC109细胞凋亡的影响Fig.6 Effects of LNT combined with OXA on apoptosis of EC109 cells
3 讨论
香菇多糖是从食用香菇中分离出的高分子多糖,随着中医中药越来越受到关注,中药制剂常被用来辅助治疗多种疾病。有报道称,香菇多糖对人神经胶质瘤细胞SHG-44[13]、人肝癌细胞HepG2[14]、人乳腺癌细胞MCF-7[15]等均有不同程度的抑增殖作用,并可作为辅助剂与化疗药物联合使用[16],发挥抗肿瘤作用。奥沙利铂是常用的铂类化疗药物,并与其他药物联合使用,但化疗耐药极大的制约了食管癌患者整体生存率。在本研究中,探讨了LNT联合OXA对人食管癌细胞EC109的协同作用。
本研究结果显示,LNT和OXA对EC109细胞的抑增殖作用呈现剂量依赖性;与LNT或OXA组相比,LNT+OXA组抑制细胞增殖作用更显著;Compusyn分析发现,LNT与OXA联用在多数浓度组合具有协同抑增殖作用。同时通过显微镜观察,两药联用使EC109细胞数量明显减少,体积变大。流式细胞术检测发现,LNT阻滞EC109细胞于G1期,OXA阻滞EC109细胞于S期,LNT+OXA组阻滞在G2期,表明两药联合可能通过调控细胞周期来抑制细胞增殖。流式细胞术检测细胞凋亡表明,LNT+OXA组引起EC109细胞凋亡的能力更强。
综上所述,LNT与OXA联合用药具有协同抑增殖促凋亡作用,与细胞周期G2期阻滞有关。同时,近年研究报道,香菇多糖可引起人结直肠癌上皮细胞SW837[17]、人肺腺癌细胞A549[18]的免疫原性细胞死亡相关分子的表达升高。也有研究表明,奥沙利铂可增强人和小鼠肝癌细胞的免疫原性细胞死亡相关生物标记物的表达[19],也可促进CD8+T细胞的增加和未成熟树突状细胞(DC)趋于成熟[5]。因此,香菇多糖和奥沙利铂联用对免疫原性细胞死亡的影响值得更深入的探索,生物活性多糖和奥沙利铂的联合应用在食管癌的临床应用研究中占有重要作用,在未来识别具有诱导免疫原性细胞死亡的抗肿瘤药物也具有重要的研究价值。

